农药对蜜蜂的影响及毒理学机制研究进展
2022-10-25齐素贞薛晓锋邱立红
张 伟, 齐素贞, 薛晓锋, 邱立红*,
(1. 中国农业大学 理学院 应用化学系,北京 100193;2. 中国农业科学院 蜜蜂研究所,北京 100093)
农药是重要的生产资料,在农林业生产的病虫草等有害生物防治中发挥着重要作用。农药的使用不仅提高了蔬菜、水果和粮食的产量和品质,还解放了农业生产力[1]。然而农药的广泛及不合理使用会导致农药残留加重,对生态环境中的非靶标生物产生不利影响。
非靶标昆虫蜜蜂是世界范围内最具有经济价值的授粉者[2],其种类包括已被人类驯化管理的,如意大利蜜蜂Apis mellifera、中华蜜蜂Apis cerana、熊蜂Bombus terrestris和大多数独居蜂,此外还有大量野生蜜蜂。不同种蜜蜂具有不同的生物学特性,如意大利蜜蜂等群居蜂以群体为单位组成蜂群,一个蜂群包含一只蜂王、几百只雄蜂和数万只不育的工蜂,它们之间分工合作,完成筑巢、哺育后代和觅食工作[3];独居蜂则由雌蜂独自筑巢哺育后代[4]。各生物之间相互协调、相互作用构成的生态系统是人类社会赖以生存和发展的基础,蜜蜂在维持植物多样性和生态系统的稳定性方面发挥着重要作用[5-6]。蜜蜂的异花授粉可为植物提供比自花授粉更大的后代遗传变异,由此使得植物有更多机会产生新的品种,从而更能够适应新的环境并占据不同的生态位[7]。同时蜜蜂与人类也有着密切的联系,可为人类提供蜂蜜、蜂王浆、蜂花粉和蜂胶等一系列绿色健康食品,是养蜂业收入的主要来源。
2006 年,美国养蜂人观察到蜜蜂离奇地从蜂箱中消失,而且出现了较高的死亡率,有学者将这种现象称为蜂群崩溃综合征 (colony collapse disorder, CCD),其主要症状是蜂箱中的成年工蜂短时间内突然在巢外消失,蜂箱中只留有一只活的蜂王、卵和未成年的工蜂,以及大量蜜粉残留于巢脾内,但没有明显的寄生螨和微生物引起的疾病[8]。CCD 现象产生的原因及后果引起了媒体和科学家的强烈关注。研究表明,导致蜂群数量下降的因素有很多 (图1),包括栖息地丧失、全球气候变化、病原体、寄生虫、杀虫剂作用和外来物种影响等[9]。在2007 年之后,美国一个蜂业信息机构(the bee informed partnership,http://beeinformed.org)发起了年度养蜂人调查,结果显示,杀虫剂被认为是造成蜜蜂数量下降的重要原因之一[10]。蜜蜂在野外接触农药的方式主要有两种:一是直接接触漂浮在空中的农药液滴;二是间接接触,即通过采集含有农药残留的花粉、花蜜而接触农药(图1)。沾染了农药的蜜蜂,或者蜜蜂将含有农药残留的花粉、花蜜带回蜂巢,都将会污染整个蜂巢,将含有农药残留的花粉、花蜜作为食物喂食幼虫或其他成年蜂时亦会造成二次伤害,从而影响整个蜂群的健康[11-14]。蜜蜂数量的下降不仅严重影响着作物授粉效率,还影响蜂产品的产量和品质[10, 15]。
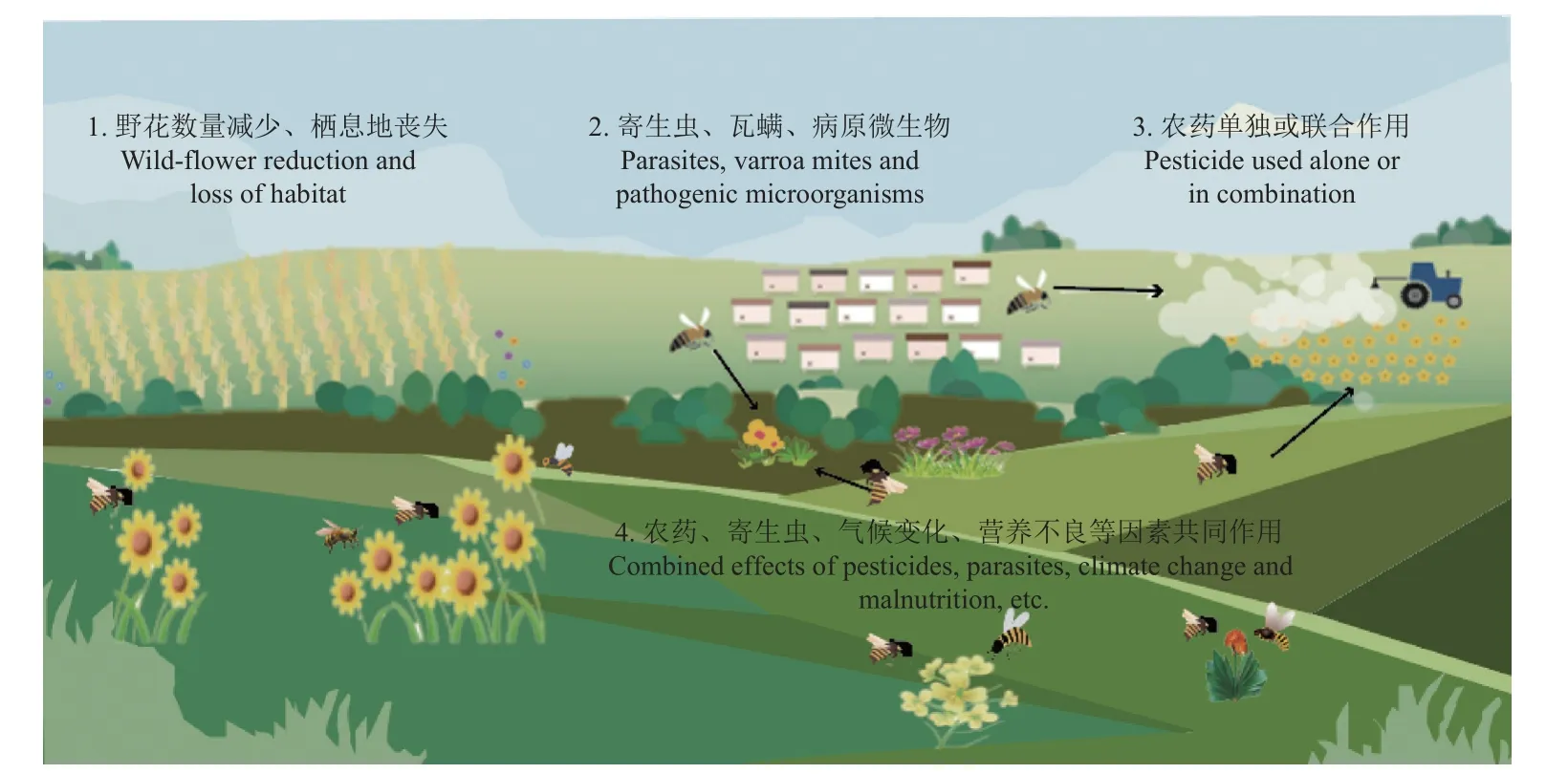
图1 多种因素对蜜蜂的影响 (引自Vanbergen[18] 并略作改进)Fig. 1 Effect of multiple factors on bees (from Vanbergen[18] with minor modification)
农药使用不当会对蜜蜂产生负面影响,尤其是新烟碱类 (neonicotinoids) 杀虫剂的影响更为突出。鉴于此,多个国家和组织对部分新烟碱类杀虫剂的环境风险进行了再评价或限制使用甚至禁用[16-17]。为了解农药对蜜蜂的潜在影响,阐明其内在作用机制,很多学者从不同层面研究了农药对蜜蜂的毒性效应,相关结果将有助于决策者制定严谨的制度或策略,以降低农药对蜜蜂的影响,维持生态系统的稳定。本文主要从农药对蜜蜂的急性毒性、农药单用或联合作用对蜜蜂的影响,以及新烟碱类杀虫剂与蜜蜂烟碱型乙酰胆碱受体的相互作用、农药对蜜蜂毒性差异的机理、农药对蜜蜂解毒相关酶活性及其他生理生化指标的影响、植物化学物质在调控蜜蜂对农药的耐受性中的作用等方面进行综述,并展望了未来的研究工作,希望能够为寻求农药使用与蜜蜂保护之间的平衡提供参考。
1 农药对蜜蜂的影响
1.1 农药对蜜蜂的急性毒性
农药对蜜蜂的急性毒性通常在室内测定得到,包括急性经口和急性接触毒性。赵帅等[19]曾测定了300 种农药制剂对蜜蜂的急性经口毒性,发现毒性等级为剧毒、高毒、中毒及低毒的农药制剂分别占总测定药剂量的14.7%、35.6%、10.7%和39%,表明不同农药对蜜蜂的毒性存在差异,其中剧毒和高毒的农药产品以杀虫剂为主,杀菌剂和除草剂对蜜蜂的毒性相对较低[19]。其他研究亦表明,除个别品种如百草枯[20-21]外,绝大多数除草剂对蜜蜂为低毒[22]。大多数杀菌剂对蜜蜂的急性毒性亦为低毒[22-23]。
就杀虫剂而言,不同种类农药对蜜蜂的毒性差异较大[24-30](表1)。众所周知,大多数新烟碱类杀虫剂如吡虫啉对意大利蜜蜂高毒;除此之外,有机磷类(organophosphorus) 和氨基甲酸酯类(carbamates) 杀虫剂对意大利蜜蜂毒性差异较大,急性接触毒性LD50值为0.018~31.2 μg/bee,其中蝇毒磷对意大利蜜蜂低毒 (LD50= 31.2 μg/bee),被用于防治危害蜜蜂的狄斯瓦螨Varroa destructor[22];乐果对苜蓿切叶蜂Megachile rotundata、毒死蜱对熊蜂均为高毒。大多数拟除虫菊酯类(pyrethroids)药剂对蜜蜂高毒,如溴氰菊酯(deltamethrin)对熊蜂、高效氟氯氰菊酯 (beta-cyfluthrin) 对红梅森蜂Osmia bicornis均为高毒,但是氟胺氰菊酯 (taufluvalinate) 对蜜蜂低毒,亦被蜂农用来防治瓦螨[22]。其他种类杀虫剂,如章鱼胺受体 (octopamine receptor agonists) 激动剂双甲脒(amitraz)[22]、鱼尼丁受体激动剂 (ryanodine receptor agonists) 氯虫苯甲酰胺 (chlorantraniliprole) 均对意大利蜜蜂低毒,但是γ-氨基丁酸门控氯离子通道激动剂 (GABA-gated Cl-channel agonists) 氟虫腈 (fipronil) 对中华蜜蜂高毒 (表1)。此外,同一种农药对不同种蜜蜂或相同作用机理不同品种农药对同种蜜蜂的毒性亦存在差异。例如:中华蜜蜂对吡虫啉 (imidacloprid)最敏感[27],其次是苜蓿切叶蜂[28]、意大利蜜蜂[24]、红梅森蜂[26]和熊蜂[30],而红梅森蜂对噻虫啉(thiacloprid) 的敏感性反而高于意大利蜜蜂[24,26];不同新烟碱类杀虫剂对同种蜜蜂的毒性不同,比如吡虫啉和噻虫啉对意大利蜜蜂的毒性即存在显著差异[24],红梅森蜂对吡虫啉和噻虫啉的敏感性也不相同[26](表1)。曾有研究人员整理了蜜蜂对包括新烟碱类杀虫剂在内不同作用机理的62 种杀虫剂的敏感性,结果表明,意大利蜜蜂可能对个别杀虫剂较为敏感,但却不是对杀虫剂最敏感的蜂种[31]。
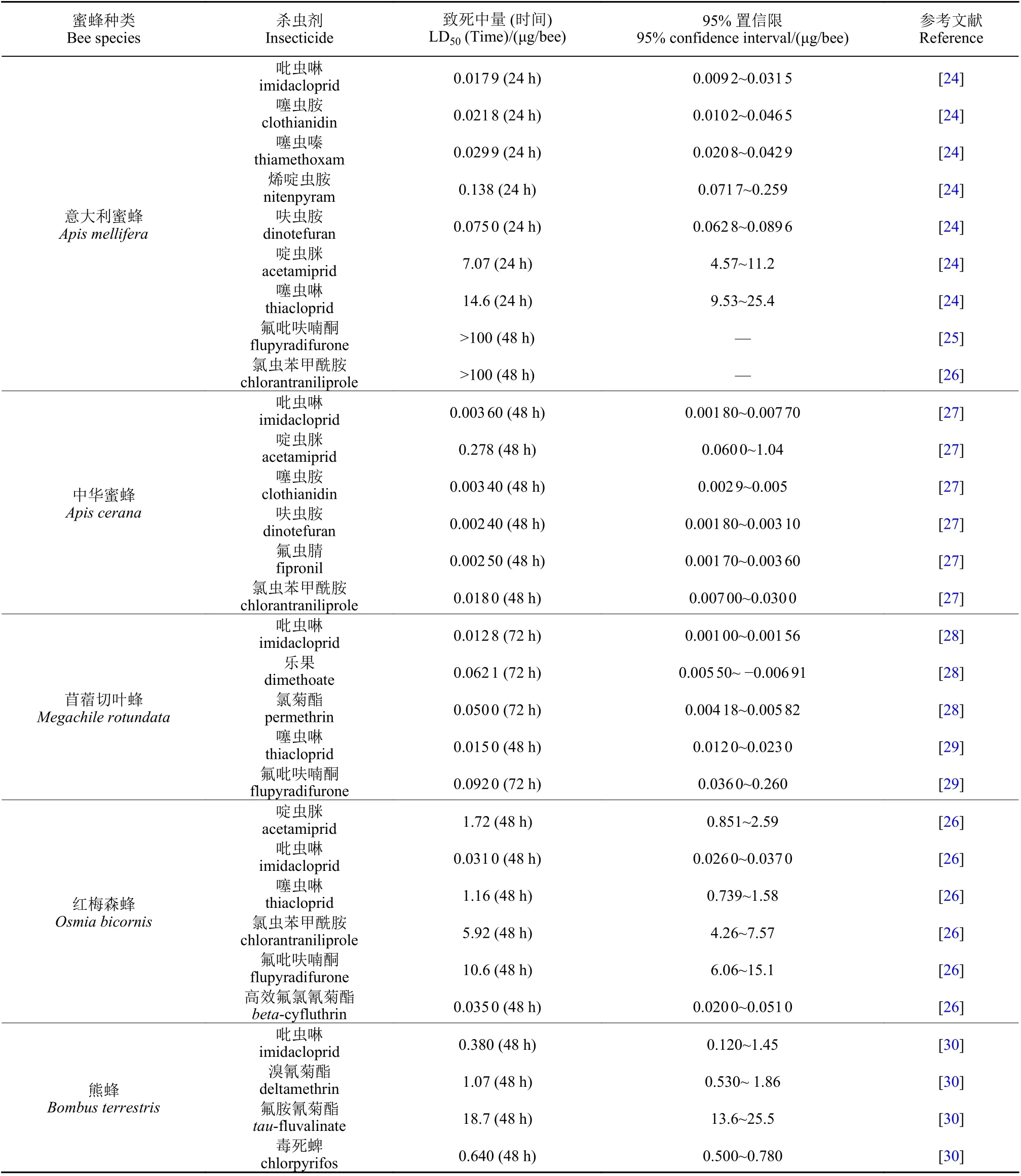
表1 不同杀虫剂对蜜蜂的急性接触毒性Table 1 Acute contact toxicity of different insecticides to honeybees
1.2 农药对蜜蜂发育及行为的影响
农药对蜜蜂的毒性与暴露剂量密切相关。虽然环境中的残留或低剂量的漂移接触不一定会造成蜜蜂的直接死亡,但所诱发的亚致死效应仍不容忽视。接触亚致死剂量农药的蜜蜂返回蜂巢,可能会使整个蜂群暴露在风险中,从而影响蜜蜂的生长发育、运动、觅食、学习记忆以及寿命的长短。
研究表明,氟胺氰菊酯的含量超过0.5mg/kg时会影响意大利蜜蜂蜂王的培育质量[32];而亚致死剂量的氟氯苯菊酯(flumethrin)能显著降低意大利蜜蜂幼虫化蛹和羽化率[33]。分别用含有毒死蜱乳油和氯氰菊酯(cypermethrin)乳油的花粉 (有效成分含量7 ng/g) 喂食红梅森蜂幼虫,18 d 后与对照组相比,两种药剂均能显著降低红梅森蜂幼虫的体重[34]。亚致死剂量的多菌灵虽然不会导致蜜蜂死亡,但是会抑制蜜蜂幼虫的发育[35]。长期接触100 μg/L 吡虫啉后,蜜蜂的寿命比对照组缩短10.81 d[36]。在垂直装置 (vertical arena) 的趋光性试验中,摄入亚致死剂量的噻虫嗪60 min 后,蜜蜂运动功能受损,其向顶部光源爬行能力下降[37]。
蜜蜂的觅食活动需要其对来回路径以及花的颜色、形状、气味进行记忆,所以学习记忆能力对蜜蜂尤为重要[38]。采用经典的奖励学习训练方法[39],蔚添添[40]研究发现,20 μg/L 的吡虫啉会极显著地使蜜蜂第2 和第3 次的喙伸反应率降低,表明吡虫啉胁迫后蜜蜂的学习能力下降。Tan 等[41]发现,中华蜜蜂摄入0.1 ng/bee 的吡虫啉后,其嗅觉学习能力比对照组低1.6 倍,记忆能力也显著低于对照组;暴露于0.24 ng/bee 吡虫啉的蜜蜂,其幼虫成年后学习能力也受到损害,比对照组降低4.8 倍。尹令虹等[42]的研究表明,1.0 mg/L 的噻虫啉会降低蜜蜂出房后的学习效率和短时间记忆。此外,氟虫腈、溴氰菊酯、硫丹(endosulfan)和咪鲜胺(prochloraz) 也可降低蜜蜂的学习能力[43]。Artz 等[44]发现,异菌脲(iprodione)、吡唑醚菌酯(pyraclostrobine) · 啶酰菌胺复合物可破坏苜蓿切叶蜂的巢穴识别能力,后者还可坏蓝色果园蜜蜂Osmia lignaria(blue orchard bees) 的巢穴识别能力。
综上所述,亚致死剂量的农药会对蜜蜂的生长发育、寿命及行为等产生不良影响。
1.3 农药联合作用对蜜蜂的影响
为了提高防效、扩大防治谱以及延缓有害生物抗性的发展,农业生产中常轮换或复配使用不同作用机理或无交互抗性的农药来控制有害生物,导致蜜蜂在觅食时可能会同时受到多种农药的影响,因此明确农药联合作用对蜜蜂的影响具有重要价值[45-46]。
生物体暴露于一种以上的应激源之后,其结果可能存在以下几种情况:1) 拮抗效应,即两个应激源联合作用的效果小于各自单独作用后加在一起的效果;2) 相加效应,两个应激源联合作用的效果等于各自作用后加在一起的效果;3) 协同效应,两个应激源联合作用的效果大于各自单独作用后加在一起的效果[47-52]。有研究发现,当蜜蜂在田间实际水平下暴露于多种农药时,农药之间存在着协同效应[53]。如新烟碱类、有机磷类和拟除虫菊酯类农药复配即表现为协同效应。张艳峰等[54]的研究表明,30%噻虫胺悬浮剂、10%高效氯氟氰菊酯 (lambda-cyhalothrin) 悬浮剂对意大利蜜蜂的急性接触毒性均为高毒,但二者复配后的10%高效氯氟氰菊酯 · 噻虫胺悬浮剂对意大利蜜蜂的急性接触毒性则为剧毒。Paik 等[55]发现,啶虫脒和蝇毒磷(coumaphos)的二元混合物对蜜蜂的毒性也表现出协同效应。此外,乙酰甲胺磷(acephate)和高效氯氟氰菊酯、联苯菊酯(bifenthrin)混配后对蜜蜂的毒性均表现出协同效应;乙酰甲胺磷与吡虫啉混配后毒性表现为相加效应;毒死蜱分别与联苯菊酯、氯氟氰菊酯(cyhalothrin)、zeta-氯氰菊酯(zeta-cypermethrin) 和氯菊酯混配,也均表现出协同效应[56-57]。甾醇抑制剂类 (sterol biosynthesisinhibiting)杀菌剂本身对蜜蜂的毒性较低,75%戊唑 · 嘧菌酯 (tebuconazole + azoxystrobin) 可溶性粉剂对意大利蜜蜂的急性经口48 h-LD50值为65.9 μg/bee,其对蜜蜂的接触毒性48 h-LD50> 105 μg/bee[23],但是当该类杀菌剂与杀虫剂混配以后,则可能会增强杀虫剂对蜜蜂的毒性[20],如四氟醚唑 (tetraconazole)分别与氰戊菊酯 (fenvalerate) 和吡虫啉混配后均表现出协同效应,其中与吡虫啉的混配使蜜蜂死亡率显著增加20%[56-57];将杀菌剂腈苯唑 (fenbuconazole)分别与啶虫脒和吡虫啉复配使用时,会显著增强两种新烟碱类杀虫剂对意大利蜜蜂和日本角面蜜蜂Osmia cornifrons的毒性[58]。此外,加拿大玉米种植区的蜜蜂在夏季大部分时间都会暴露于毒理学水平显著的新烟碱类杀虫剂中,Tsvetkov 等[59]通过现场暴露试验发现,噻虫胺和噻虫嗪分别与对蜜蜂低毒的啶酰菌胺 (boscalid) 混合使用后,混剂对蜜蜂的LD50值显著低于分别单独使用时的LD50值,毒性明显增加。由此可见,一些农药的联合使用可能会对蜜蜂的生存产生更为明显的负面影响。
2 农药对蜜蜂的毒理学机制研究进展
2.1 新烟碱类杀虫剂与蜜蜂靶标受体的相互作用研究
在昆虫的神经系统中,乙酰胆碱 (acetylcholine,ACh) 广泛分布于脑中,参与学习记忆、运动、呼吸、循环、消化以及体温调节等多种重要的生命活动,是一种十分重要的神经递质[60-61]。乙酰胆碱受体 (AChR) 是ACh 的特异性受体,接受ACh 刺激后引起神经突触后膜产生兴奋电位、进行信号传递[62]。乙酰胆碱受体分为两种类型:一种是被烟碱 (nicotinic) 激活的烟碱型乙酰胆碱受体 (nAChR),另一种是可被蕈毒碱 (muscarinic) 激活的蕈毒碱型乙酰胆碱受体 (mAChR),现有新烟碱类杀虫剂主要作用于昆虫的nAChR[63-64]。
通过昆虫全基因组测序发现,意大利蜜蜂nAChR 基因有9 个α-亚基(Amelα1~9)和2 个β-亚基 (Amelβ1~2)[65]。了解新烟碱类杀虫剂在传粉媒介中的作用靶标至关重要,然而实现这一目标的主要困难是靶标受体难以成功表达[66]。虽然昆虫nAChR 的异源表达比较困难,但是其α-亚基在与某些脊椎动物非α-亚基共表达时会形成稳健的nAChR,该发现已被用于研究新烟碱类杀虫剂的作用模式[67-68]。
因软体动物神经胶质细胞 (molluscan glial cells) 分泌的乙酰胆碱结合蛋白 (acetylcholinebinding protein,AChBP) 具有与昆虫nAChR 细胞外部分相同的结构,故其晶体结构可用于描述nAChR 与配体之间的相互作用。Chen 等[69]基于Ac-AChBP 和吡虫啉的3D 结构模板 (ID:3C79),借助全长编码序列,建立了意大利蜜蜂 nAChR 的推定模型Amelα8/ratβ2。Xu 等[70]借助Amelα8/ratβ2 模型,进一步研究了蜜蜂与新烟碱类杀虫剂的相互作用机制,发现氟吡呋喃酮的一个电负性基团结合了一个选择性的α-亚基,而吡虫啉则结合在非选择性的β-亚基,这可能是蜜蜂对这两种杀虫剂敏感性不同的原因之一。然而AChBP 毕竟只是nAChR 的结构替代物,不是新烟碱类杀虫剂的作用靶标,因此关于蜜蜂nAChR 的晶体结构仍有待进一步研究。日本近畿大学松田一彦教授研究团队[66]突破了昆虫nAChRs 异源表达的难题,他们的研究表明,硫氧还蛋白 (thioredoxin) 是昆虫烟碱型乙酰胆碱受体稳定表达的关键,并在非洲爪蟾Xenopus laevis卵母细胞中表达了果蝇Drosophilid、蜜蜂及熊蜂的nAChRs;此研究也使得新烟碱类化合物的分子靶点作用特性得以确定,有助于理解其对授粉昆虫的毒性作用机制。
2.2 杀虫剂对蜜蜂毒性差异机理研究
蜜蜂体内存在多种解毒代谢酶系,主要包括谷胱甘肽硫转移酶 (glutathione-S-transferases,GSTs)、细胞色素P450 单加氧酶(cytochrome P450 monooxygenases,P450s)和羧酸酯酶(carboxylesterases,CarEs) 等,它们共同构成蜜蜂的解毒防御体系[71]。外源物质解毒过程主要包括将脂溶性物质转化为水溶性、可排泄的代谢物等阶段。P450s 和CarEs 主要在初级代谢 (phase I) 中发挥作用,通过改变毒素结构,使其无法与亲脂性靶标位点相互作用;GSTs 是主要的次级代谢 (phase II)酶,通过与谷胱甘肽 (GSH) 结合而参与外源物质的解毒;在III 相代谢 (phase III) 中,则由ATP 结合盒转运蛋白 (ATP-binding cassette,ABC) 将次级代谢产物转运至细胞外以进行排泄[72]。了解蜜蜂接触和转化毒素的分子基础,对于保护蜂群健康至关重要[73]。
昆虫P450 基因分为CYP2、CYP3、CYP4 和线粒体P450 四大分支,其中CYP3 分支中的基因数量最多,在蜜蜂体内,CYP3 分支共有CYP6、CYP9 和CYP336 家族基因[74-75](表2),其中CYP6家族基因数量最多,其次是CYP9 家族。已有相当多的证据表明,CYP6 和CYP9 家族的基因大多与药物代谢和对杀虫剂的抗性有关[75]。
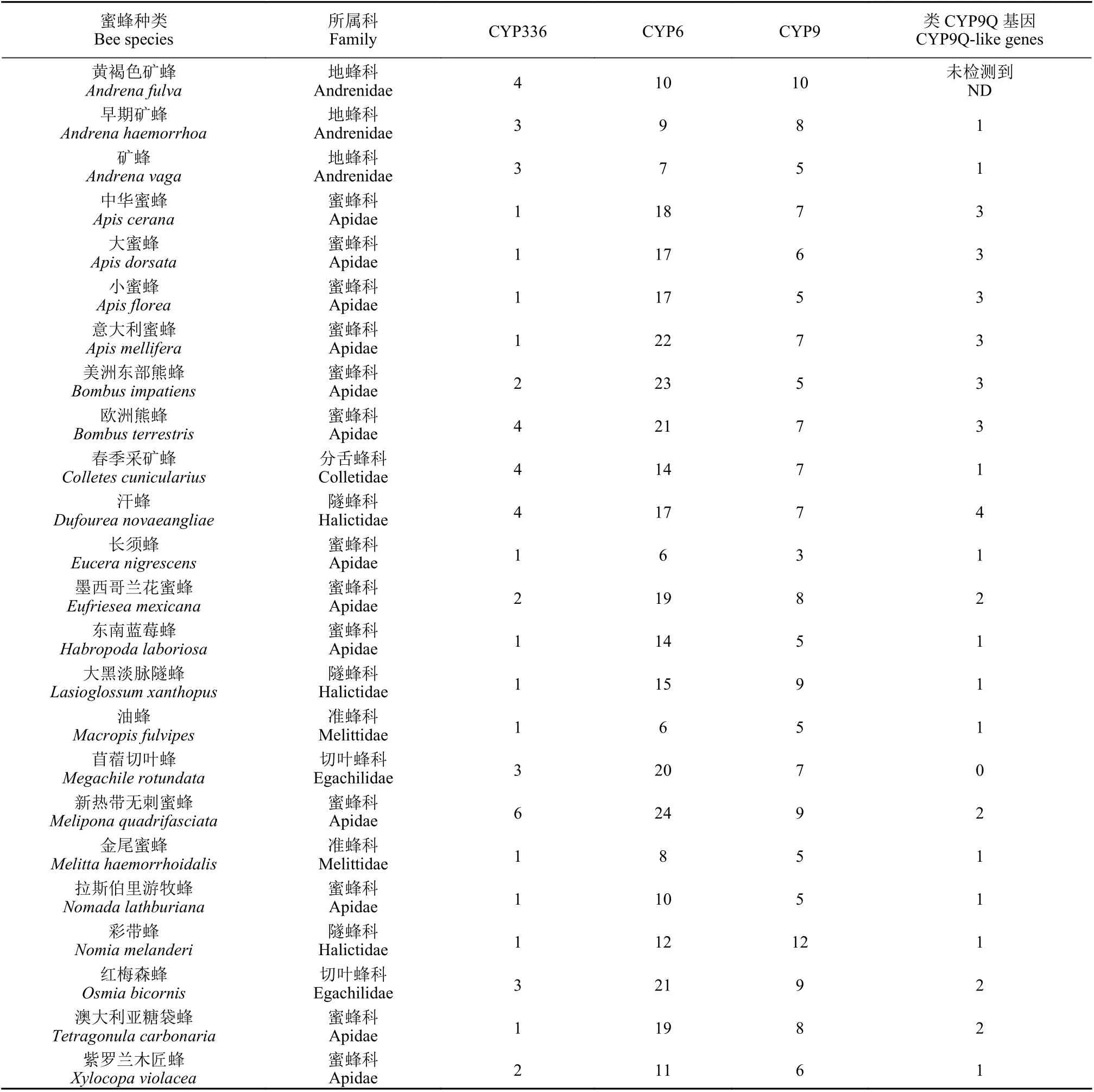
表2 蜜蜂CYP3 分支的P450 基因种类及数量 (引自Haas 等[74])Table 2 P450s of CYP3 clan in bee species (from Hass et al [74])
蜜蜂对农药的敏感性不同,很大一部分原因与其解毒酶系统将农药转化为毒性较小化合物的能力不同有关。CYP9Q 亚家族的细胞色素P450酶在蜜蜂和熊蜂代谢新烟碱类化合物时发挥了重要作用,如熊蜂CYP9Q4 和CYP9Q6 能代谢噻虫啉和啶虫脒[76],意大利蜜蜂CYP9Q3 能代谢噻虫啉和啶虫脒[77];同时其在拟除虫菊酯类和有机磷类杀虫剂的解毒代谢方面也具有重要的作用,如Mao 等[78]在异源表达及体外代谢试验中发现,CYP9Q1、CYP9Q2 和CYP9Q3 能将氟胺氰菊酯代谢成更易于被羧酸酯酶裂解的化合物,同时还能代谢蝇毒磷。红梅森蜂体内虽然缺乏CYP9Q 亚家族,但系统发育分析显示,该蜂CYP9BU 亚家族与蜜蜂科CYP9Q 亚家族关系最近,并且体外代谢试验发现,CYP9BU1 和CYP9BU2 能代谢噻虫啉[79]。
Manjon 等[77]通过放射性配体结合及P450s 重组表达等试验发现,意大利蜜蜂、熊蜂对新烟碱化合物N-硝基胍类吡虫啉和N-氰基脒类噻虫啉的敏感性差异不是因为它们对受体亲和力的差异,而是由于P450s 的代谢差异,意大利蜜蜂CYP9Q3能高效地代谢噻虫啉而对吡虫啉几乎没有活性,熊蜂CYP9Q4 也能高效地代谢噻虫啉。噻虫啉和氟吡呋喃酮 (flupyradifurone) 对苜蓿切叶蜂的毒性高于意大利蜜蜂和熊蜂,在急性接触毒性试验中,发现苜蓿切叶蜂对噻虫啉敏感性是意大利蜜蜂、熊蜂的2 500 多倍,对氟吡呋喃酮的敏感性是意大利蜜蜂和熊蜂的170 倍;基因组学研究发现,苜蓿切叶蜂对噻虫啉和氟吡呋喃酮敏感是因为其体内缺乏CYP9 家族基因,不能编码相应的P450 而缺乏解毒能力,从而使噻虫啉和氟吡呋喃酮不能被代谢,所以这两种药剂对苜蓿切叶蜂高毒[29]。研究者通过受体结合和表皮穿透试验发现,红梅森蜂对N-硝基胍类和N-氰基脒类新烟碱化合物的敏感性存在差异,其原因不是nAChR 亲和力和表皮穿透力的不同,通过在昆虫细胞系中与家蝇Musca domesticaL. 细胞色素P450 还原酶(cytochrome P450 reductase, CPR) 共表达,发现红梅森蜂CYP9BU1、CYP9BU2 代谢N-氰基脒类化合物噻虫啉的效率显著高于N-硝基胍吡虫啉;此外,表达CYP9BU1黑腹果蝇转基因品系对噻虫啉表现出显著的抗性,进一步证明CYP9BU亚家族介导红梅森蜂对噻虫啉的耐受性,所以P450 代谢差异导致红梅森蜂对吡虫啉和噻虫啉的敏感性不同[79]。Zhang 等[80]的研究表明,N-硝基胍类呋虫胺 (dinotefuran) 和N-氰基脒类啶虫脒 (acetamiprid)对蜜蜂的毒性差异不是因为它们对蜜蜂生物屏障的穿透程度不同,而是因为它们的代谢速率不同,啶虫脒在蜜蜂体内的代谢速率比呋虫胺快。噻虫胺、噻虫啉对意大利蜜蜂分别为高毒和低毒[24]。但是松田一彦研究团队[66]用非洲爪蟾卵母细胞进行电压钳电生理学试验,发现当噻虫胺与噻虫啉浓度低至10 pmol/L 时即可影响意大利蜜蜂与熊蜂的nAChRs,表明靶标亲和力不是毒性差异的原因。有研究发现,噻虫啉在意大利蜜蜂与熊蜂体内代谢速率较吡虫啉快[77],而噻虫胺未被证实具有如此快的代谢速率,所以解毒代谢是噻虫胺与噻虫啉对蜜蜂毒性差异的原因。松田一彦等[66]认为,噻虫啉在合理使用的情况下不会对授粉昆虫产生不利影响,但噻虫胺阻断ACh 与nAChRs 反应的浓度远低于其田间暴露浓度,所以推测其可能对授粉昆虫有风险。
蜜蜂对化学农药敏感性差异的原因除了解毒代谢差异以外,还有一部分原因是靶标受体及表皮穿透速率的差异。Guo 等[81]研究发现,靶标不敏感性是双甲脒对蜜蜂低毒的原因;而氟胺氰菊酯(tau-fluvalinate)和其他拟除虫菊酯类药剂对熊蜂具有优异的选择性,也正是由于药剂靶标-钠离子通道氨基酸活性位点存在差异所致[82]。Haas等[25]的研究表明,氟吡呋喃酮对蜜蜂低毒的原因是由于蜜蜂对该药的吸收速率较慢,并且与n A C h R 亲和力低,同时蜜蜂体内的解毒酶CYP6AQ1、CYP9Q2 和CYP9Q3 对氟吡呋喃酮的代谢能力较强,且代谢物对蜜蜂无毒,即靶标受体结合力、解毒代谢及表皮穿透速率的差异共同赋予了蜜蜂对氟吡呋喃酮的耐受性。
2.3 农药对蜜蜂解毒酶活性及其他生化指标的影响
农药不仅会对蜜蜂的生长发育及行为产生影响,而且可以削弱其免疫和生殖系统,激活抗氧化和解毒机制,进而影响整个蜂群的健康和繁衍。Carneiro 等[83]通过急性毒性试验及组织病理学、细胞毒性、荧光定量等检测手段研究发现,急性经口摄入1.44 mg/L 的吡虫啉会造成蜜蜂中肠上皮消化细胞间隙增大,产生胞浆空泡,而且摄入时间越长,对器官损伤越严重;摄入24 h 后细胞会出现自噬体,且自噬相关基因atg1表达量显著高于对照组,表明经口摄入吡虫啉会诱导蜜蜂中肠细胞的凋亡和自噬。Carneiro 等[84]还发现,经异菌脲处理过的意大利蜜蜂细胞亦出现凋亡现象,如细胞质空泡化、顶端细胞突起、核碎裂以及染色质浓缩。卵黄蛋白原(vitellogenin,Vg) 是卵黄蛋白的前体,负责调节蜜蜂的发育和行为,通常与能量稳态有关。有文献报道,Vg 含量下降时,蜜蜂的觅食活动随之增加,反之则会减少[85]。Christen等[86]发现,暴露于0.1、0.5、1 和10 ng/mL 噻虫嗪48 h 后,与对照组相比,蜜蜂卵黄原蛋白基因表达量均上调;72 h 后,1 和10 ng/mL 处理组卵黄原蛋白基因表达量仍表现为上调,蜜蜂觅食活动减少。此外,蜜蜂高度依赖生物钟来调节其关键行为,例如觅食方向、学习记忆等,近年来,有关农药对蜜蜂生物钟的影响亦多见报道。睡眠损害已被广泛证明会破坏多种物种的神经认知功能,例如学习、记忆和社交等,有研究表明,喂食新烟碱类化合物数天会导致其在蜜蜂大脑中积累,扰乱蜜蜂个体的昼夜节律并损害其睡眠;在睡眠受损的蜜蜂中,关键的导航记忆巩固功能也受到损伤,从而降低了觅食蜜蜂返回蜂巢的可能性[5]。
蜜蜂体内的抗氧化酶主要有超氧化物歧化酶(SOD)、过氧化氢酶 (CAT) 及谷胱甘肽过氧化物酶 (GSH-Px)[87]。蜜蜂在接触低剂量的农药之后,可能会诱导氧化应激而产生活性氧 (ROS) 或活性氮 (RNS) 及与之相关的毒性作用,同时也会调控体内的解毒酶系统以减少农药对自身的危害,如GST、CAT 和CarE 等均已被证实可参与蜜蜂代谢农药和机体防御等重要过程,这些抗氧化酶或解毒酶常被用于评估外源性化合物对生物的影响[88]。Balieira 等[89]研究发现,0.7 和2.0 ng/mL 的吡虫啉会增加蜜蜂体内GSH-Px 和CAT 的活性。Qi 等[33]的研究表明,蜜蜂幼虫连续暴露于1、10 和100 μg/L的氟氯苯菊酯杀螨剂6 d 后,化蛹前的晚龄幼虫体内SOD、CAT、过氧化物酶 (POD)、脂质过氧化物酶 (LPO)、谷胱甘肽还原酶 (GR) 和GST 活性以及丙二醛 (MDA) 含量均发生了显著变化。
研究表明,噻虫嗪会提高蜜蜂不同发育阶段的乙酰胆碱酯酶 (acetylcholinesterase,AChE) 活性,以及提高蛹期GST 和CarE 的活性[90]。Yao等[91]研究发现,0.168 mg/L 的乙酰甲胺磷即能显著降低蜜蜂酯酶的活性,以6.97 mg/L 乙酰甲胺磷处理蜜蜂后,其CarE 和GST 的活性分别减少了79.9%和20.4%,但同时使P450 的活性提高了20%。
P450 基因具有诱导表达的特性。研究表明,0.046 和0.064 mg/L 的噻虫嗪能诱导意大利蜜蜂CYP6AS3基因上调表达,同时后者还能诱导CYP6AS5基因的上调表达[92];噻虫嗪、灭多威(methomyl)、溴氰菊酯和辛硫磷 (phoxim) 能诱导中华蜜蜂AccCYP336A1基因的过量表达[93]。除此之外,意大利蜜蜂CYP6AS4、CYP6AS15等基因也能被吡虫啉诱导上调表达[94](表3)。Mao 等[78]分析了意大利蜜蜂中肠CYP3 分支的P450 基因,结果发现,氟胺氰菊酯、联苯菊酯能分别提高CYP9Q3和CYP9Q2基因的表达量。农药除了会影响蜜蜂CYP3 分支P450 基因的表达,还能诱导线粒体P450 基因的表达,如噻虫嗪能诱导中华蜜蜂线粒体P450AccCYP301A1、AccCYP303A1、AccCYP306A1和AccCYP315A1基因的上调表达[95],噻虫啉能诱导意大利蜜蜂CYP301A1和CYP315A1基因的上调表达[96](表3)。诱导表达后的P450 有助于蜜蜂降解农药等外源物质,从而提高其对有害物质胁迫的抵抗力。

表3 蜜蜂工蜂接触农药后上调表达的解毒酶基因Table 3 Up-regulated detoxification genes in honeybee workers after exposure to pesticides
2.4 农药联合作用对蜜蜂影响的毒理学机制研究
研究表明,有机磷类与拟除虫菊酯类杀虫剂复配使用对蜜蜂具有协同效应,其原因是有机磷酸酯可与酯酶结合,抑制酯酶的活性,使其不能降解拟除虫菊酯类农药而起到增效作用[56]。比如乙酰甲胺磷与吡虫啉混配后对蜜蜂的毒性升高,是因为乙酰甲胺磷可抑制羧酸酯酶的活性,削弱了蜜蜂对其他化学物质的防御反应[57]。三唑类杀菌剂可抑制由P450 介导的对拟除虫菊酯类与新烟碱类药剂的解毒作用,因而其与菊酯类和新烟碱类杀虫剂混用后表现出协同效应[20,98]。在分子水平上探明农药相互作用的机理,有助于评估和预测协同效应的发生。筛选农药混用配方时则应注意不同农药间的相互作用,避免其对蜜蜂等授粉昆虫产生负面影响。
3 植物化学物质调控蜜蜂对农药的耐受性研究
保证食物营养是蜜蜂维持健康和抵抗外界胁迫的重要因素,蜜蜂在采集和食物酿造、储存过程中可接触到多种多样的植物化学物质,包括植物激素、植物次生代谢物等。研究表明,多种植物源化学物质可显著改善蜜蜂的健康状况[99]。例如,幼蜂食用百里香酚 (thymol) 后,其变形翅病毒的感染水平显著降低,成蜂食用后则抗菌肽的表达水平明显升高[100];咖啡因 (caffeine) 广泛存在于咖啡和柑橘类植物的花蜜中[101],能提高意大利蜜蜂在复杂的学习任务中的动力(motivation)和认知能力(cognitive performance)[102],接受咖啡因奖励的蜜蜂记忆和定位习得花香的百分比是只接受蔗糖奖励组蜜蜂的3 倍,并发现其参与嗅觉学习和记忆的肯扬细胞 (kenyon cells) 兴奋性明显增强[101],此外咖啡因还能显著降低感染以色列急性麻痹病毒蜜蜂的死亡率[103]。咖啡因作为一种膳食补充剂,同时还能够提高蜜蜂抵抗外界胁迫的能力。Balieira 等[89]研究发现,咖啡因能减轻由吡虫啉引起的蜜蜂氧化应激反应。Wong 等[104]的研究表明,吡虫啉质量浓度为15 和45 μg/L 时,使用对香豆酸 (p-coumarin acid) 处理能延长意大利蜜蜂的寿命;当吡虫啉为45 μg/L 时,单独使用槲皮素(quercetin) 或与对香豆酸联用都能延长蜜蜂的寿命。Arathi 等[99]研究发现,25 mg/L 的咖啡因、山奈酚 (kaempferol)、没食子酸 (gallic acid) 和对香豆酸均可以延长暴露于10 μg/L 噻虫嗪的蜜蜂的寿命。Mitton 等[105]的研究表明,对香豆酸和吲哚-3-乙酸 (3-indoleacetic acid) 能提高暴露于氟胺氰菊酯的蜜蜂存活率。Liao 等[106]发现,对香豆酸和槲皮素均可将丙环唑 (propiconazole) 与氯虫苯甲酰胺联合使用的风险比率 (hazard ratio, HR) 降低约60%。Ardalani 等[107-108]亦发现,槲皮素能降低蜜蜂体内吡虫啉的浓度,而黄酮类化合物能降低蜜蜂体内吡虫啉和氟胺氰菊酯的浓度。
植物化学物质可调控蜜蜂对农药的耐受性,可能与其能诱导蜜蜂解毒代谢酶基因表达上调、提高解毒代谢酶活性有关[109-110]。Johnson 等[111]发现,槲皮素通过上调3 种细胞色素P450 基因CYP6AS1、CYP6AS3和CYP6AS4的表达,可降低氟胺氰菊酯对蜜蜂的毒性,提高工蜂的存活率。而对香豆酸则被发现可上调意大利蜜蜂工蜂CYP9Q3基因的表达[112]。同时Mitton 等[105]研究发现,对香豆酸可增加氟胺氰菊酯处理组意大利蜜蜂P450 和GR 的活性,而喂食吲哚-3-乙酸后,意大利蜜蜂体内P450 水平显著升高,因此认为与解毒机制相关的酶促变化是降低氟胺氰菊酯暴露下蜜蜂死亡率的原因。
综上,植物化学物质在蜜蜂调控对农药的耐受性方面发挥着重要作用,为保护蜜蜂提供了新的思路和方法,对降低农药对蜜蜂的影响、提高蜜蜂授粉的安全性具有十分重要的意义,但能否将其应用于养蜂业中还有待于进一步研究。
4 总结与展望
现有研究表明,农药使用不当对蜜蜂的影响是复杂多样的,除急性中毒死亡外,亚致死剂量的农药亦可影响蜜蜂的觅食、发育、学习记忆等,由此提醒我们应注意采取合理措施规范使用农药,尽量避免和减少农药对蜜蜂的直接暴露,同时降低农药在环境中的残留,以将其对蜜蜂等非靶标生物的影响降至最低。值得注意的是,上述研究大多数是在实验室条件下进行的,所得数据并不能完全反映田间环境下农药对蜜蜂影响的真实水平,所以还需要在田间条件下开展相关试验。此外,蜜蜂在自然环境中会同时暴露在各种各样的潜在有毒化学物质中,包括由植物产生的黄酮类物质和生物碱,以及真菌毒素、杀虫剂、杀螨剂、杀菌剂、除草剂和其他环境污染物,接触某种农药所造成的危害可能还取决于同时接触到的其他化合物的水平,以及病原体水平、营养状况和许多其他因素,因此明确农药与其他有毒物质对蜜蜂的复合影响仍是未来研究的重点和难点。
目前有关农药对蜜蜂影响的研究仍主要集中在意大利蜜蜂上,对于其他蜂种,如中华蜜蜂、独居蜂等的研究相对较少,由于意大利蜜蜂与其他蜜蜂具有不同的生理机制,因此农药对不同种类蜜蜂的影响也可能会有所不同,加之中华蜜蜂、熊峰、独居蜂等在农业授粉作业中的使用比例正逐渐升高,所以未来还应加强农药对其他蜜蜂影响的研究。
避免在施药时期放蜂是保护蜜蜂的有效措施之一,但是农药半衰期长等原因可能会导致农药在植物花粉、花蜜中残留,蜜蜂在采蜜时可能会接触到残留的农药,进而发生中毒现象,然而目前尚未发现很好的方法可救治中毒的蜜蜂。因此,研究开发救治中毒蜜蜂的方法,或者开发能够提高蜜蜂对农药耐受性的物质都将有助于保护蜜蜂免受农药的危害,并有望在未来的养蜂业中得到推广应用。同时,研发高效、环境友好型、尤其是对蜜蜂等有益生物低毒/无毒的绿色农药应成为今后农药创制的方向。可喜的是,已有很多对蜜蜂低毒的农药,如氟吡呋喃酮已获准生产并投入田间使用;日本明治制药公司研发的新型新烟碱类杀虫剂flupyrimin 不仅可以高效地防治稻飞虱,而且对意大利蜜蜂和熊蜂等均为低毒[113]。同时还不少学者正在研发对蜜蜂安全的其他一些候选药剂,如杨新玲教授团队[114]开发了对蜜蜂友好的新型绿色蚜虫控制剂候选物L25 和L17;段红霞教授课题组[115]发现了对大豆蚜Aphis glycinesMatsumura 具有活性但对蜜蜂低毒的苯乙酰腙类似物3c 和3e。相信在相关领域研究人员的不懈努力下,将会有越来越多对蜜蜂低毒、高活性及环境友好的农药问世,从而更好地保障农业生产和生态系统的可持续发展。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

张伟,女,博士研究生。2020 年6 月于山东农业大学制药工程 (农药) 专业获工学学士学位。2022 年9 月在中国农业大学农药学专业以硕博连读方式攻读博士学位,主要从事杀虫剂对蜜蜂毒理学研究。

邱立红,女,1998 年7 月于中国农业大学农药学专业获博士学位。现任中国农业大学理学院教授、博士生导师,主要从事害虫抗药性、农药毒理和使用技术原理的教学与科研工作。先后主持国家自然科学基金3 项、国家“十二五”科技支撑计划子课题1 项、农业农村部等省部级科研项目5项,并参与国家重点研发计划、国家“九五”“十五”“十一五”科技攻关等涉及抗性病虫新药研发及新农药创制等多个项目的研究。目前兼任《植物保护学报》副主编、《农药学学报》常务编委、中国植物保护学会园艺病虫害防治专业委员会委员。
