海藻糖酶结构及其抑制剂的农用活性研究进展
2022-10-25师东梅蒋志洋邹雪君黄家兴段红霞
师东梅, 蒋志洋, 邹雪君, 黄家兴, 段红霞
(中国农业大学 理学院 应用化学系 农药创新研究中心,北京 100193)
0 引言
海藻糖是由两分子葡萄糖通过α-1,1 糖苷键相连的非还原性二糖[1],其广泛分布于除脊椎动物外的昆虫、真菌、细菌以及植物等众多生物体内,具有重要的生物学功能[2]。在真菌、细菌和植物体内,海藻糖不仅能够作为储能物质参与生物体的能量代谢,而且具有抵抗环境胁迫的功能;此外,海藻糖还能影响真菌的孢子萌发和作为毒力因子决定病原微生物的致病性[3-7]。在昆虫体内,海藻糖作为昆虫的“血糖”,除具有储能和抗胁迫功能外,其代谢过程还可调节昆虫几丁质的生物合成,进而调控昆虫的生长发育。此外,昆虫飞行肌中的海藻糖还可为其飞行提供能量[8-11]。
在昆虫和植物病原真菌体内,海藻糖的主要代谢过程如图1 所示。尿苷二磷酸葡萄糖 (UDPG)与葡萄糖-6-磷酸 (G6P) 在海藻糖-6-磷酸合成酶催化下生成海藻糖-6-磷酸 (T6P),T6P 经海藻糖-6-磷酸磷酸酯酶催化生成海藻糖,海藻糖再经海藻糖酶水解,最终生成两分子葡萄糖以参与糖代谢和能量代谢,为生物体的重要生理活动供能[2,12]。在昆虫和植物病原真菌的海藻糖代谢过程中,海藻糖酶是唯一负责海藻糖不可逆水解的重要功能酶,对海藻糖含量的调控至关重要[2,13]。正是由于海藻糖酶具有重要的生物学功能,且凭借着其在昆虫、真菌及哺乳动物体内生物学功能的差异,尤其是以海藻糖酶为靶标的商品化杀菌剂井冈霉素的广范应用,使其成为对植物和哺乳动物安全的新型杀虫剂/杀菌剂开发中的候选靶标[14-15]。
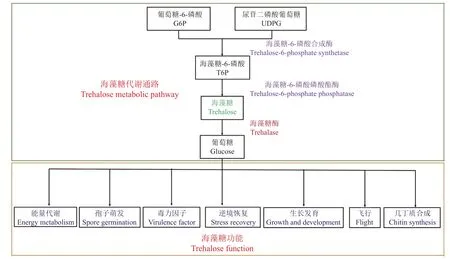
图1 昆虫和植物病原真菌体内海藻糖代谢通路及其功能Fig. 1 Trehalose metabolic pathway and its functions in insects and plant pathogenic fungi
目前已发现的海藻糖酶抑制剂主要为糖基和拟糖基类抑制剂,鲜有非糖基类抑制剂的报道。本课题组前期筛选发现了一类对草地贪夜蛾Spodoptera frugipera海藻糖酶有较好抑制活性的新型胡椒碱衍生物,这表明胡椒碱类化合物可作为海藻糖酶潜在的抑制剂骨架[16]。此外,在医药研究领域中,已有许多关于胡椒碱生物活性的报道,如抗菌、抗肿瘤、抗癌、抗氧化、抗腹泻、保肝及增效等[17-18]。近年来,在农药研究领域,胡椒碱也逐渐受到人们关注。众多研究表明,胡椒碱及其类似物不仅对鞘翅目、直翅目、双翅目、鳞翅目和同翅目等多种农业害虫均具有杀虫活性[19-22],而且对致病疫霉菌Phytophthora infestans、稻瘟病菌Pyricularia grisea等植物致病真菌还表现出杀菌活性[23-24]。然而,目前尚未见关于胡椒碱类化合物农用活性的综述报道。
本文拟对近年来报道的海藻糖酶晶体结构、底物/抑制剂结合模式以及酶抑制剂在农业领域的活性研究进展进行综述。鉴于胡椒碱类化合物不仅可作为海藻糖酶的潜在抑制剂,而且具有多重生物活性,因此,本文着重介绍了胡椒碱及其类似物在昆虫海藻糖酶抑制作用等方面的多种农用活性研究进展,以期为靶向海藻糖酶结构开发新型胡椒碱类结构的农用化学品提供参考。
1 海藻糖酶结构及其与抑制剂/底物的互作机制研究进展
1.1 海藻糖酶的结构
糖苷水解酶 (GHs) 是糖代谢过程中的重要功能酶,主要负责生物体内双糖、多糖及其他糖类复合物的水解。根据糖苷水解酶的氨基酸序列保守度可分为168 个家族,即GH1-GH168[25]。此外,有报道指出,GHs 存在两种催化机理,即保留或反转催化机制[26]。海藻糖酶则属于GHs 中的GH15、GH37 或GH65 家族,且其遵循反转催化机制[27]。
相关研究表明,昆虫体内含有两种形式的海藻糖酶,即可溶性海藻糖酶和膜结合海藻糖酶,均属于GH37 家族。此外,大多数真菌或细菌海藻糖酶也同属于GH37 家族。 GH37 家族中的海藻糖酶结构普遍具有较高的序列同源性,尤其是在酶催化活性中心的残基Glu-Asp 更为保守,这两个残基可分别作为亲核试剂和质子供体完成海藻糖的水解。目前,仅有小部分真菌和古细菌海藻糖酶被划分至GH15 和GH65 家族,与GH37家族海藻糖酶不同的是,GH15 和GH65 家族内海藻糖酶均以催化中心的一个Glu 残基为质子供体,而分别以Glu 残基和水分子作为亲核试剂行使其催化功能[13,28]。
截至目前,已有来自4 种生物的13 个海藻糖酶的晶体结构被成功解析和报道 (表1)。通过分析现有海藻糖酶晶体结构可发现,不同物种海藻糖酶的高级结构具有一定相似性,即均由氮端结构域、Ca2+结合域 (CaBD) 和高度保守的催化域 (CD)3 部分组成。
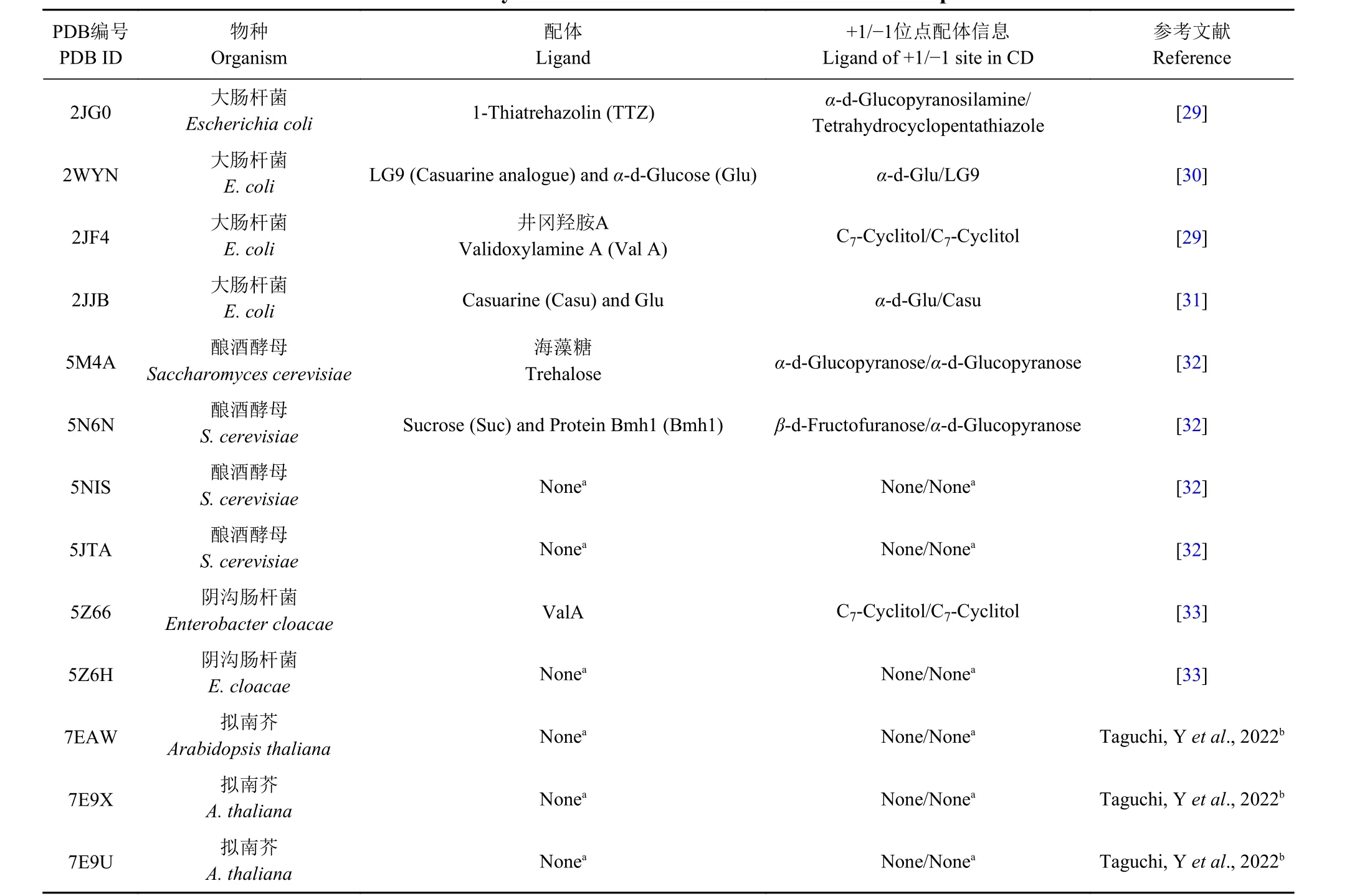
表1 目前已报道的不同物种海藻糖酶晶体结构信息Table 1 The crystal structures of trehalase from different species
本文以酿酒酵母S.cerevisiae海藻糖酶的晶体结构 (PDB ID: 5N6N) 为例介绍海藻糖酶的高级结构[32]。如图2 所示,海藻糖酶的氮端结构域包括两个亚结构,且每个亚结构中都存在一个磷酸化位点,即残基Ser60 和Ser83,它们可以激活海藻糖酶的催化活性。海藻糖酶的CaBD 部分则是由3 个α螺旋和2 个反向平行的β-折叠片组成的,其中Ca2+可参与海藻糖酶活性的调控,并与其相邻残基Asp114、Asp116、Asn118 和Asp125 的侧链配位互作。海藻糖酶的CD 部分则折叠成一个典型且高度保守的 (α/α6) -桶型结构,其中海藻糖酶的活性中心就位于该桶型结构内部。海藻糖酶的催化位点通常由两个葡萄糖结合亚位点组成,即识别位点和催化位点 (分别称为 -1 位点和 +1位点),催化位点附近的氨基酸残基Asp478 和Glu674 是海藻糖酶行使催化功能的关键残基。此外,在这个独特桶型结构的外部还有一个类似于“桶盖”的长环状结构,包含一对保守的Glu-Tyr,其位于CaBD 和CD 之间,将海藻糖酶的催化中心包裹在内,分别参与底物的结合与催化。
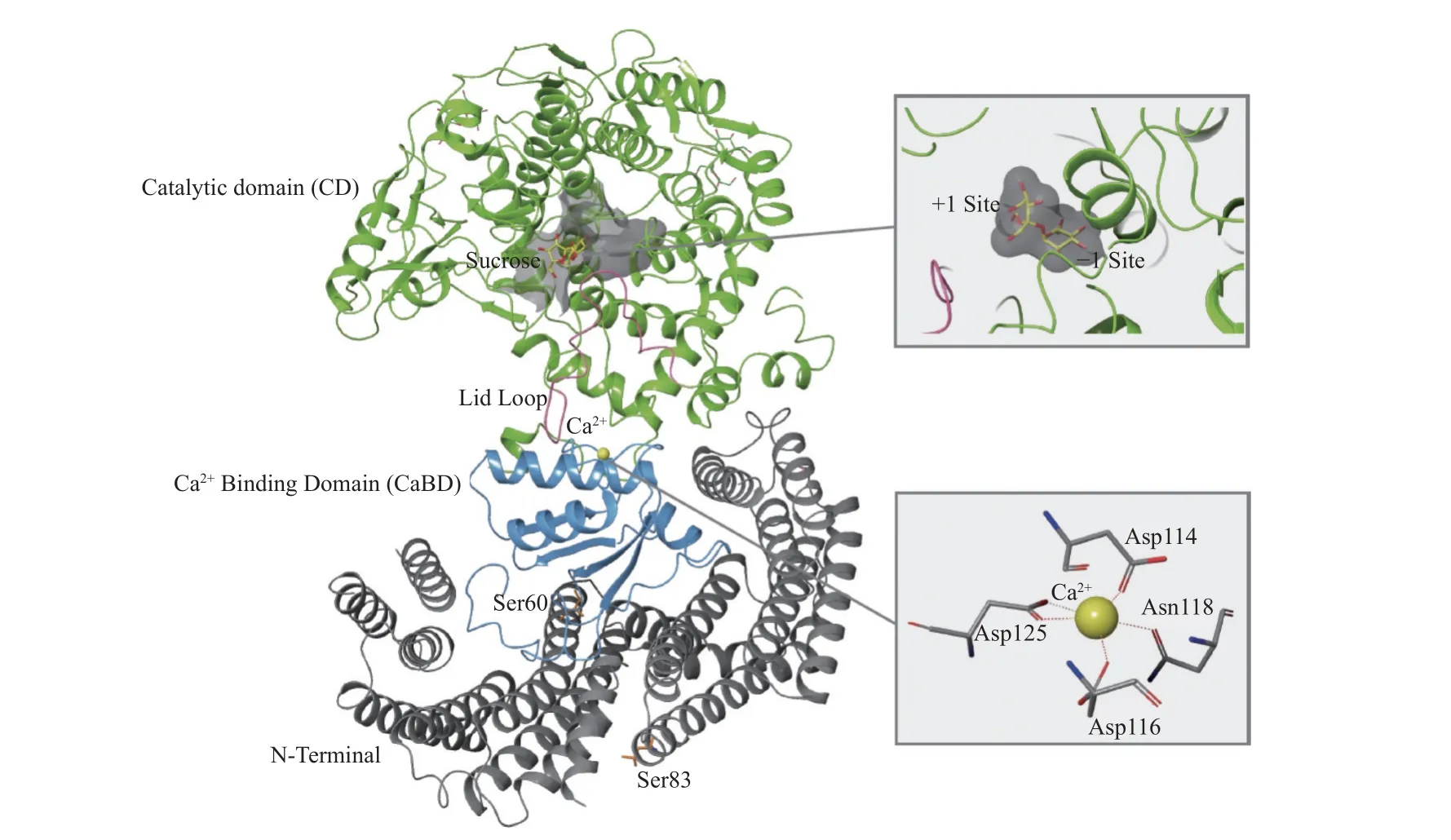
图2 酿酒酵母S. cerevisiae 海藻糖酶的晶体结构 (PDB ID: 5N6N)[32]Fig. 2 The crystal structures of trehalase from S. cerevisiae (PDB ID:5N6N)[32]
1.2 海藻糖酶与抑制剂/底物的互作机制
目前,已被解析的海藻糖酶与配体的复合物结构中仅包括CD 部分,其配体均为糖基抑制剂或底物海藻糖。进一步分析海藻糖酶与配体复合物晶体结构发现,不同物种的海藻糖酶CD 部分的高级结构十分保守,且其中配体的结合位点和结合模式高度相似。如图3A 所示,海藻糖酶抑制剂井岗羟胺A (VDM)、1-噻妥唑啉 (TTZ) 及木麻黄素的葡萄糖衍生物在大肠杆菌海藻糖酶中的结合构象十分相似,尤其是这些抑制剂中的葡萄糖环或假葡萄糖环部分,几乎以同一构象嵌入海藻糖酶催化中心的 +1 位点,其催化位点附近的Arg152、Trp159、Asn196、Arg277、Glu279 和Gly310 可与其配体形成氢键互作,在酶与抑制剂的结合中发挥关键作用[29]。酿酒酵母海藻糖酶与底物海藻糖的复合物结构 (PDB ID: 5M4A) 也显示海藻糖的两个葡萄糖环分别占据了 +1 和 -1 位点,与酶活性中心的残基Trp309、Asp310、Asn346 和Gly476以氢键结合 (图3B)[32]。如图3C 所示,阴沟肠杆菌Enterobacter cloacae海藻糖酶与VDM 也具有类似的结合模式,即VDM 可与海藻糖酶活性中心的残基Trp160、Arg277、Gly310 和Asp312 形成氢键相互作用[33]。
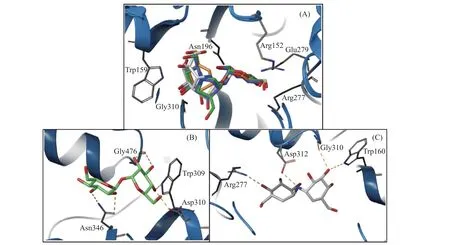
图3 不同类型的抑制剂或天然底物与不同物种海藻糖酶的结合模式[29,32-33]Fig. 3 The binding modes of different inhibitors or substrates to trehalases from different species[29,32-33]
可见,不同物种的海藻糖酶的催化域结构相对保守,且与糖基抑制剂或底物海藻糖都具有相似的结合模式,这为靶向海藻糖酶开发广谱性杀虫 (菌) 剂提供了重要的结构生物学基础。此外,海藻糖酶与抑制剂互作的关键氨基酸残基也可为基于海藻糖酶结构的新型抑制剂设计和改造提供借鉴。
2 海藻糖酶抑制剂研究进展
自从以海藻糖酶为靶标的低毒杀菌剂——井冈霉素问世以来,许多天然的和人工合成的具有海藻糖酶抑制活性的海藻糖类似物被陆续报道。主要包括井冈霉素、天然产物salbostatin 和trehazolin及其合成类似物、脱氧野尻霉素及其合成类似物、天然生物碱及其合成类似物。这些抑制剂对家蚕Bombyx mori、裂腹摇蚊Chironomus riparius、立枯丝核菌Rhizoctonia solani等多种昆虫或真菌海藻糖酶表现出一定抑制活性。最近本课题组研究发现,胡椒碱衍生物对草地贪夜蛾海藻糖酶具有较好抑制活性,成为一类新型海藻糖酶抑制剂候选物[16]。鉴于前期Matassini 等已对糖基、拟糖基和氨基糖类海藻糖酶抑制剂结构及其医用活性进行了综述[15],本文主要对具有农用杀虫或杀菌活性的海藻糖酶抑制剂结构及其农用活性进行介绍,并重点介绍胡椒碱及其类似物在昆虫海藻糖酶抑制活性等方面的农用研究进展。
2.1 商品化杀菌剂——井冈霉素
二十世纪70 年代,研究人员从吸水链霉菌亚种Streptomyces hygroscopicus中分离出一类天然的抗生素,其有效成分为井冈霉素A (Val A,图4,1)。目前,井冈霉素是防治水稻纹枯病最常用、最有效的农药品种,同时它还可与丙环唑、戊唑醇和三唑酮等多种杀菌剂混配用于防治小麦纹枯病、小麦赤霉病以及稻曲病等[34]。表2 总结了井冈霉素类化合物对昆虫和真菌海藻糖酶的抑制活性。
1974 年,研究者首次发现Val A 对水稻纹枯病菌Pellicularia sasakii菌丝的生长无显著抑制作用,且对菌株蛋白质或核酸含量也无影响,而是通过改变菌丝的形态间接抑制菌丝的扩增,但该研究中并无有关Val A 靶标和作用机制的报道[35]。1985 年,Trinci 等发现,葡萄糖可阻断Val A 对禾谷丝核菌Rhizoctonia cerealis的抑制活性,由此推测Val A 的靶标可能与糖代谢有关[36]。直至1987年,Asano 等测定了Val A 及validoxylamine A(VDM,图4,2) 对立枯丝核菌中提取出的不同糖苷水解酶的抑制作用,发现Val A 及VDM 对海藻糖酶表现出显著的抑制活性,其IC50值分别为7.2 ×10-5和1.4 × 10-7mol/L,但对纤维素酶、果胶酶和几丁质酶等其他糖苷水解酶并无抑制活性,由此推断,Val A 可能是先被运输到菌丝后被水解为VDM,最终作用于海藻糖酶而发挥杀菌作用[37]。1992 年,Shigemoto 等研究发现,在培养基中添加葡萄糖和蔗糖等糖类物质时会显著降低Val A对立枯丝核菌的抑菌活性,再一次证明了Val A 作为海藻糖酶抑制剂可以影响植物病原真菌的糖代谢[38]。
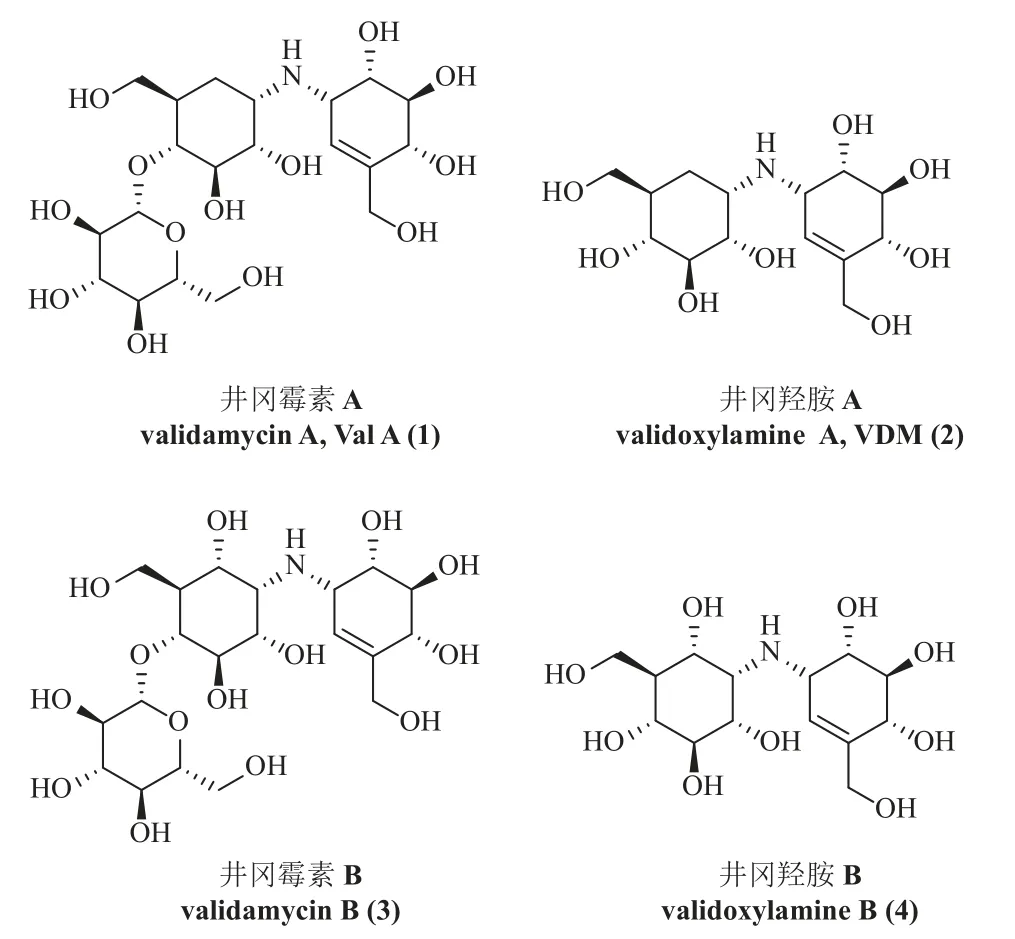
图4 井冈霉素类化合物的化学结构式Fig. 4 The chemical structures of validamycin analogues
除立枯丝核菌外,有许多研究也报道了Val A对其他植物病原真菌的抑制活性。1996 年,Ishikawa 等研究发现,Val A 在50 μg/mL 下对青枯假单胞菌Pseudomonas sollanacearum的生长具有抑制作用,且盆栽试验结果表明,Val A 对青枯病具有显著的治疗效果,其在250 μg/mL 下可使其发病率降低47.4%[39]。2019 和2021 年,Bian 等和Li 等均研究了Val A 对禾谷镰孢菌Fusariumgraminearum的抑菌机制,表明Val A 能通过抑制海藻糖酶活性进而调控糖酵解过程中丙酮酸激酶的活性,以抑制脱氧雪腐镰刀菌烯醇 (deoxynivalenol,DON) 的产生,最终抑制禾谷镰孢菌的侵染。此外,上述研究还发现,Val A 不仅可以抑制DON的生物合成,还可以诱导宿主对禾谷镰孢菌的抗性反应[40-41]。
鉴于海藻糖酶在昆虫体内重要的生物学功能,许多研究者通过研究发现Val A 也可作为昆虫海藻糖酶抑制剂表现出一定杀虫活性。1978 年,K a m e d a 团队研究,指出V D M 对斜纹夜蛾Spodoptera litura海藻糖酶具有显著的抑制活性(IC50=4.8 × 10-8mol/L),且高于Val A 对该酶的抑制活性 (IC50=3.7 × 10-7mol/L)[42]。1995 年,Takahashi 等通过显微注射试验发现,Val A 能显著抑制家蝇Musca domestica、肉蝇Sarcophagidae和宽丽蝇Calliphora nigribarbis体内的海藻糖酶活性,使得海藻糖在其血淋巴中积累。此外,研究者还发现注射2.5 μg 的Val A可造成30%供试家蝇的死亡,但对其他两种蝇类则无致死效果[43]。2009 年,Jin 等研究发现除Val A 和VDM 外,井冈霉素B (validamycin B, 图4,3) 和validoxylamine B (图4,4) 对白蚁termites 海藻糖酶也具有显著抑制活性 (表2),且酶促动力学研究发现,Val A等井冈霉素类化合物对白蚁海藻糖酶的亲和力要强于其底物海藻糖[44]。上述研究结果表明,Val A可作为白蚁海藻糖酶的潜在抑制剂,值得进一步关注。2016 年,Tatun 等通过饲喂和注射试验发现,Val A 可通过肠道上皮细胞进入其血淋巴中,从而显著抑制赤拟谷盗T. castaneum海藻糖酶的活性。此外,该研究还指出Val A 可通过抑制赤拟谷盗海藻糖酶的活性,进而抑制其几丁质合成,从而影响赤拟谷盗的化蛹和羽化过程,最终导致成虫的畸形和死亡[45]。Tang 等向褐飞虱N.lugens体内注射Val A 后,发现其可通过抑制褐飞虱可溶性海藻糖酶和膜结合海藻糖酶的活性,进而调节褐飞虱体内几丁质的代谢,并显著影响其几丁质代谢相关基因的mRNA 表达水平,最终导致供试褐飞虱种群的死亡和畸形[46]。近年来,Marten 等研究发现Val A 也可降低埃及伊蚊Aedes aegypti体内葡萄糖的含量,进而造成其发育延迟和飞行严重受阻,这表明Val A 作为海藻糖酶抑制剂也可用于卫生害虫的防治[47]。2022 年,Yu 等通过代谢组学分析等手段研究Val A 对斜纹夜蛾的杀虫机制,发现Val A 可以通过抑制斜纹夜蛾中糖代谢和几丁质的合成发挥杀虫活性,该研究为应用Val A 防治斜纹夜蛾奠定了重要理论基础[48]。
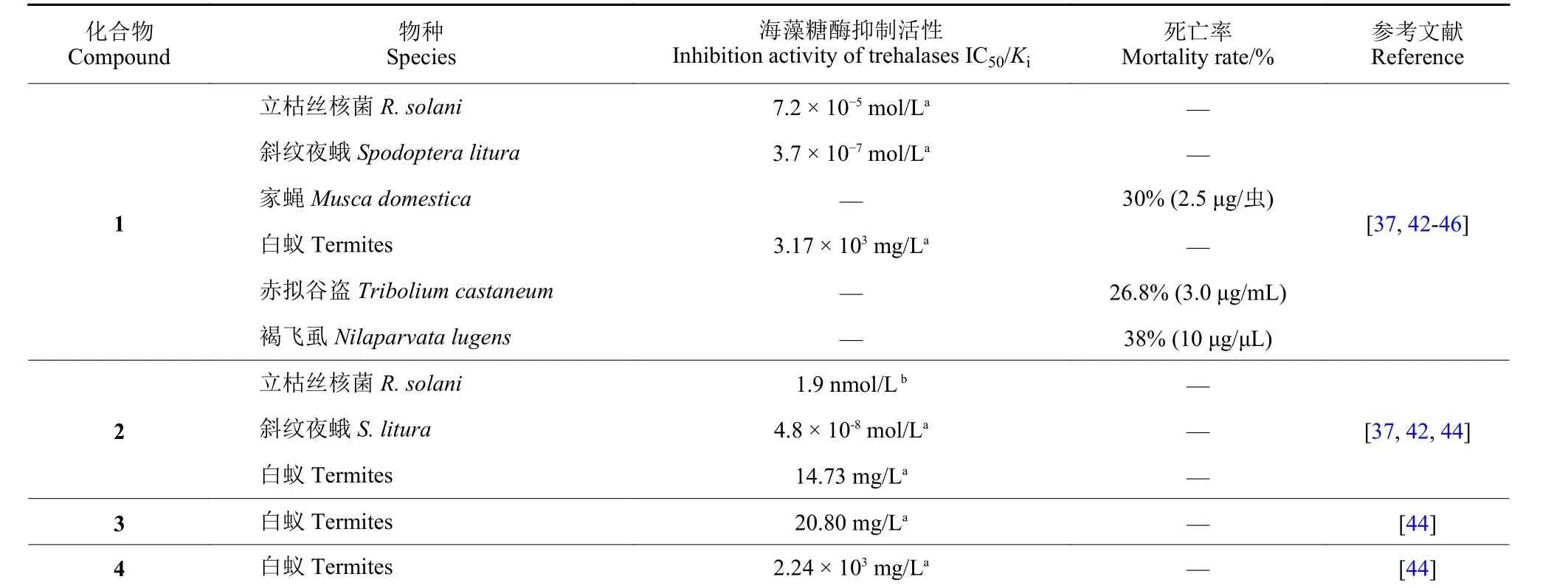
表2 井冈霉素类化合物对不同物种的海藻糖酶抑制活性汇总表Table 2 Summary of inhibitory activities of validamycin against trehalases from different species
综上所述,Val A 作为唯一以海藻糖酶为靶标的商品化杀菌剂,通过内吸方式进入植物病原菌丝后可被水解为VDM,进而作用于海藻糖酶,对立枯丝核菌、青枯假单胞菌和禾谷镰刀菌等众多植物病原菌具有良好的防效。此外,Val A 也被证明可作为昆虫海藻糖酶的潜在抑制剂,但其杀虫活性普遍不佳,这极大限制了其应用。
2.2 天然产物salbostatin、trehazolin 及其合成类似物
20 世纪90 年代初期,研究者发现,从白色链霉菌Streptomyces albus中提取出的salbostatin (图5,5) 对家蚕和猪肾海藻糖酶均具有显著的抑制活性[49-50],但可能由于其对哺乳动物选择性差,因而无后续相关报道。与此同时,Ando 等研究发现,从小单胞菌属Micromonospora的SANK 62390菌株中分离出来的trehazolin (图5,6),可作为家蚕海藻糖酶的潜在抑制剂,且对其他糖苷转移酶具有良好的选择性[51]。1995 年,Ando 等首次测试了trehazolin 的杀虫活性。结果表明,当向家蚕幼虫体内注射50 和100 μg/虫的trehazolin 时,可分别造成70%和100%供试家蚕幼虫的死亡。值得注意的是,trehazolin 除具有明显的杀虫活性外,其对立枯丝核菌海藻糖酶也具有一定的抑制活性,且与Val A 相当[52]。2003 年,研究者发现,tre 对蝗虫Locusta migratoria肌肉中的海藻糖酶具有显著的抑制效果,其Ki值在8~10 nmol/L 范围内,注射试验结果表明,trehazolin 表现出优异的杀虫活性:在24 h 内50 μg/mL 的trehazolin 即可杀死50% 的供试昆虫[11]。2001 年,Qian 等对trehazolin 的结构进行改造,得到了结构更为简单的化合物7 (图5),其在200 mg/L 下对黑腹果蝇Drosophila melanogaster有显著的杀虫活性和抑制其飞行的效果,但该化合物对猪肾海藻糖酶也表现出中等的抑制活性[53]。随后,研究者发现,trehazolin 的类似物1-thiatrehazolin (图5,8) 对猪肾海藻糖酶的抑制活性远低于trehazolin[54],且Gibson 等解析了1-thiatrehazolin 与大肠杆菌海藻糖酶的二元复合蛋白晶体结构,深入阐明了其对海藻糖酶的抑制机制[29],但目前尚未见该化合物对昆虫或真菌海藻糖酶抑制活性和农用活性报道。
2.3 脱氧野尻霉素及其合成类似物
1994 年,Asano 等首先报道了脱氧野尻霉素(DNJ,图5,9) 和1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇 (DAB-1,图5,10) 可作为金黄色毛壳菌Trichoderma aureus海藻糖酶的抑制剂[55-56]。直至2007 年,Konno 等才研究发现,高浓度的DNJ 和DAB-1 对蝴蝶幼虫 (caterpillars) 具有显著的杀虫活性[57]。2010 年,研究者发现,DNJ 虽然对裂腹摇蚊的膜结合海藻糖酶和猪肾海藻糖酶均表现出抑制活性,但其对二者的酶促动力学存在显著差异,表明其可以作为开发靶向海藻糖酶的杀虫剂先导。因此,研究者随后合成了一系列DNJ 类似物,其中仅化合物11 (图5) 对猪肾海藻糖酶具有安全性[58]。DNJ 虽然具有较好的昆虫海藻糖酶抑制效果但其对猪肾海藻糖酶选择性差,为进一步解决此问题,研究者设计并合成了多个DNJ 类似物,发现化合物12 和13 (图5) 均对裂腹摇蚊海藻糖酶具有选择性[59-60]。此外,1983 年,有研究者发现DNJ 的类似物1,5-二脱氧-1,5-亚氨基-D-甘露醇 (DMJ,图5,14) 对麻蝇Sarcophaga barbata海藻糖酶具有一定抑制活性[61],虽然其抑制效果低于DNJ,但其对哺乳动物海藻糖酶并无抑制活性,具有更高的安全性。1995 年,有研究报道了2R,5R-二羟甲脲-3R,4R-二羟基吡咯烷 (DMDP,图5,15) 对小菜蛾Pluttella xylostella和棒状杆菌Corynebacteriumsp.的海藻糖酶均具有抑制活性,且该化合物在1 mmol/L 下对猪肾海藻糖酶无抑制作用[62]。可见,上述抑制剂对昆虫海藻糖酶均具有较好的抑制活性,但其对哺乳动物的安全性仍有待考量,且鲜有其对农用杀虫活性的报道。因此,这些抑制剂能否成为潜在杀虫剂还值得进一步探讨。
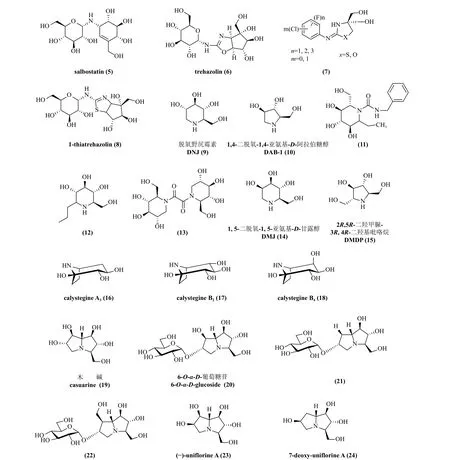
图5 已报道的海藻糖酶抑制剂结构Fig. 5 The chemical structures of inhibitors against trehalases
2.4 天然生物碱及其合成类似物
除糖基和拟糖基类抑制剂外,一些天然的生物碱及其类似物也被报道具有昆虫或真菌海藻糖酶的抑制活性。1996 年,Asano 等从茄科植物提取物中分离鉴定出了几种莨菪烷生物碱,发现其中 calystegine A3(图5,16)、Calystegine B2(图5,17) 和calystegine B4(图5,18) 对众多昆虫和植物病原菌 (家蚕、斜纹夜蛾和立枯丝核菌等) 的海藻糖酶均具有抑制活性,但这些化合物对大鼠和猪等哺乳动物体内的海藻糖酶同样具有抑制活性(表3),这表明这些化合物缺乏安全性[63]。2003年,木麻黄碱 (图5,19) 和6-O-α-D-葡萄糖苷(图5,20) 被报道具有猪肾海藻糖酶抑制活性[64],随后,2010 年,研究者又发现木麻黄碱也可显著抑制裂腹摇蚊的海藻糖酶活性[58]。同年, Cardona等对6-O-α-D-葡萄糖苷结构进行改造,发现合成的化合物21 和22 (图5) 对大肠杆菌和裂腹摇蚊的海藻糖酶抑制效果不及其母体化合物6-O-α-D-葡萄糖苷 (Ki值分别为12 和0.66 nmol/L),但对猪肾海藻糖酶却表现出良好的安全性[30]。(-)-uniflorine A(图5,23) 是从桃金娘科植物Myrtaceae Juss.的叶子中分离出来的一种天然生物碱,2015 年,D’Adamio等合成(-)-uniflorine A 类似物7-deoxy-uniflorine A(图5,24),并发现(-)-uniflorine A 和7-deoxy-uniflorine A 对裂腹摇蚊和棉叶虫Spodoptera littoralis海藻糖酶均具有显著的抑制活性,且对猪肾海藻糖具有安全性,但显微注射结果却显示这些化合物对棉叶虫的生长发育无显著影响,推测可能是该抑制剂在体内不稳定容易快速降解所致[65]。
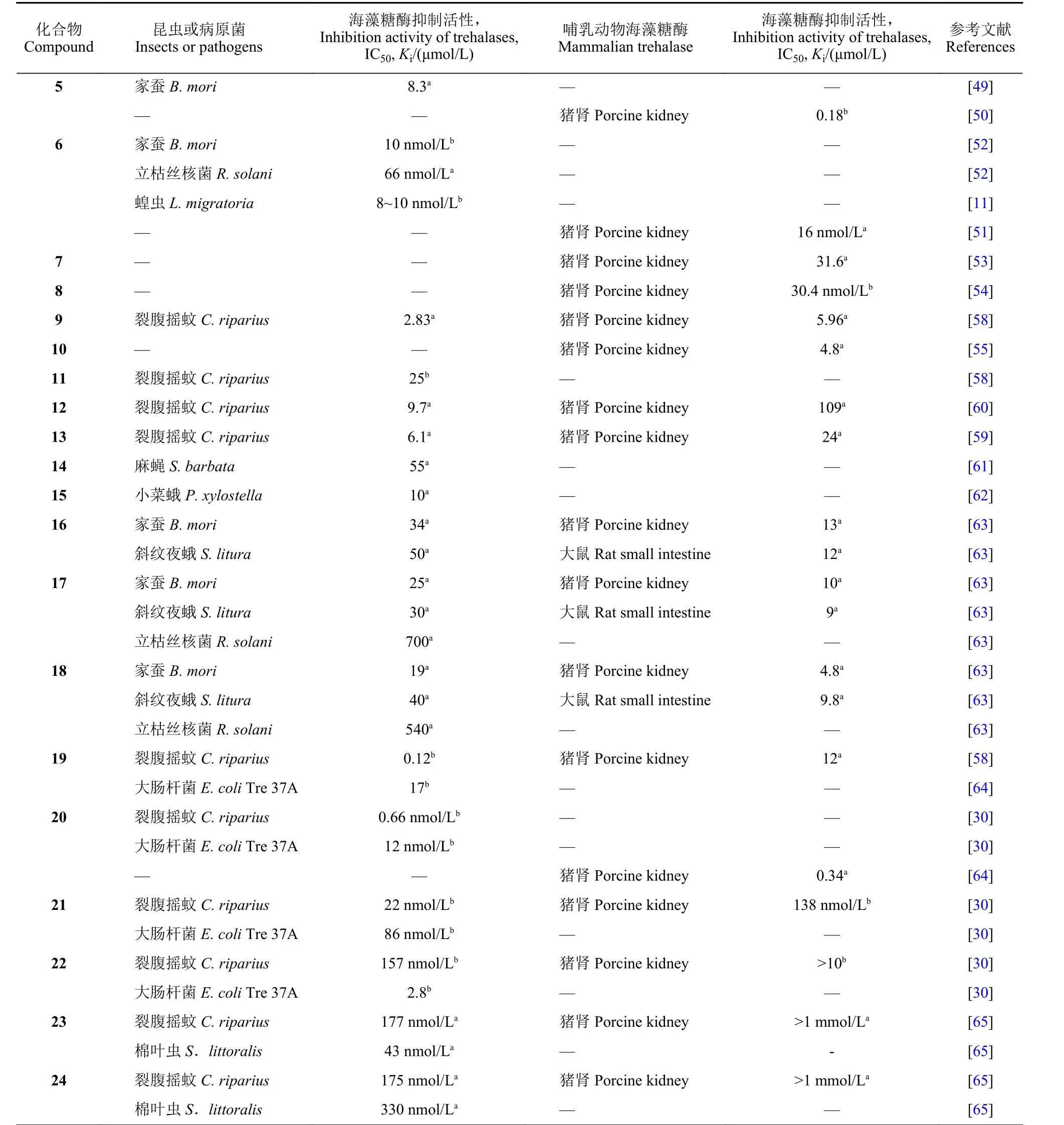
表3 化合物对不同物种海藻糖酶抑制活性信息表Table 3 Information on inhibitory activities of inhibitors against trehalases from different species
2.5 胡椒碱及其类似物
胡椒碱,又名1-胡椒酰哌啶1-piperylpiperidine,其化学名为1-(5-(1,3-苯并二氧杂环戊烯-5-基)-1-氧代-2,4-戊二烯基-(E,E)-)哌啶) (结构式见图6)。
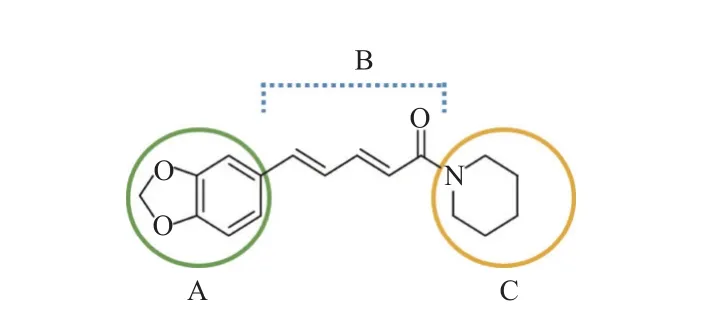
图6 胡椒碱的化学结构式Fig. 6 Chemical structure of piperine
最近本课题组首次研究发现胡椒碱类化合物可显著抑制草地贪夜蛾海藻糖酶活性,使其几丁质代谢通路紊乱,并延缓草地贪夜蛾的生长,最终导致草地贪夜蛾的蜕皮困难和生长发育异常而死,这表明胡椒碱结构可作为靶向海藻糖酶的新型潜在抑制剂或杀虫剂候选物骨架值得深入研究[16]。此外,胡椒碱类化合物作为一类含有1,3-苯并二氧杂环独特骨架的化合物,还具有抗肿瘤、抗癌、抗氧化、抗腹泻、杀虫活性、抗菌活性和协同增效作用等多种生物活性[17,20,23]。胡椒碱具有结构简单和便于改造的特点,近年来胡椒碱类化合物的设计与改造受到研究者们的广泛关注。如图6 所示,胡椒碱的主要结构包括3 部分,即胡椒环 (1,3-苯并二氧杂环) A、桥链B 和哌啶环C[66]。目前,相关研究大多针对胡椒碱的B 和C 部分进行改造,且发现改造后化合物具有一定农用活性。以下就胡椒碱及其类似物的结构、农用杀虫、杀菌或增效活性方面的研究进展展开综述。
2.5.1 胡椒碱及其类似物杀虫活性研究进展 天然胡椒碱类化合物种类众多,如:胡椒碱、guineensine (图7,25) 和Pipercide (图7,26) 等。截止目前,已有多种天然的胡椒碱类化合物被报道其对鞘翅目、鳞翅目、双翅目和同翅目等类害虫有杀虫活性。1977 年,Su 首先发现胡椒碱对米象甲Sitophilus oryzae和绿豆象Callosobruchus chinensis有一定的杀虫活性[67]。1978 年,Scott 等研究表明,黑胡椒提取物对3~5 龄的棉铃象鼻虫Anthonomus grandis表现为高毒,其LD50值为9.6 μg/虫[68]。1981 年,Su 等人发现,guineensine (图7,25)和pipercide (图7,26) 对绿豆象有触杀毒性,且对其腿部肌肉有麻痹作用[69]。1993 年,Gbewonyo等发现,从胡椒根中提取的化合物25、26 和guineensinamide (图7,27) 具有神经毒剂的作用特点,并对家蝇表现出击倒和致死活性,其中击倒活性和致死活性的排序分别为: 化合物25>27>26 和化合物26>25>27[19]。此外,Akinbuluma 等报道了5%的化合物25和胡椒碱在96 h 内对玉米象Sitophilus zeamais有显著的致死效果,且与对照甲基硫磷无显著差异。此外,上述化合物还可影响玉米象的产卵且对其具有驱避活性 (驱避率为70%),因此,胡椒碱类化合物作为仓储粮食保护剂值得进一步研究[22]。1999 年,Jacobs 等研究了6 种胡椒碱类化合物,即化合物25、26、28、29、30、31 (图7) 在100 mg/L 下对埃及伊蚊Aedes aegypti的杀虫活性,结果显示化合物25、26 和28 在2 h 内杀虫活性达到100%,但是化合物30、31 无杀虫活性,推测可能由于其短链结构使亲酯性较低,不易透过昆虫的体壁所导致[70]。
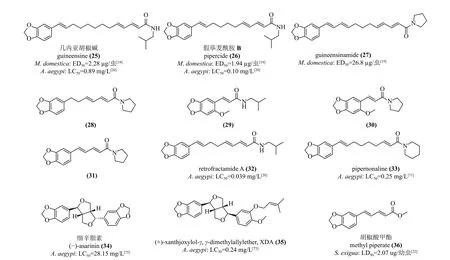
图7 具有杀虫活性的天然胡椒碱类化合物结构式Fig. 7 Structural formula of natural piperine compounds with insecticidal activity
2002 年,Park 等研究发现化合物25、26 和retrofractamide A (图7,32) 对淡色库蚊Culex pipiens pallens、埃及伊蚊和东乡伊蚊Aedes togoi表现出显著的致死活性,且均优于胡椒碱,由此推断胡椒碱类化合物中的N-异丁胺部分对蚊子幼虫的毒性至关重要[20]。上述研究也表明,天然胡椒碱类化合物可作为潜在的蚊虫防治剂,值得进一步研究。同年,Yang 等报道了pipernonaline(图7,33) 对埃及伊蚊幼虫的杀虫活性,其LC50值为0.25 mg/L,与商品化杀蚊剂甲基嘧啶磷相当[71]。2006 年,王佳采用个体研究与细胞研究相结合办法,发现胡椒碱表现出显著的神经毒剂特点,其对淡色库蚊有明显的触杀活性 (LC50值为0.368 μg/L),推测胡椒碱可能是作用于昆虫的神经系统进而发挥其杀虫活性的,此外,胡椒碱也可对淡色库蚊幼虫的发育和产卵等生理过程产生影响[21]。2007 年,王玉芳在王佳研究基础上,从细胞水平上研究胡椒碱对白纹伊蚊Aedes albopictusC6/36 细胞的毒性机制,结果表明胡椒碱对上述细胞系有较强的毒性和生长抑制作用,可作为新型杀虫剂的候选物[72]。2011 年,Tavares等研究发现,10 g/L 的胡椒碱可造成草地贪夜蛾和小蔗螟Diatraea saccharalis卵的致死率分别达到88.8%和98.9%[73]。2013 年,冯岗等研究发现,胡椒碱对螺旋粉虱Aleurodicus dispersusRussell 成虫和幼虫均具有很好的杀虫活性,且与对照药剂印楝素相当[74]。2017 年,Kim 等研究了天然胡椒碱类化合物(-)-asarinin (图7,34) 和(+)-xanthjoxylolγ,γ-dimethylallylether (XDA,图7,35) 对淡色库蚊、埃及伊蚊3 龄幼虫的杀虫活性,结果显示XDA对两种蚊类幼虫的杀虫活性均高于(-)-asarinin,但不及杀蚊剂双硫磷。值得注意的是,XDA 对淡色库蚊的抗性种群也表现出显著杀虫活性 (LC50=0.31 mg/L),表明该化合物与拟除虫菊酯和有机磷类杀虫剂具有不同的作用模式且无交互抗性,可作为潜在的杀虫剂进一步研究[75]。2021 年,Akinbuluma等研究发现胡椒碱、胡椒酸甲酯 (图7,36) 对甜菜夜蛾Spodopteraexigua二龄幼虫的LD50值分别为0.42 μg/虫和2.07 μg/虫,且这两个化合物对甜菜夜蛾幼虫体内的羧酸酯酶、谷胱甘肽转移酶和乙酰胆碱酯酶等解毒代谢酶的也具有显著抑制作用[22]。
迄今为止,天然胡椒碱及其类似物对象鼻虫、玉米象、埃及伊蚊、草地贪夜蛾、小蔗螟等多种农业害虫具有杀虫或杀卵等作用,推测其可能作用于昆虫的神经系统或其体内的解毒代谢酶系以发挥其杀虫活性,但是其真正的作用靶标和毒性机制仍有待后续深入研究和关注。
鉴于天然胡椒碱及其类似物具有广谱的杀虫活性,研究人员以胡椒碱为先导,通过对其结构改造发现,许多结构新颖的胡椒碱类似物也表现出显著的杀虫活性。2011 年,徐聪报道了一类胡椒基丙烯酰胺类化合物,其中化合物37 (图8) 在150 mg/L 下对黏虫Mythimna separate的致死率达到66.7%[76]。2013 年,Qu 等筛选发现了胡椒碱腙类化合物38~40 (图8),其在1 mg/mL 下对黏虫的致死率达60%以上,高于对照川楝素[77]。2015 年,Qu 等又发现胡椒碱磺酰腙类化合物41 和42 对黏虫具有特别强的麻醉活性,且化合物41 对乙酰胆碱酯酶具有选择性抑制活性[78]。2018 年,Yang 等研究发现,含异恶唑啉/吡唑啉支架的胡椒碱类化合物43~45 对小菜蛾具有显著的杀虫活性,同时对黏虫也具较好的生长抑制活性[79]。2020 年, Tantawy等合成了一系列胡椒碱基二烯肼类化合物,其中化合物46~54 (图8) 在0.75 mg/mL 下对尖音库蚊Culex pipiens表现出良好的杀虫活性 (死亡率为80.00%~83.33%),优于先导胡椒碱和对照溴氰菊酯,此外该研究指出胡椒碱基二烯肼类化合物的潜在靶标可能为乙酰胆碱酯酶 (acetylcholinesterase,AChE),且该类化合物中苯环上C-2 位置的取代基的有无对其杀虫活性的高低至关重要[80]。此外,本课题组前期以胡椒碱为先导设计并合成了多个胡椒类化合物,并筛选发现了对亚洲玉米螟Ostrinia furnacalis几丁质酶I 具有显著抑制活性的胡椒基丁烯内酯类化合物 (图8,55~60),其对亚洲玉米螟几丁质酶I 的抑制活性Ki位于1.03~2.04 μmol/L 之间,也发现了对亚洲玉米螟几丁质酶I 和几丁质酶h 兼具抑制活性的胡椒基硫代噻唑烷酮类化合物 (Ki=0.2~0.67 μmol/L),并指出这两类化合物对亚洲玉米螟均有杀虫活性和生长发育调节功能,可作为开发新型昆虫生长调节剂的先导值得关注[81-82]。
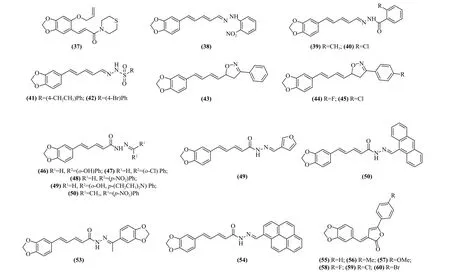
图8 具有杀虫活性的合成胡椒碱类似物的化学结构Fig. 8 Chemical structure of synthetic piperine analogues with insecticidal activity
综上所述,基于胡椒碱结构设计合成的多类化合物表现出显著的杀虫活性,且现有研究结果表明胡椒碱类化合物的作用靶标可能为乙酰胆碱酯酶、几丁质酶和海藻糖酶等,但仍需进一步研究证实,以实现为基于关键害虫靶标结构开发新型高效杀虫剂研究提供参考和奠定基础。此外,基于上述研究结果,本文总结发现胡椒碱的1,3-苯并二氧杂环A 部分和桥链B 部分对胡椒碱类化合物的杀虫活性十分重要,而C 部分的哌啶环似乎对化合物的杀虫活性影响较小,但胡椒碱的酰胺键相对也是必要的 (图9)。
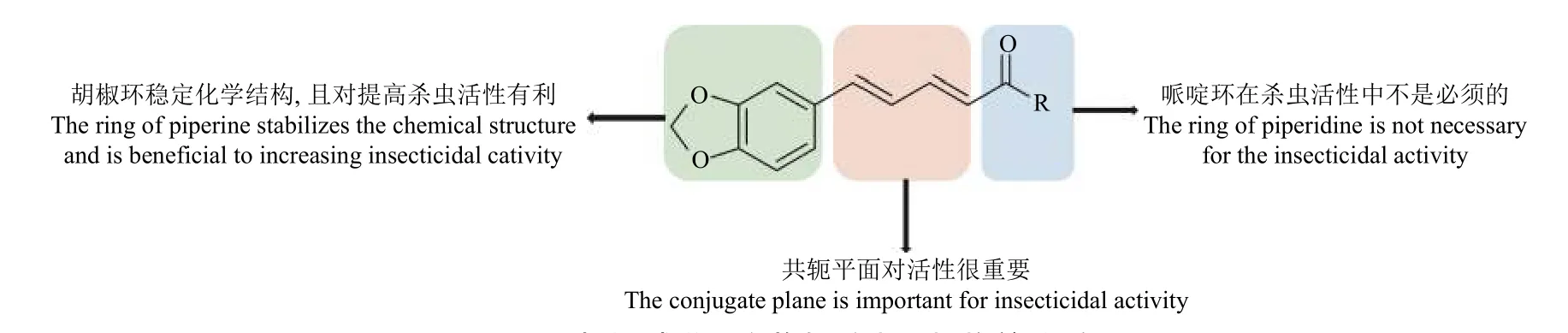
图9 胡椒碱类化合物与杀虫活性构效关系Fig. 9 Structure-activity relationship between piperine compounds and the insecticidal activity
2.5.2 胡椒碱及其类似物的杀菌活性研究进展胡椒碱类化合物除具有优异的杀虫活性外,也被报道具有广谱的农用杀菌活性。2001 年,Lee 等从荜茇果实中分离出的pipernonaline (图7,33),其在1 mg/mL 下对稻瘟病菌、立枯丝核菌、致病疫霉菌Phytophthora infestans和小麦锈病菌Puccinia recondita的离体抑菌活性分别为71%、35%、91% 和100%,暗示该化合物可作为开发新型广谱杀菌剂的先导化合物[23]。2010 年,Marques 等测试了胡椒碱、piperlonguminine (图10,61) 和corcovadine (图10,62) 以及合成的酰胺类化合物对植物病原菌芽枝状枝孢菌Cladosporium cladosporioides及球孢枝孢菌Cladosporium sphaerospermum的离体抑菌活性,结果表明这些胡椒碱类化合物对两种植物病原菌均具有一定抑菌活性,且构效关系分析结果表明,单双键连接芳香环和异丁基酰胺部分对胡椒碱类化合物的杀菌活性至关重要[83]。2014 年,王涛等报道了一种含胡椒环的膦酸盐化合物,其中化合物63 (图10)在50 mg/L 下对油菜菌核病菌Sclerotinia sclerotiorum和黄瓜灰霉病菌Botrytis cinerea显示出良好的抑制活性[84]。同年,宁国慧等报道了一类含胡椒环的异恶唑啉类化合物,其中化合物64 (图10)在50 mg/L 下对小麦赤霉菌Fusarium graminearum和棉花疫霉菌Phytophthora boehmeriae的离体抑制率都达到了90%以上[85]。此外,刘长令等研究发现胡椒碱类化合物65、66 (图10) 在2.8 mg/L下对稻瘟病菌的抑制率达到了100%,更值得注意的是,化合物66 在0.9 mg/L下对稻瘟病菌还可达到80%,且化合物67 对小麦白粉病菌Blumeria graminis、黄瓜霜霉病菌Pseudoperonospora cubensis和玉米锈病菌Pucciniasorghi也表现出广谱的离体抑菌活性[86]。2020年,王净净以胡椒碱为先导,在其侧链引入精油和胺类结构合成了一系列化合物68~70 (图10),其中化合物70 (图10)对辣椒疫霉菌Phytophthora capsici和茶树拟茎点病菌Phomopsis adianticola都表现出100%的抑制活性,远优于先导胡椒碱 (41.88%) 和对照多菌灵(34.27%)[87]。同年,宋迪合成了胡椒基内酰胺类衍生物,其中化合物71 (图10) 对茶树链格孢菌Alternaria tenuis的抑菌活性最好,高于阳性对照多菌灵[88]。2021 年,宋萍萍等公开了胡椒碱作为农业杀菌剂的用途专利,表明其可有效地防治菌核病、纹枯病、灰霉病、赤霉病、炭疽病、恶苗病、蔓枯病、枯萎病、黄萎病等多种农作物病害。更重要的是,胡椒碱还具有低毒、无残留、无污染和无公害的特点,可作为开发环境友好型杀菌剂的先导[89]。
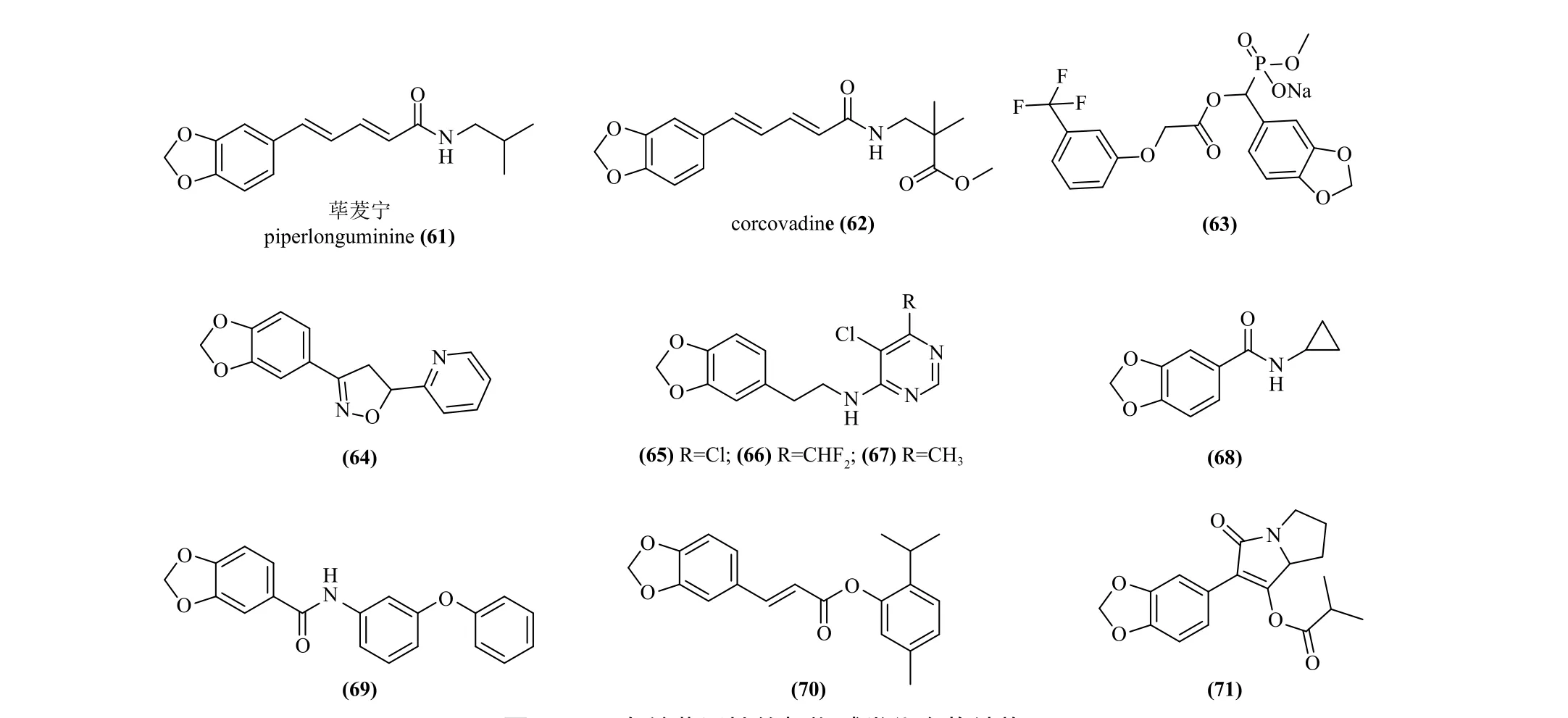
图10 具有杀菌活性的胡椒碱类化合物结构Fig. 10 Structures of piperine compounds with fungicidal or bactericidal activity
总之,胡椒碱类化合物对植物病原真菌或细菌都具有一定的杀菌作用。如图11 所示,构效关系分析表明,胡椒环结构对其杀菌活性可能是重要的,但桥链部分与杀菌活性的关系在不同物种中有所差别,同时哌啶环部分似乎也不是必须的,这就赋予了胡椒碱较大的结构改造空间。但是,目前有关胡椒碱及其类似物抑菌的分子机制尚未见报道,作用靶标也未明确,这是基于胡椒碱独特骨架结构进行进一步合理设计和改造以期发现活性优异的抑菌候选物的瓶颈。因此,后续研究中还需对胡椒碱及其类似物的作用机制进行深入地研究,为开发靶向关键病虫害生物功能蛋白的高活性胡椒碱类化合物奠定关键基础。
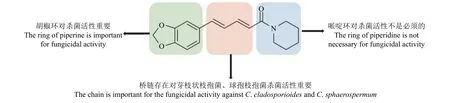
图11 胡椒碱类化合物与杀菌活性构效关系Fig. 11 Structure-activity relationship between piperine compounds and fungicidal activity
近年来,胡椒碱的增效作用也引起了人们的广泛关注,有研究表明胡椒碱可通过增加分子的溶解度和生物利用度等理化性质以提高商品化杀菌剂的防效。2018 年,王勇等将胡椒碱和丁香酚按照质量比3 : 1~1 : 1 进行复配制得增效杀菌剂,在离体及田间试验发现其对草莓灰霉病具有良好的防效,该复配剂可作为对己苯并咪唑类及二甲酰亚胺类杀菌剂产生抗药性的草莓灰霉病防治的替代药剂[90]。同年,王勇等还发明了胡椒碱与啶酰菌胺增效复配的杀菌剂,在油菜菌核病及草莓灰霉病的防治中,该复配剂防效显著,且能显著降低化学药剂啶酰菌胺的用量,有望成为新一代环保、高效和低毒的农用杀菌剂[91]。
综上所述,虽然已有多种糖基和拟糖基类海藻糖酶抑制剂被报道,但这些抑制剂普遍存在诸多问题,如:结构单一、合成困难、缺乏安全性和较少杀虫 (菌) 活性报道等。最近本课题组研究发现的新型胡椒碱类化合物作为海藻糖酶抑制剂具有结构简单、便于合成,有较大的改造空间,且表现出个体杀虫活性,值得深入研究。
3 总结与展望
近年来,随着农业生产的快速发展,尤其是众多经济作物的大面积栽培,农业病虫害问题日益严重。当病虫害大规模发生时,化学防治仍是最有效的方法,但人类大量不合理的使用化学农药,已经引起了严重的3R 问题,即残留、抗性和有害生物再猖獗等。因此,探索全新的农药靶标并针对新靶标结构进行合理药物设计是解决这一问题的主要手段。海藻糖酶广泛存在于农业有害生物,如:昆虫、细菌、真菌等生物体内且发挥着重要的生物学功能,加之其在农业有害生物和哺乳动物体内的功能存在差异,这表明海藻糖酶可作为安全型杀虫剂或杀菌剂的潜在靶标。目前除了已报道的海藻糖酶抑制剂外,胡椒碱类化合物也被发现具有良好的海藻糖酶抑制活性,且能影响草地贪夜蛾的生长发育,可作为新型昆虫生长调节剂候选先导。胡椒碱类化合物具有多重农用活性,且原料易得、结构改造空间大,在农业病虫害防治领域具有广阔应用前景。本文对已报道的海藻糖酶晶体结构、酶与底物/抑制剂结合的关键氨基酸残基和抑制剂的结构和农用活性进行综述,尤其关注作为潜在海藻糖酶抑制剂的胡椒碱类化合物的农用生物活性,期望为新型胡椒碱类海藻糖酶抑制剂的进一步研究和开发奠定理论基础。
虽然有关海藻糖酶靶标结构、抑制剂及胡椒碱类化合物农用活性的研究已取得一定进展,但仍存在诸多问题亟待解决,如:海藻糖酶晶体结构较少,且尚无昆虫海藻糖酶晶体结构的报道;现有海藻糖酶抑制剂结构较为单一、合成复杂对哺乳动物选择性差,并且鲜有杀虫或杀菌活性的报道。此外,具有农用活性的胡椒碱类化合物的作用机制和作用靶标尚未明确,这使得未来以胡椒碱结构为骨架、以重要靶标结构为靶向的新型农用化学品合理设计与开发存在困难。因此,未来植物保护领域的研究人员应着重解决这些问题,推动以海藻糖酶为靶标的新型农用抑制剂的设计与开发,预期为现代农业有害生物的绿色防治提供全新的解决方案。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

师东梅,女,硕士研究生。2021年毕业于西南大学植物保护学院获植物保护专业学士学位,现就读于中国农业大学理学院农药学专业,研究方向为新农药分子设计与创制。

段红霞,女,教授,博士生导师。2005 年毕业于北京理工大学,获应用化学专业博士学位;2005—2007 年在中国科学院上海药物研究所从事博士后研究;2007 年至今,为中国农业大学理学院应用化学系讲师、副教授、教授。期间于2013—2014 年在美国加州大学戴维斯分校作访问学者研究。重点围绕“人工智能助力的原创靶标导向新农药分子设计与创制”进行科学研究。主要研究方向:1) 靶标选择性导向的低蜂毒杀蚜剂的设计与发现;2) 靶向嗅觉蛋白组策略的新型蚜虫行为控制剂的筛选;3) 重大病虫害几丁质通路中关键糖酶网络调控的植物健康保护剂的合理设计。现任北京农药学会副秘书长,《农药学学报》常务青年编委。
