cbpD基因对溶藻弧菌毒力及相关生物学特性的影响
2022-10-25苏雯晓邓益琴臧树军林梓阳
苏雯晓 ,邓益琴,臧树军 ,王 茜, ,林梓阳, ,冯 娟
1. 上海海洋大学/水产科学国家级实验教学示范中心,上海 201306
2. 中国水产科学研究院南海水产研究所/农业农村部南海渔业资源开发利用重点实验室,广东 广州 510300
3. 天津农学院,天津 300392
4. 海南大学 海洋学院,海南 海口 570228
溶藻弧菌 (Vibrio alginolyticus) 是一种广泛分布于海洋的嗜盐革兰氏阴性菌[1]。近年来,溶藻弧菌已成为我国水产养殖中主要的致病菌[2],其引起的弧菌病可导致养殖动物表皮出血、肾脏发白、内脏充血,特别是在夏季较高的温度下致病率会显著提高[3],造成严重的经济损失。2016年9月,马来西亚杂交石斑鱼 (Epinephelus polyphekadion × E. fuscoguttatus) 幼鱼感染溶藻弧菌,疾病爆发致大量死亡,且分离出来的溶藻弧菌感染鲈鱼死亡率达100%[4]。2019年8月,中国山东某养殖场的太平洋牡蛎 (Crassostrea gigas) 感染了溶藻弧菌,死亡率超过60%[5]。2020年3月,埃及赫尔格达养殖的幼年海参 (Holothuria atra) 感染溶藻弧菌后,皮肤发生溃疡并于3 d内死亡[6]。另外,溶藻弧菌还可以引起人类败血症、食物中毒等疾病[3]。因此,溶藻弧菌不仅能导致大规模的养殖动物死亡,造成负面经济影响,也是潜在的人与水产动物共患病源,可能对人类健康构成风险。
目前,在溶藻弧菌中,已经发现许多与蛋白相关毒力因子,如分泌系统、蛋白酶、生物膜、溶血性等。效应蛋白Val1686可以引起鱼类细胞凋亡[7];溶藻弧菌的ncRNAVvrr1和丙酮酸激酶Ⅰ基因pykF相互作用,分别过表达Vvrr1和敲除pykF基因可以显著降低溶藻弧菌的黏附能力、生物膜形成和毒力[3];敲除Ⅲ型分泌系统T3SS的调控蛋白操纵子基因exsD可导致溶藻弧菌对斑马鱼 (Danio rerio) 的毒力显著上升[8];外膜蛋白A基因ompA缺失后涌动性和生物膜形成出现缺陷,溶藻弧菌毒力降低[9];辅助定植因子acfA通过调节相关基因的表达来负调控生物膜的形成,从而影响溶藻弧菌毒力[10];rpoS可调节细菌黏附能力,是溶藻弧菌毒力的关键调节因子[11]。因此,溶藻弧菌可能通过相关毒力因子或者毒力调控因子影响细菌对宿主的侵袭、黏附、定植以及毒力释放等过程,从而影响细菌对宿主的毒力作用。
几丁质结合蛋白 (Chitin-binding protein D,CbpD) 被视为一种几丁质氧化毒力因子[12],它能够结合在几丁质上。几丁质结合蛋白结合几丁质后,能改变几丁质的物理结构,利于几丁质酶对其进行后续水解[13]。在铜绿假单胞菌(Pseudomona aeruginosa) 中,cbpD缺失导致宿主体内细菌的清除率提高,细菌和宿主蛋白质大量重组,使铜绿假单胞菌无法建立致命的全身感染,致病性降低[14]。目前,关于溶藻弧菌cbpD的研究甚少,前期基因组测序鉴定得到溶藻弧菌毒株ZJ-T中cbpD基因,通过同源重组的方法构建溶藻弧菌ZJ-T的cbpD基因缺失突变株,并通过比较其与溶藻弧菌野生株ZJ-T的生长情况、运动性、药物敏感性等生物学特性以及毒力的差异,为进一步了解cbpD在溶藻弧菌中的功能提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株及质粒
溶藻弧菌ZJ-T、自杀质粒pSW7848、自杀质粒中间宿主大肠杆菌 (Escherichia coli) Ⅱ3813及接合作用供体宿主E. coliGEB883保存于本实验室;本研究所用菌株及质粒见表1,所用引物见表2。

表1 本研究所用菌株及质粒Table 1 Strains and plasmids used in this study

表2 本研究所用引物Table 2 Primers used in this study
1.1.2 主要试剂
用于E. coliⅡ3813生长的2'-脱氧胸苷 (2'-Deoxythymidine, Thy) 购于生工生物工程 (上海) 股份有限公司。用于营养缺陷型E. coliGEB883生长的2,6-二氨基庚二酸 (2,6-Diaminopimelic acid,DAP) 购自西格玛奥德里奇 (上海) 贸易有限公司。高保真酶PrimeSTAR® Max DNA polymerase、限制性内切酶DpnⅠ购自宝日医生物技术(北京)有限公司;等温组装试剂盒 ClonExpress MultiS One Step Cloning Kit 购自南京诺唯赞生物科技有限公司;胶回收试剂盒MagPure DNA Clean Up Kit B购自广州美基生物科技有限公司;用于药敏试验的抗生素纸片购自杭州滨和微生物试剂有限公司;用于胞外蛋白酶测试的脱脂奶粉NON-Fat PowderedMilk、生物膜实验的结晶紫Crystal violet、PBS缓冲液以及用于铁离子吸收测试的铁离子螯合剂2-2'-联吡啶 (2,2'-Dipyridyl, DIP) 购自生工生物工程(上海) 股份有限公司。
1.1.3 主要培养基
LB (Luria-bertani)、LBS (LB with 3% 氯化钠)、TCBS培养基 (Thiosulfate citrate bile salts sucrose agar) 以及血平板购自广东环凯微生物科技有限公司。LB培养基 (g·L-1) 含胰蛋白胨 10 g、酵母提取物 5 g、氯化钠10 g。固体LB培养基含琼脂15 g。LBS培养基 (g·L-1) 中含氯化钠 30 g。
1.2 实验方法
1.2.1cbpD缺失株的构建
参照Deng等[19]方法,构建cbpD缺失株。用引物pSW7848-F/pSW7848-R对质粒pSW7848线性化,用引物dcbpD-U-F/dcbpD-U-R和引物dcbpDD-F/dcbpD-D-R对cbpD编码序列上下游片段进行扩增。等温组装线性化质粒和cbpD上下游同源臂片段,连接后将其转化至中间宿主大肠杆菌E.coliⅡ3813,用引物Del-check-pSW7848-F/R检测连接cbpD上下游同源臂的完整性,随后转化至接合作用供体宿主大肠杆菌E. coliGEB883,用检测引物Del-check-pSW7848-F/R对其扩增后进行电泳检测并测序鉴定,得到连接cbpD上下游片段后的重组自杀质粒pSW7848-cbpDup-cbpDdown。自杀质粒pSW7848不能在溶藻弧菌中复制,且带有氯霉素抗性,阿拉伯糖会诱导pSW7848中的毒性基因ccdB表达[18]。接合实验通过带有葡萄糖和阿拉伯糖两种不同抗性的TCBS平板先后进行两次筛选,使重组自杀质粒上cbpD的上下游同源臂片段与溶藻弧菌ZJ-T基因组的cbpD上下游同源臂先后发生两次同源重组,重组后的单菌落用检测引物DelcbpD-check-F/R进行PCR扩增和测序后,获得溶藻弧菌ZJ-T的cbpD基因缺失株,命名为ZJ-T-ΔcbpD。
1.2.2 不同培养条件下的生长情况测定
将溶藻弧菌ZJ-T和缺失突变株ZJ-T-ΔcbpD的单克隆分别接种至LBS液体培养基,于30 ℃、200 r·min-1摇床振荡培养过夜后,将过夜菌液用新鲜LBS培养液稀释至OD600= 0.001,吸取100 μL至96孔板,利用Tecanspark微孔板检测仪30 ℃、180 r·min-1连续振荡恒温培养,每隔30 min测定OD600。每个样品3个平行,实验至少重复3次。
1.2.3 运动性检测
同1.2.2过夜菌液,用LBS液体培养基调整OD600=1.0,取稀释后菌液5 μL平行3次点样到0.3%和1.5%的琼脂LBS平板,30 ℃静置培养16和24 h,测量菌斑直径,比较菌株的游动和涌动能力,实验至少重复3次。
1.2.4 药敏实验
用纸片扩散法测定溶藻弧菌ZJ-T和突变株ZJT-ΔcbpD对23种抗生素的敏感性。同1.2.2过夜菌液,取200 μL至10 mL新鲜LBS液体培养基混匀后倒入LBS平板,平板浸湿10 min后将剩余菌液倒掉。将各抗生素纸片按压于平板上,30 ℃静置培养24 h,记录抑菌圈直径,通过比对药敏说明书判定敏感性结果 ,实验至少重复3次。
1.2.5 胞外蛋白酶检测
本实验采用脱脂牛奶平板法[20]测定溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD胞外蛋白酶活性,将同1.2.2过夜菌液调整培养液浓度至OD600=5.0,取5 μL平行3次点样到含1%脱脂奶粉的LBS平板上,30 ℃静置培养24 h后,测量蛋白质透明分解圈直径和菌落直径,两者的比值为蛋白酶的分泌能力[20],实验至少重复3次。
1.2.6 溶血性测定
用绵羊血平板测定溶藻弧菌的溶血活性,蘸取同1.2.2过夜菌液于血平板划线,30 ℃静置培养24 h,观察平板溶血情况,实验至少重复3次。
1.2.7 对过氧化氢 (H2O2)、铜离子 (Cu2+) 抗性及对铁离子 (Fe3+) 的吸收测试
参考邓益琴等[21]的方法,同1.2.2过夜菌液,将培养液浓度调至相同吸光度OD600=5.0,并作10倍倍比稀释,取各倍比稀释浓度菌液各5 μL平行3次点样到LBS平板作为对照,点样至终浓度为 0.003% H2O2、4.5 mmol·L-1CuSO4或 150 μmol·L-1DIP的LBS平板上,用于测试突变后对H2O2和Cu2+的抗性及对Fe3+的吸收能力。在30 ℃恒温培养箱静置培养24 h,观察菌落生长情况,实验至少重复3次。
1.2.8 生物膜测试
同1.2.2过夜菌液,用LBS培养液将菌液浓度稀释至OD600=1.0,吸取1 mL至无菌24孔培养板,30 ℃静置培养48 h;将菌液吸出后吹干培养板,并加入PBS缓冲液洗涤1次;倒置晾干后,用10%甲醇固定20 min,固定结束后吸出甲醇并吹干;加入0.1%结晶紫染液室温静置染色20 min,吸取染液,用PBS缓冲液洗去多余染液;用95%乙醇染色,室温反应30 min后使用酶标仪测定OD570。实验至少重复3次。
1.2.9 斑马鱼毒力实验
本实验以斑马鱼为动物模型,测定溶藻弧菌ZJ-T缺失cbpD对细菌毒力的影响。在广州好易生水族店购入体质量约0.3 g的斑马鱼,26~28 ℃暂养1周。挑取ZJ-T和ZJ-T-ΔcbpD单克隆分别接种至LBS斜面培养基中,30 ℃静置培养过夜,用3 mL 0.85%生理盐水洗脱菌落并测菌体浓度,将菌液稀释至OD600=0.3。实验设3个平行,对照组注射40 μL 0.85%生理盐水,实验组ZJ-T和ZJ-TΔcbpD斑马鱼腹腔注射40 μL OD600=0.3的菌液(2.32×108~2.71×108CFU),每组 3个重复。
2 结果
2.1 cbpD缺失株的构建与验证
以引物pSW7848-F/pSW7848-R扩增得线性化pSW7848质粒约3 300 bp (图1-a)。以ZJ-T基因组为模板,引物dcbpD-U-F/dcbpD-U-R和dcbpD-DF/dcbpD-D-R扩增得cbpD上游片段约870 bp,cbpD下游片段约1 000 bp (图1-b)。等温组装连接自杀质粒和cbpD上下游片段,重组自杀质粒pSW 7848-cbpDup-cbpDdown长度约2 170 bp (图1-c),与设计的片段大小相符。经过接合实验两次同源重组后,用检测引物Del-cbpD-check-F/Del-cbpD-check-R验证,野生型ZJ-T扩增片段约1 670 bp,突变株PCR扩增得片段约540 bp (图1-d),符合预期片段大小,cbpD缺失株ZJ-T-ΔcbpD构建成功。

图1 缺失株ZJ-T-ΔcbpD的构建注:a. 质粒 pSW7848 线性化条带;b. cbpD 上下游片段,泳道 2 为 cbpD 上游同源臂,泳道 3 为 cbpD 下游同源臂;c. 重组自杀质粒PCR 鉴定扩增片段;d. cbpD 缺失株的鉴定,泳道 5 为野生株扩增结果,泳道 6 为潜在突变株扩增结果。Fig. 1 Construction of deletion strain ZJ-T-ΔcbpDNote: a. Plasmid pSW7848 linearization band; b. cbpD upstream and downstream fragments, and Lane 2 is the upstream, while Lane 3 is the downstream; c. PCR to identify segment of recombinant suicide plasmid; d. Identification of cbpD deletion strain, Lane 5 is the amplification result of the wild strain, and Lane 6 is the amplification result of the potential mutant strain.
2.2 cbpD缺失对溶藻弧菌ZJ-T生长的影响
溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD在富营养的LBS培养基中生长,在24 h培养时间里,潜伏期为培养初期1 h,在1 h后进入对数期,经过7 h后进入生长稳定期,ZJ-T的稳定期生长量略高于突变株ZJ-T-ΔcbpD,但野生株和突变株总体生长期无显著差异 (图2)。
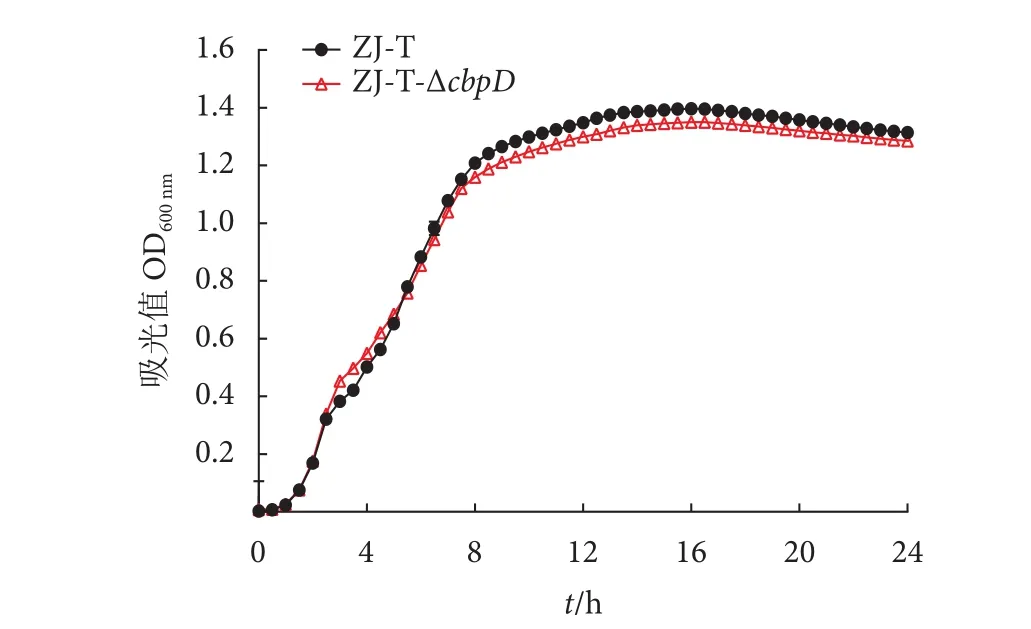
图2 LBS培养基中的生长曲线Fig. 2 Growth curves in LBS culture
2.3 运动性检测
将野生株ZJ-T和突变株ZJ-T-ΔcbpD接种在0.3%琼脂LBS平板,观察游动性变化。菌株在30 ℃培养16 h后,野生株ZJ-T显示出较明显的游动能力,以点样处为中心向四周游动 (图3),突变株ZJ-T-ΔcbpD游动能力显著降低 (P<0.05,图4)。在1.5%琼脂LBS平板观察涌动能力变化,30 ℃培养24 h后,ZJ-T呈现在点样处朝四周涌动现象,而突变株ZJ-T-ΔcbpD未出现扩散现象,只在点样处生长,菌斑表面光滑,由不透明转变为半透明 (图3),涌动能力显著下降 (P<0.01,图4)。

图3 溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD的运动性Fig. 3 Mobility of V. alginolyticus ZJ-T and mutant strain ZJ-T-ΔcbpD
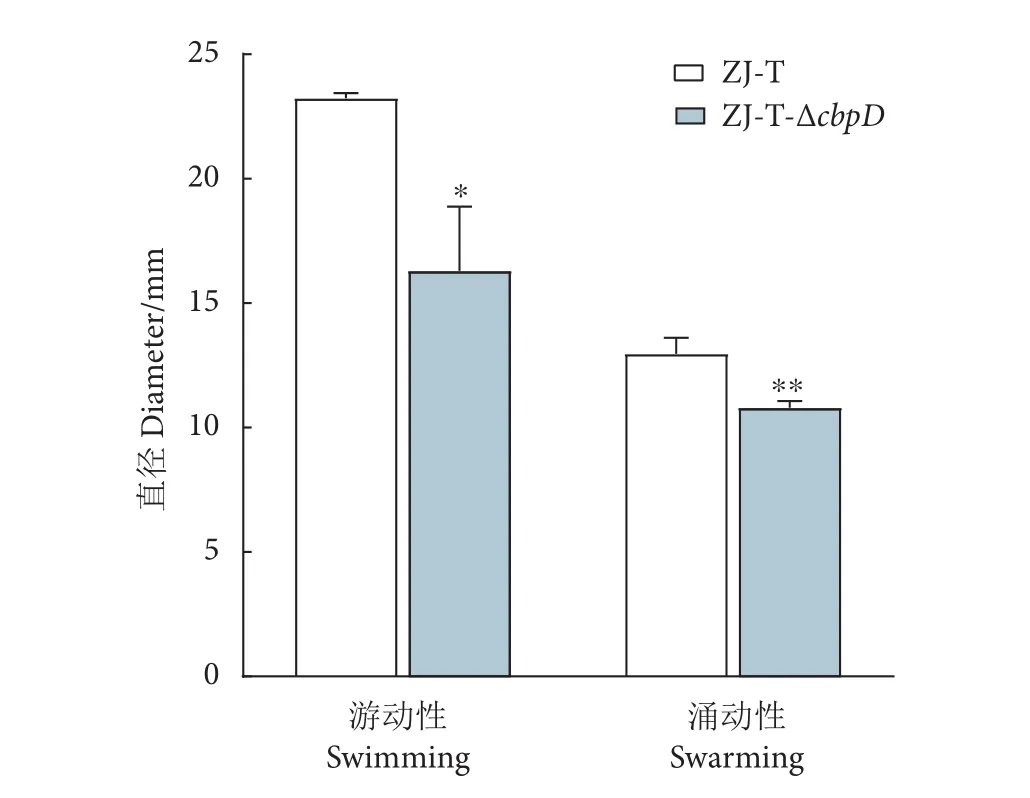
图4 运动性统计分析注:*. P<0.05;**. P<0.01;图 5-a、8-b同此。Fig. 4 Motility statistical analysisNote: *. P<0.05; **. P<0.01; The same case in Fig. 5-a and 8-b.
2.4 cbpD缺失对耐药性的影响
本实验中利用纸片扩散法测定溶藻弧菌ZJT和突变株ZJ-T-ΔcbpD对克拉霉素、利福平、阿莫西林等23种抗生素的药物敏感性,实验结果见表3。溶藻弧菌ZJ-T缺失cbpD后,突变株ZJ-TΔcbpD对克拉霉素的敏感性由高度敏感变为中度敏感。野生株ZJ-T和突变株ZJ-T-ΔcbpD对利福平、阿莫西林、磺胺异噁唑、麦迪霉素等13种抗生素具有抗性,对多西环素、氟苯尼考、妥布霉素、环丙沙星等10种抗生素有不同程度的敏感,但溶藻弧菌野生株ZJ-T和突变株ZJ-T-ΔcbpD对以上抗生素的敏感性没有差异。

表3 药敏试验结果Table 3 Drug sensitivity tests results of ZJ-T and ZJ-T-ΔcbpD
2.5 胞外蛋白酶活性变化
cbpD缺失后,蛋白质透明分解圈直径与菌落直径的比值显著上升 (P<0.01,图5),溶藻弧菌ZJ-T缺失cbpD后蛋白酶的分泌能力增强。
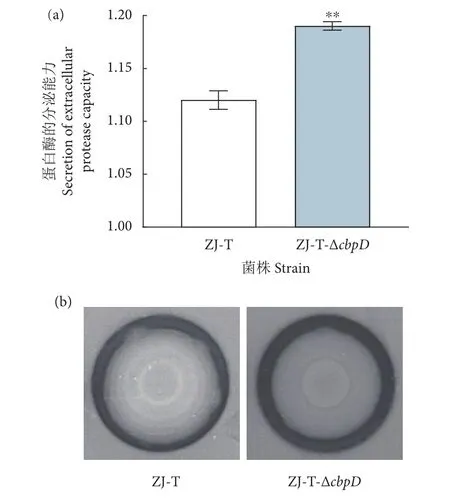
图5 蛋白酶分泌能力注: a. 蛋白质透明分解圈直径与菌落直径的比值;b. 脱脂牛奶平板图。Fig. 5 Secretion of extracellular protease capacityNote: a. The ratio of protein transparent decomposition circle diameter to colony diameter; b. Picture of skim milk plate.
2.6 溶血活性
溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD在血平板上均未出现溶血圈 (图6)。溶藻弧菌ZJ-T本身无溶血活性,且cbpD缺失后溶藻弧菌ZJ-T的溶血性没有发生改变。
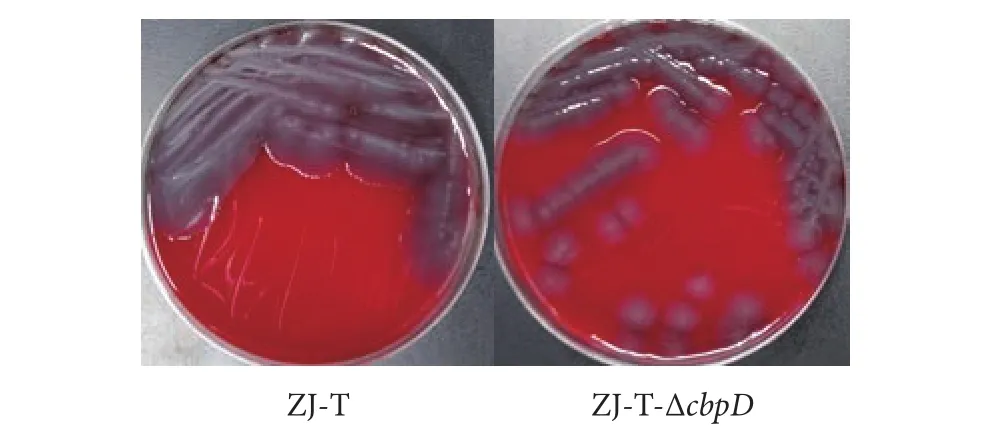
图6 溶藻弧菌ZJ-T和ZJ-T-ΔcbpD的溶血性Fig. 6 Hemolytic activity of V. alginolyticus ZJ-T and ZJ-T-ΔcbpD
2.7 cbpD缺失对H2O2、Cu2+抗性及对Fe3+吸收的影响
ZJ-T和ZJ-T-ΔcbpD点样在LBS平板和分别含有H2O2、CuSO4、DIP的LBS平板上,随着稀释倍数的增加,菌落数减少。在0.003% H2O2-LBS平板,稀释倍数达10-2以后野生株和突变株均不再生长;在4.5 mmol· L-1CuSO4-LBS平板,稀释倍数达10-1时,ZJ-T菌落开始逐渐不再生长,而突变株ZJ-T-ΔcbpD菌落数比野生株要多,在稀释倍数达10-4时仍有存活,缺失cbpD后对Cu2+的抗性增加;两者在150 μmol·L-1DIP的LBS平板生长无显著差异,突变不影响ZJ-T对Fe3+的获取能力 (图7)。

图7 溶藻弧菌ZJ-T和ZJ-T-ΔcbpD对过氧化氢、硫酸铜以及铁离子螯合剂2-2'-联吡啶的敏感性注:a. LBS 琼脂平板;b. 0.003% H2O2-LBS 平板;c. 4.5 mmol·L-1 CuSO4-LBS 平板;d. 150 μmol·L-1 DIP-LBS 平板。Fig. 7 Sensitivity to H2O2, CuSO4 and DIP of wild type and cbpD mutant on LBS plateNote: a. LBS agar plate; b. 0.003% H2O2-LBS agar plate; c. 4.5 mmol·L-1 CuSO4-LBS agar plate; d. 150 μmol·L-1 DIP-LBS agar plate.
2.8 生物膜形成
ZJ-T和ZJ-T-ΔcbpD结晶紫染色后,可见培养孔底部有菌体沉淀,突变株ZJ-T-ΔcbpD生物膜的平均形成量相对野生株无显著变化 (图8,P>0.05)。

图8 生物膜形成量Fig. 8 Biofilm formation
2.9 cbpD缺失对斑马鱼毒力的影响
对斑马鱼进行称质量,体质量约为0.34 g。斑马鱼腹腔注射溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD菌液后,注射野生型菌株ZJ-T第24、第48 、第72、第96小时斑马鱼的成活率分别为68.89%、62.22%、60.00%、60.00%;而cbpD突变后,成活率提高至97.78%、97.78%、95.56%、91.11%,成活率较野生型显著提高 (P<0.01,图9)。
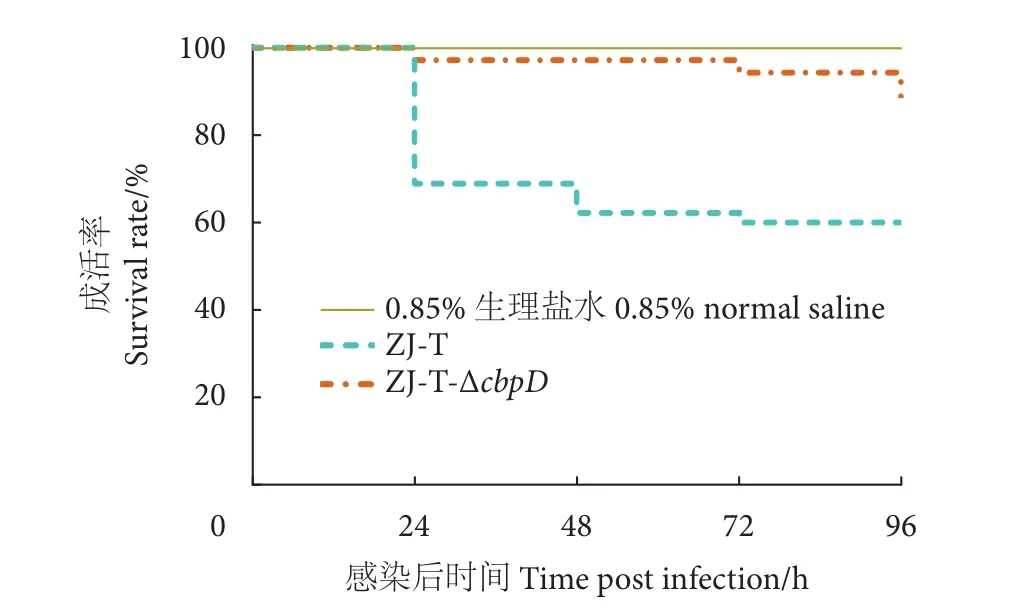
图9 溶藻弧菌ZJ-T和突变株ZJ-T-ΔcbpD感染斑马鱼后成活率Fig. 9 Survival rate of V. alginolyticus ZJ-T and mutant strain ZJ-T-ΔcbpD after infection of D. rerio
3 讨论
几丁质结合蛋白编码基因cbpD编码表达裂解多糖单氧酶 (Lytic polysaccharide monooxygenases,LPMOs)。LPMOs能利用分子氧分解糖苷键,具有铜依赖性,可将聚合碳水化合物转化为可利用碳源,参与微生物病原和病毒的感染循环[22]。LPMOs分为结构域为辅助活动族9 (Auxiliary activity 9,AA9) 的真菌纤维素活性酶和辅助活动族10 (Auxiliary activity 10, AA10) 的细菌几丁质活性酶。具有几丁质酶活性的AA10酶与细菌发病机制有关,AA10结构域的LPMOs——GbpA和lmo2467分别为霍乱弧菌 (V. cholerae) 和李斯特菌 (Listeria monocytogenes) 的毒力因子[22]。霍乱弧菌中的几丁质结合蛋白GbpA参与霍乱弧菌的定殖,GbpA与黏蛋白相互作用,协调霍乱弧菌的黏附能力,gbpA突变体在小鼠体内的肠道粘附能力显著下降[23]。李斯特菌编码几丁质结合蛋白的lmo2467缺失后在小鼠的肝脏和脾脏中的感染量均显著降低,在脾脏中的感染量只有野生型的1/6[24]。此外,LPMOs也与铜绿假单胞菌和粘质沙雷氏菌 (Serratia marcescens)的毒力有关[25]。本研究发现,溶藻弧菌ZJ-T敲除cbpD后,突变株ZJ-T-ΔcbpD对斑马鱼的毒力显著下降,且细菌游动性、涌动性以及胞外蛋白酶活性显著降低,而突变株相对于野生株的生物膜形成能力、对Fe3+的吸收利用和H2O2的耐受力无显著差异,但cbpD缺失后对Cu2+的敏感性降低。药敏试验表明,溶藻弧菌ZJ-T缺失cbpD后,对克拉霉素的敏感性由高度敏感变为中度敏感,所测试的其余抗生素敏感性在cbpD突变后无显著差异,溶藻弧菌对大多数所测抗生素耐药,cbpD的缺失不影响溶藻弧菌对所试验的其余22种抗生素的药物敏感性。野生株和突变株在绵羊血平板上均不出现溶血圈。
运动性是许多病原体入侵和定殖的重要原因之一,也是细菌聚集并形成生物膜的先决条件[26]。本研究中溶藻弧菌ZJ-T的cbpD突变后运动性显著降低,cbpD可能与鞭毛的形成有关,且cbpD缺失后细菌运动能力降低可能导致对斑马鱼的毒力下降。大量研究表明,鞭毛蛋白对于鞭毛运动是必不可少的,它对弧菌的定殖能力有极大影响,并与某些细菌的毒力密切相关[27]。溶藻弧菌胞外蛋白酶基因pep缺失后,虽仍有极性鞭毛,但在固体琼脂平板生长时无法产生侧鞭毛,导致运动性显著降低[28]。Zhou等[29]研究发现,溶藻弧菌T3SS伴侣护卫vscO与溶藻弧菌的鞭毛有关,vscO基因缺失使细菌涌动能力下降从而毒力降低。胞外产物包括胞外蛋白酶、溶血素和铁载体,其中胞外蛋白酶是感染过程中的致病因子[30]。本研究cbpD缺失后,胞外蛋白酶活性降低,cbpD可能对溶藻弧菌的定殖和黏附能力有调控作用。如通过调控溶藻弧菌运动性和胞外蛋白酶活性,从而影响细菌的黏附和定殖能力,进而影响细菌毒力。溶藻弧菌EPGS的组氨酸激酶基因baeS缺失后,BaeS分泌的毒力因子碱性丝氨酸蛋白酶Asp活性显著降低[31]。此外,霍乱弧菌中的几丁质结合蛋白GbpA与霍乱弧菌的定殖能力有关,gbpA缺失后对感染小鼠肠道的黏附能力下降[23]。
致病菌的应激反应能增强防御不利环境的能力,氧化应激系统能清除影响生长繁殖和定殖宿主的活性氧等有害分子[32]。铜的两种氧化状态能参与基本的氧化还原反应,过量Cu2+还能促进大量活性氧的形成,对细菌细胞产生毒性,对细胞产生损伤[33]。铜对细菌的毒性主要表现在病原入侵宿主时宿主的防御机制上,铜排出能避免致病菌铜中毒[34]。细菌的Cu2+抗性对于定殖和毒力必不可少[35]。Kong等[36]用50 mg·L-1五水硫酸铜处理溶藻弧菌后,溶藻弧菌黏附能力显著降低,进一步转录分析测序发现溶藻弧菌携带的铜耐受基因表达水平在经Cu2+处理后表达量增加。CusS-cusR双组分系统能传感和响应重金属离子,当环境中Cu2+浓度增加时,双组分系统会诱导铜耐受基因cusCFBA的表达,以维持细胞中Cu2+的稳态[37]。本研究中突变株受Cu2+刺激时细菌损伤降低,说明突变株对Cu2+的敏感性下降,Cu2+对细菌细胞产生的毒性降低。cbpD突变可能增强了清除损伤细菌的活性氧等有害分子的能力,影响了铜耐受基因的表达,cbpD也可能与ZJ-T对活性氧等有害分子的调节有关。此外,cbpD可能与大部分LPMOs类似,具有铜依赖性。
目前对于弧菌病的防治仍以抗生素为主,长期使用会使细菌产生耐药性[38]。溶藻弧菌T3SS基因tyeA突变后对四环素、氯霉素、卡那霉素、多西环素从敏感转为耐药[27]。本研究中cbpD缺失对溶藻弧菌耐药性无显著影响。溶血活性被认为是许多致病性弧菌的毒力因子,包括霍乱弧菌、副溶血弧菌 (V. parahaemolyticus)、溶藻弧菌、哈维氏弧菌(V. harvey)和创伤弧菌 (V. vulnificus)[39]。哈维氏弧菌rseB基因RpoE操纵子断裂后,在血平板上的溶血活性降低,在凡纳滨对虾 (Litopenaeus vannamei)中的定殖能力和毒力均减弱[39]。而本研究发现,cbpD缺失前后溶藻弧菌在绵羊血平板上均不产生溶血圈,说明溶藻弧菌ZJ-T无溶血性,其毒力与ZJ-T溶血活性无关。生物膜是微生物群落的普遍特征,是微生物适应环境、抵御不良环境因素的手段[40]。本研究中cbpD缺失后生物膜形成能力无显著变化,说明cbpD可能不参与溶藻弧菌生物膜形成相关基因的调控。今后笔者将对野生株和cbpD突变株的基因表达进行分析,通过比较cbpD突变前后基因表达的差异并结合本研究中发现的生物学特性差异,找出cbpD可能调控的靶标基因,并深入研究cbpD和靶标基因的相互作用机制,从而阐明cbpD对溶藻弧菌毒力的调控机制。
4 结论
本文通过基因敲除技术成功构建溶藻弧菌ZJTcbpD基因突变株ZJ-T-ΔcbpD,斑马鱼腹腔注射敲除株发现:cbpD缺失后斑马鱼的相对成活率提高,cbpD敲除株可作为开发抗溶藻弧菌减毒活疫苗潜在菌株;cbpD缺失后细菌的运动性和胞外蛋白酶活性均显著降低,cbpD可能通过影响细菌鞭毛形成、胞外蛋白酶分泌以及对宿主的黏附和定殖等,从而影响细菌对宿主的毒力;cbpD缺失后对Cu2+的耐受力增强,cbpD可能影响溶藻弧菌清除活性氧或其他有害因子的能力。
