水产养殖环境中抗生素抗性基因 (ARGs) 研究进展
2022-10-25李丹怡王许诺张广桔王增焕
李丹怡,王许诺,张广桔,王增焕,黄 珂
1. 中国水产科学研究院南海水产研究所/广东省渔业生态环境重点实验室/农业农村部水产品加工重点实验室,广东 广州510300
2. 广州市花都排水有限公司,广东 广州 510800
随着人们对动物食源需求的增加,全球水产养殖产量呈指数增长,中国作为世界第一水产养殖大国,其产量约占全球水产养殖产量的61.62%[1]。在市场的推动下,水产养殖模式逐渐向规模化、集约化发展,抗生素作为养殖药物已被普遍用于防治疾病、促进生长和节省饲料营养成分等[2]。然而,水产养殖中使用的大量抗生素 (约80%) 未被水生生物吸收,其与水生生物的排泄物将进入水体或沉降聚集于底泥中,是抗生素耐药性在环境中传播扩散的重要来源[3]。
20世纪40年代,抗生素类药物首次被应用于治疗人类严重感染疾病,从化学结构上可将其分为氨基糖苷类、四环素类、β-内酰胺类、喹诺酮类、酰胺醇类、大环内酯类和多肽类等[4]。低浓度抗生素也具有很高的生物活性,在各种环境介质中均能被检出,即使是低剂量暴露 (纳克每升水平) 也会严重损害水生生物和人类机体功能[5]。抗生素在畜牧、水产养殖和医药等领域的长期滥用导致了环境介质中抗生素抗性基因 (Antibiotic resistant genes, ARGs) 和抗生素耐药菌 (Antibiotic resistant bacteria, ARB) 的残留。ARGs作为一种新型环境污染物[4],可在环境中持久残留,并通过在菌株间迁移传播加速抗生素耐药性的扩散。当ARGs进入水库或养殖环境中,现有处理技术未能将其完全除去[6],ARGs可通过食物链传递最终危及人类健康。由于难以完全禁止抗生素的投加使用,如何管控水产养殖行业中抗生素的使用以有效遏制抗性基因污染仍然任重道远。
针对ARGs的潜在危害性、难以去除等特点,本文对ARGs的污染现状、来源、迁移与传播及影响因素,与抗生素、微生物群落和环境因素之间的关联特性,潜在风险,管控策略和削减技术等进行了系统地综述,并对今后ARGs的管控对策和研究方向提出建议,以期为揭示水产养殖环境中ARGs的污染机理、遏制抗生素抗性传播提供借鉴。
1 水产养殖环境中ARGs的污染现状
目前中国水产养殖业常用的抗生素主要有阿莫西林、恩诺沙星、红霉素、氟苯尼考、磺胺嘧啶和磺胺甲恶唑等[7]。近年来,抗生素在环境中的残留水平不断提高,如珠江[8]、九龙江[9]和太湖[10]中抗生素的最高质量浓度达到微克每升水平,且中国南部茅尾海域附近的海水养殖场中检出14种抗生素 (分属于磺胺类、氟喹诺酮类、大环内酯类和氯霉素类)[11]。此外,在沉积物、土壤和许多农产品中均检测到抗生素残留[12-13]。根据联合国粮食及农业组织(Food and Agriculture Organization of the United Nations,FAO) 发布的统计数据,中国7.7%的水产品中抗生素残留超标[14]。与抗生素残留相比,ARGs由于在环境中具有持久性、可移动性和可传导性,呈现出更高的生态毒害效应,环境中ARGs的潜在风险正逐步成为人们关注的重点[15]。
近年来在养殖水体、底泥、水生生物以及病原体等介质中普遍检出ARGs,包括四环素类抗性基因 (tetA、tetB、tetC、tetD、tetE和tetG)、喹诺酮类抗性基因 [qnrA、qnrB、qnrS1和aac(6')-Ib-cr]、大环内酯类抗性基因(mphA和erm)、氨基糖苷类抗性基因 [ph、aad和aac(6')-Ib]、氯霉素类抗性基因 (catA2、cml和floR)、β-内酰胺类抗性基因 (blaCTX-M和blaTEM) 和磺胺类抗性基因 (sul1、sul2和sul3)等[16-17]。Pereira等[18]在葡萄牙鲑鱼养殖场水体和沉积物中均检测出高含量的四环素类抗性基因和氟喹诺酮类抗性基因。Gao等[17]研究也表明在中国天津水产养殖环境中四环素类抗性基因 (tetM、tetL和tetO) 与磺胺类抗性基因 (sul1和sul2) 具有较高丰度。无独有偶,Cesare等[19]在意大利鲷鱼和石斑鱼养殖场沉积物中也发现了四环素类抗性基因 (tetM、tetL和tetO) 和磺胺类抗性基因 (sul1和sul2)。由此可见,在水产养殖业中抗性基因污染非常普遍,具有全球性特点,且四环素类抗性基因和磺胺类抗性基因检出频率较高,这两类基因的环境毒理效应应成为水产养殖环境中的重点关注对象。除此之外,由于水产养殖业交叉使用多种抗生素,水源、养殖生物肠道及其排泄物和生物膜等其他介质中也存在不同类型的ARGs [qnrD、floR、cmlA和aac(6')-Ib等] 污染[20-22]。
2 水产养殖环境中ARGs的来源、迁移与传播
2.1 ARGs的来源与暴露途径
水产养殖环境中ARGs来源广泛,主要来源包括细菌的内在抗性和外源输入。内在抗性即细菌基因组中存在可以产生抗性表型的基因,细菌通过表达潜在抗性基因或随机突变获得耐药性。微生物的内在抗性实际上是为了适应自然进化,部分ARGs早已存在于自然界,而不是由于抗生素的使用造成的[23]。自然环境介质中微生物产生的抗性基因浓度在环境中较低,而外源输入是目前环境中抗性基因残留的主要来源[24]。外源输入是指自然界中存在对抗生素具有固有耐药性的细菌,或携带抗生素耐药性的肠道细菌随着人畜粪便的排放进入水环境[25]。肠道细菌携带的遗传信息可通过横向转移机制转移到环境土著菌中,进而将抗生素耐药性转移到水生生物体内[26]。ARGs主要以水、空气和土壤等环境介质作为储库和迁移扩散的媒介,畜禽养殖、污水处理厂出水和医院废水排放,以及堆肥中的固体有机物残留等都是ARGs进入环境的主要途径[27-28]。
多品种集约化水产养殖模式极易促进传染病在水生生物中的传播,抗生素滥用加速抗生素耐药性的产生,ARGs逐渐进入健康的水生生物体内,进而在体内形成抗生素耐药性模块[29]。此外,池塘中残留的抗生素可在水体和沉积物中累积,并对当地细菌群落施加抗生素选择性压力[30],土著菌通过染色体随机突变或基因水平转移产生抗生素耐药性,进而利用基因交换扩散引起池塘及周围环境中微生物抗生素耐药水平的上升[31]。因此,水产养殖系统越来越被认为是ARGs的蓄积库,且能有效促进ARB的增加[32],其能够为编码细菌抗性的可移动遗传元件 (Mobile genetic elements, MGEs) 的水平交换提供理想环境。深入解析水产养殖环境中ARGs的来源和暴露途径,有利于准确建立关于ARGs的风险评估方法及控制治理策略。
2.2 ARGs的迁移与传播
抗生素耐药性问题被称为“21世纪重大健康安全的挑战”[33],ARGs在水产养殖环境中的分布、迁移与传播扩大了污染面,并加剧了抗性基因污染的复杂特性。水体是污染物的重要载体,且ARGs和ARB极易在水环境中迁移扩散,因此水体是抗生素抗性进入水产养殖环境的重要媒介。由于现有技术难以完全除去污水处理厂和畜禽养殖场中的ARGs和ARB,其会被排放至受纳水体(如河流)中,最终进入以河流为水源的水产养殖环境中[34]。
ARGs的主要转移机制是水平转移 (Horizontal gene transfer, HGT),仅少数位于染色体上的ARGs通过垂直扩散 (Vertical gene transmission, VGT) 进行传播。ARGs主要复制机制是利用水平转移使位于质粒、转座子或整合子等MGEs上的遗传物质转移到相关或不相关的细菌菌属中[35]。在这些MGEs中,整合子在介导抗生素耐药性转移和传播上具有极大优势,它们通过捕获和整合一个或多个基因盒,并将其转化为功能表达基因,因而迅速获得多种抗性基因[36]。大多数可移动ARGs能够利用MGEs通过结合、转化和转导等方式在养殖水体、生物膜和沉积物的微生物区系间进行水平转移[37]。垂直扩散则主要是通过细菌增殖分裂来完成,分裂过程中ARGs可作为遗传物质从亲代传递给子代。ARGs在环境中可持续残留,即使携带ARGs的细胞裂解消亡,其携带ARGs的裸露DNA仍可通过水平或垂直扩散转移至其他菌株中[38]。携带编码抗性基因菌株的养殖生物经排泄后可将ARGs和ARB转移至周围生态环境和人居环境中,进而对生态和人类安全构成威胁。水产养殖环境中ARGs的来源、分布和迁移传播过程如图1所示。
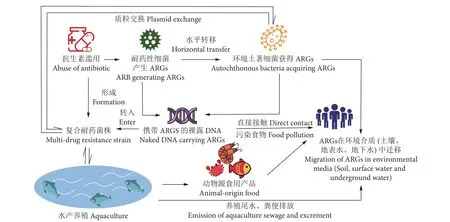
图1 水产环境中ARGs的来源、迁移与传播Fig. 1 Source, migration and spread behavior of ARGs in aquaculture environment
2.3 ARGs迁移与传播的影响因素
水产养殖环境是一种受人类活动影响的半自然环境,为进一步阐释水产养殖环境中ARGs的迁移与传播规律,应系统研究环境因素和人类活动对ARGs迁移传播的影响。影响水产养殖环境中ARGs迁移与传播的因素主要包括以下3类。
1) 自然环境影响因素。在碱性或高溶解氧的海洋环境中,细菌具有良好的增殖能力,能够促进ARGs在不同属的细菌之间进行水平转移[39]。水动力条件可能是影响ARGs在水体中迁移和扩散的主要因素,当处于旱季时,蒸发作用引起养殖水体表面积缩小,ARGs富集[40],且水体中诱导ARGs水平迁移的污染物 (如重金属、持久性有机污染物和营养物质) 浓度也升高[41]。此外,旱季的低温环境不利于ARGs衰减,这是由于携带ARGs的微生物在低温条件下更具优势[42]。
2) 养殖场自身影响因素。养殖模式、养殖周期和微生物群落等差异性均会影响ARGs的分布与迁移情况。据Wu等[43]报道,不同海水养殖区测得的ARGs含量存在显著差异,而且从饲养期到收获期,鱼类体内ARGs总含量显著增加 (P<0.01)。Su等[44]研究发现,成虾肠道内ARGs浓度是幼虾的2.45~3.92倍 (P<0.05),且成虾肠道内微生物丰度变化更显著。此外,家禽粪便中存在的MGEs可能会加速ARGs的水平迁移[45],I型整合子 (intI) 介导的ARGs迁移转化是养殖环境中抗性基因污染的重要途径。Zhou等[46]研究指出,在鱼、鸭混养池塘中,鸭粪会携带ARGs (AmpC β-内酰胺酶基因) 进入鱼塘,arsB和arsC均与I型整合子整合酶基因 (intI1) 呈现显著正相关关系 (P<0.05),ARGs具有迁移转化潜力。
3) 养殖场周边其他人为活动影响因素。与养殖场相邻的工业区排出的废水中重金属对抗生素具有协同选择效应,能够促进抗生素抗性的传播,同时使ARGs的丰度维持在较高水平[47-48]。重金属不仅对ARGs的迁移转化产生协同作用,还极易导致菌株产生多重抗药性[49]。Zhou等[46]研究揭示了头孢噻肟抗生素在重金属砷的协同作用下能够加剧ARGs的迁移转化进程。此外,城市化程度也会引起ARGs的分布差异,如sul1基因的丰度与城市化程度具有显著相关性[50]。
综上,影响ARGs迁移与传播的因素十分复杂。随着全球对抗生素耐药性传播的担忧日益加剧[51],很有必要开发先进的分析模型以加深对ARGs传播机理的研究。其中,数学模型在揭示ARGs传播规律方面的应用日益广泛,如可以利用数学建模定量评估ARGs的迁移传播行为,其中建模须考虑ARGs复制、水平转移的传播动力学以及自然衰减机制 (水解、光解和ARGs沉积等)。基于此,已有研究利用数学建模来评估耐药细菌在环境中传播的影响因子[52]。
3 水产养殖环境中ARGs与抗生素、微生物群落和环境因素之间的关联特性
抗生素滥用现象日趋严重,其诱导产生的ARGs具有普遍存在、持续残留和可迁移转化等特点,携带ARGs的微生物能够随着水体、水生生物的活动等迅速扩散到周围环境,而ARGs在迁移传播过程容易受到外界环境因素的干扰。因此,很有必要开展ARGs与抗生素、微生物群落和环境因素之间的关联性分析,为进一步阐明ARGs在环境介质中的迁移、传播和归趋等行为提供依据。
3.1 ARGs与抗生素之间的关联特性
现阶段,关于抗生素的使用历史和ARGs的产生之间的关联机制仍未明确。研究表明,水产养殖废水中高浓度ARGs (如tetB和tetD) 可能与四环素类抗生素的频繁使用有关[53]。Zhou等[46]指出,环境因素压力增加 (即头孢噻肟浓度上升) 会导致ARGs含量升高,同时头孢噻肟会改变水体和生物膜中ARGs、微生物群落的分布。可见,抗生素在水产养殖环境中的分散性将促进ARGs的产生。然而,Zhao等[54]研究揭示了抗生素和ARGs的存在及其不一致的相关性。与此同时,Zhang等[55]研究也表明,长江 (江苏段) 中磺胺类抗生素和sul类基因之间无显著相关性,且喹诺酮抗性基因 (qnrC/16S-rRNA) 丰度与恩诺沙星浓度呈现负相关关系。由此可见,较高的抗性基因丰度可能与抗生素的选择性压力相关,但并非所有抗生素的使用都能引起相应ARGs丰度的增加,抗生素的使用历史和ARGs的产生之间的相关性未达成一致观点,需要进一步开展研究。
3.2 ARGs与微生物群落之间的关联特性
微生物群落主要通过MGEs的转移获得抗性基因,其介导行为对ARGs的分布、迁移与转化起到了重要作用[44],微生物群落与ARGs之间可能存在显著相关性。在大型湖泊养殖系统中,变形菌门和拟杆菌门被鉴定为ARGs的潜在优势宿主[56],且变形菌门属于ARB的优势菌门,类似结果在其他环境介质 (城市河流[57]、淡水[58]或饮用水[59]等) 中均得到了验证。网络分析方法可以为阐明复杂环境中ARGs与其潜在宿主之间的关系提供新视角。Wu等[43]利用网络分析方法揭示了假交替单胞菌 (Pseudoalteromonassp.) 与sul2之间存在正相关关系,假交替单胞菌可能是sul类基因的宿主。此外,Su等[44]研究发现,虾肠道内的变形菌门与sul1、qnrD,厚壁菌门与floR、sul2,疣菌门与floR、sul2之间均存在显著正相关关系,优势菌门的差异是导致虾肠道内ARGs丰度升高的主要原因。弧菌是海水养殖环境中常见的细菌种群,由于其在沿海水域的丰富性和多样性,一直被视为抗生素耐药性的储库。在属水平上,弧菌是海洋环境中最占优势的ARB[60]。综上,ARGs与微生物群落之间相关性显著,拥有基因水平转移内在机制的微生物类群可能是ARGs的潜在优势宿主。
3.3 ARGs与环境因素之间的关联特性
目前,水产养殖中ARGs与环境因素之间相关性的系统研究尚很缺乏[56]。与其他环境因素相比,盐度对ARB和ARGs的影响最为显著,盐度与弧菌的丰度呈正相关关系[43],而与大多数ARGs呈负相关关系,例如sul类基因丰度的降低与河口盐度的显著增加有关[61]。对东江流域水质进行跟踪监测发现[62],ARGs的丰度与流域水体的总磷、总氮、总有机碳以及铜 (Cu)、锌 (Zn) 浓度呈现一定相关性。在梅斯基塔尔河谷的土壤中,长期污水灌溉导致ARGs、硫 (S) 和磷 (P) 浓度升高,且硫和磷的浓度与抗生素耐药性水平呈现正相关关系[63]。除此之外,氧含量、光照和温度等因素均会影响环境中残留ARGs的降解过程,例如在厌氧或光照条件下,ARGs丰度显著下降,且高温能够加速部分大环内酯类抗性基因和磺胺类抗性基因的降解[64]。在开放性环境中,ARGs的分布、迁移与传播机制会受到多种因素的干扰,环境因素是否适宜是决定ARGs能否进行水平转移的重要条件。
抗生素的选择性压力、微生物群落的介导作用以及环境因素干扰等被认为是促进ARGs不断扩散、转化的主要因素[65-66],其中微生物群落的改变对ARGs的影响最显著[67]。残留抗生素通过影响原生生物区系和对环境微生物施加选择性压力来干扰微生物系统,且环境因素 (水温、营养成分和溶解氧等) 能够改变微生物群落特征,进而影响ARGs的丰度和迁移传播行为[67-68]。ARGs与抗生素、微生物群落和环境因素之间的关联特性见图2。系统研究ARGs与抗生素、微生物群落和环境因素之间的关联特性已成为揭示ARGs在水产养殖环境中分布特征和转归规律的重点问题,对该科学问题的深入认识将有助于提出ARGs减控的有效策略。
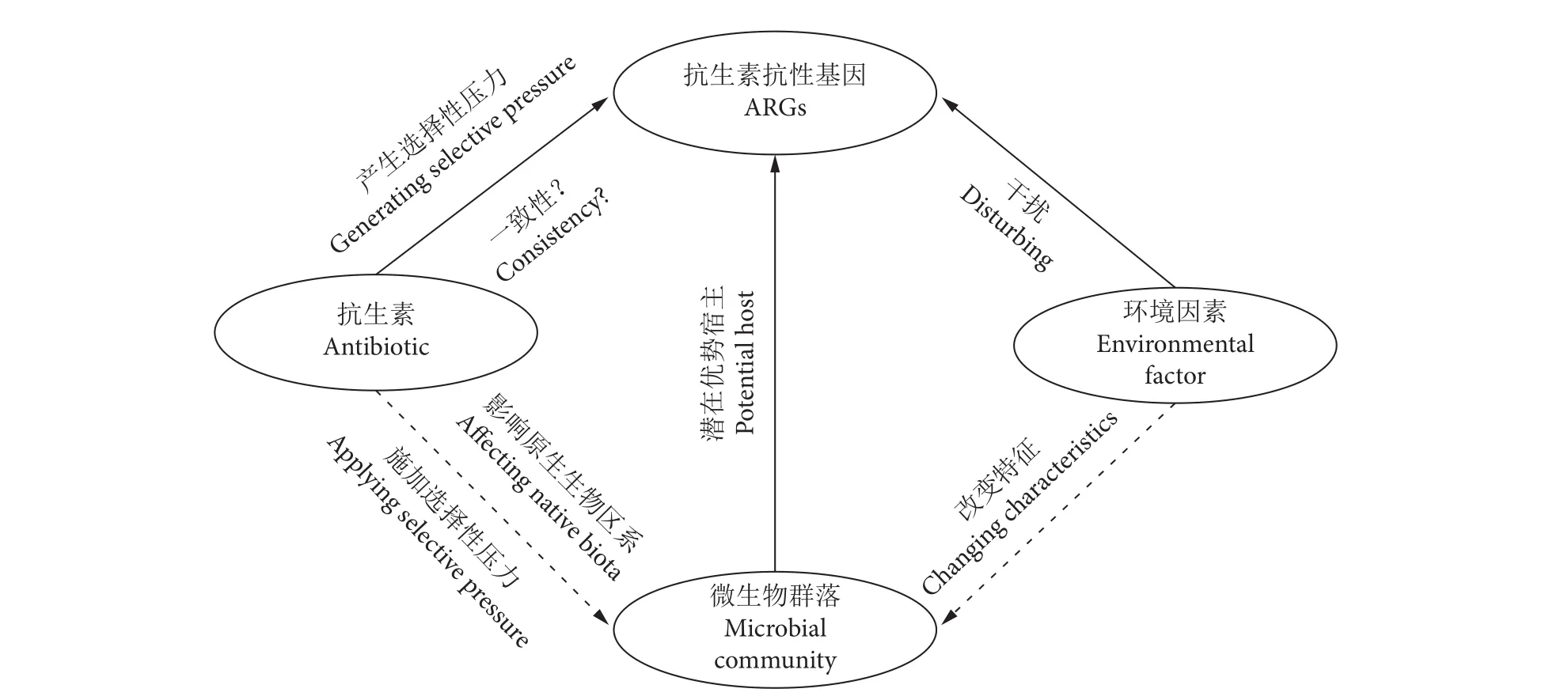
图2 水产养殖环境中ARGs与抗生素、微生物群落和环境因素之间的关联特性Fig. 2 Correlations between ARGs and antibiotics, microbial communities and environmental factors in aquaculture environment
4 水产养殖环境中抗生素、ARGs和ARB对生态环境与人类健康的影响
水产养殖环境中ARGs的来源、迁移与传播行为决定了抗性基因污染现状的复杂性,而ARGs与抗生素、微生物群落和环境因素之间的关联特性影响着其分布特征、迁移与传播规律。ARGs的潜在污染极易对生态与人类安全造成长期、不可逆的危害,特别是多重耐药性菌株的出现会削弱各种疾病的治疗效果,这已然成为一项重大的公共卫生挑战[69]。
4.1 抗生素、ARGs对生态环境和人类健康的影响
当抗生素进入水生环境,可能对野生非目标物种 (藻类和细菌) 产生毒性效应,危害动物早期发育过程,并通过细菌毒害作用破坏浮游动植物的多样性,而且影响浮游植物叶绿素的产生[70]。藻类是食物链的基础,藻类数量的微小变化都会影响水生系统的平衡,与水蚤和鱼类相比,藻类对抗生素 (如四环素类) 更加敏感[71-72]。抗生素的残留还会导致水生生物的生长障碍和免疫抑制,引起肠道微生物群落的改变[73]。如前所述,这些改变反过来会在生态系统各个层级上产生负面影响,引起食物链变化,极易导致生态失衡。环境中抗生素的残留还会对生态系统的功能产生潜在影响,抗生素通过杀死或抑制微生物的生长进而打破生态系统中微生物之间的平衡,例如利用被抗生素残留污染的废水灌溉农田会导致重要固氮菌群的消亡[74]。此外,水产养殖业中残留的抗生素不仅直接影响到水产品质量,还可被野生鱼类摄入从而威胁捕捞渔业产品的安全。人类食用抗生素残留物的后果包括药物不良反应和临床重要病原菌耐药性的发展,例如青霉素G、四环素类和磺胺类药物的抗原性可能引起消费者过敏反应,且残留在人体中的药物积累将导致“慢性毒性”,极易损伤器官[75]。
ARGs已广泛分布于多种水体介质中,如地表淡水[76]、城市河流[77]和沿海地带[78],水生环境中潜在的ARGs可通过质粒介导的整合子转移到非致病菌中[79]。在自然环境中,ARGs从非致病菌到病原体的传播可能比抗生素本身能产生更大的生态毒理效应[80]。抗生素抗性基因已被世界卫生组织 (Word Health Organization, WHO) 确定为21世纪威胁人类健康的最重大挑战之一[81]。长时间低水平接触抗生素会诱导鱼类肠道细菌产生抗生素耐药性,ARGs通过结合作用能够转移至人类病原体内[82]。携带ARGs的人畜共患病病原体 [如气单胞菌属 (Aeromonas)] 既能够对动物宿主造成感染,又可以通过直接接触水产养殖设施或通过食源性感染间接传递给人类[83]。此外,人类肠道和皮肤的微生物群可通过ARGs的迁移传播污染水生环境[84],而水体的自然稀释和降解作用均无法消除ARGs[85]。
4.2 ARB对生态环境和人类健康的影响
当环境中抗生素的浓度超过特定阈值,便会产生选择性压力以促进ARB的产生与扩散[86]。虽然部分ARB本身不具备致病性,但其可通过将耐药基因转移到病原体中[87],从而降低抗生素对病原体引起的疾病的治疗有效性。利用人或动物粪便作为鱼塘肥料是一种资源化、高效的养殖模式,但是通过粪-口途径传播的肠道病原体、ARB以及通过鱼类传播的人畜共患吸虫已被确认为是亚洲废弃物喂养-水产养殖模式的潜在健康隐患[88]。Trang等[89]指出,接触废弃物喂养-水产养殖模式的工人患腹泻、皮肤病和肝吸虫感染的风险提高,而当水体或鱼类中存在ARB时,患病风险可能加剧。
现阶段仍缺乏关于水产养殖中ARB潜在的公共健康影响的综合性研究报告,而且ARGs与ARB的剂量响应曲线和暴露评估方法的依据还未形成,微生物定量风险评估(Quantitative microbial risk assessment, QMRA) 被认为是一种适合评价和量化人类健康风险的方法[90]。通过采用荧光定量PCR、下一代测序分析结合水质理化参数检测等方法研究鱼塘水体污染源、病原体、ARB和其他微生物群落,能够鉴定其与水产养殖作业相关的潜在健康风险[91]。
5 水产养殖环境中ARGs的控制策略与去除技术
为了有效消除ARGs迁移传播引起的基因污染隐患,亟需开展ARGs的控制策略研究,全程管控源头预防至末端治理环节,并针对性选用有效削减ARGs污染的处理技术,达到双管齐下的效果。
5.1 控制策略
实际上,减少和优化水产养殖行业中抗生素的使用是从源头上抑制动物源性ARGs产生与传播的最直接方法。丹麦曾在动物工业中停止使用非治疗性抗生素,结果发现在1~2年内,动物和肉制品中的ARGs与ARB含量显著降低[92]。耐药性的产生通常与细菌对环境的适应度降低有关,减少抗生素使用,将有助于适应性较强的易感菌淘汰耐药菌[93]。其次,寻找抗生素替代品,如其他添加剂 (植物源性产品、益生菌和益生元等),将有助于改善动物健康状况和降低食品中食源性致病菌的风险[94]。抗菌肽凭借其有效的抗生素功效和较弱的耐药性诱导能力,被认为是抗生素的有效替代品[95]。此外,提供良好的渔业养殖环境卫生、持续监控水产养殖作业的规范性和严格管制养殖尾水的达标排放对于阻断抗生素耐药性的传播途径至关重要。制定关于抗生素、ARGs和ARB监测的标准化方法,并建立全球共享数据库,其中数据库囊括全球关于抗生素的使用情况,ARGs的污染现状、传播机制和潜在风险,以及应对ARGs威胁的措施等信息。至于末端治理,通过谨慎处理养殖尾水和废弃物可减少抗生素和ARGs释放到环境中。当环境中抗生素驱动的选择性降低时,ARGs在不同生态位中的迁移和增殖均被遏制。
5.2 去除技术
有效处理养殖尾水是控制ARGs迁移转化的关键,处理技术的差异很大程度上会影响ARGs的归趋。现有对ARGs的去除方法包括物理法、化学法和生物法等。关于ARGs的去除技术及效果见表1。
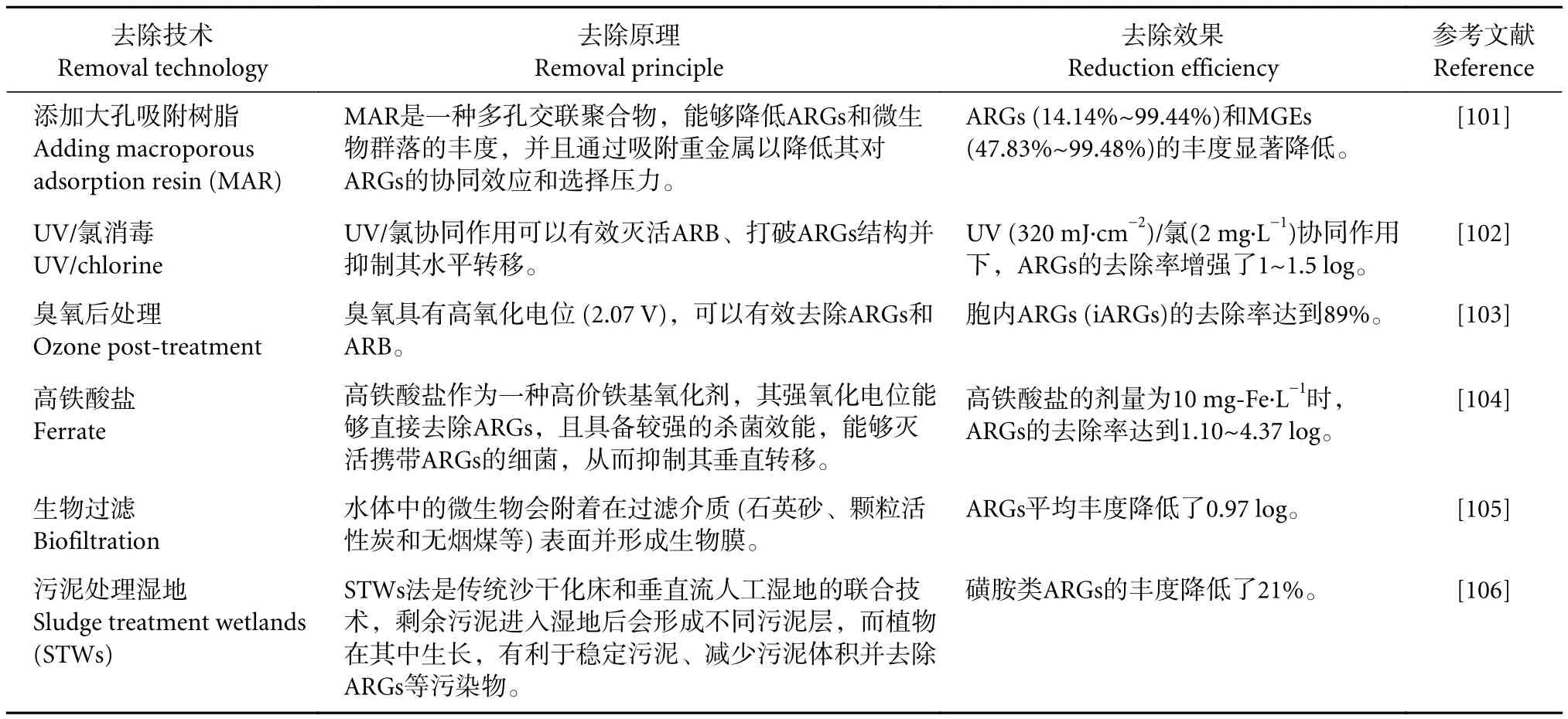
表1 现有技术对ARGs的去除效果Table 1 Reduction efficiency of ARGs by existing technologies
物理法主要包括吸附、混凝、过滤、沉淀和紫外消毒等技术,具有成本低、工艺简单等优势,可作为后续生化处理的预处理。常用的吸附剂种类有活性炭、生物炭和火山渣等,吸附处理未能使抗生素或ARGs失效,后续还需对其进行降解和处理、解析吸附剂。投加混凝剂 (聚合硫酸铁、聚合氯化铝和聚丙烯酰胺等) 可使水体中游离的ARB与悬浮物、胶体物质和溶解性有机物凝聚成大分子物质,经沉淀或过滤处理后抗性菌株及其携带的ARGs均被去除。此外,UV能够直接被DNA吸收,从而破坏ARGs结构,UV消毒在合适剂量下既不会生成消毒副产物 (DBPs),也不存在残留物。据Guo等[96]报道,当UV剂量为5 mJ·cm-2时,UV消毒能够有效去除水中红霉素类抗性基因和四环素类抗性基因。
化学法主要包括臭氧氧化、光催化氧化,芬顿氧化和氯消毒等技术。高级氧化法 (AOPs) 在去除抗生素和ARGs方面具有很大优势,如优异的去除效能和良好的环境相容性等,可提高渔业养殖用水的卫生安全性。AOPs涉及原位生成高活性自由基,如羟基或硫酸根,能够去除大量有机化学品和生物制剂。其中,电氧化法可以同步除去致病细菌、抗生素和ARGs[97]。Hou等[98]应用上下流厌氧污泥床 (UASB),缺氧-好氧池 (A/O) 结合4个独立的AOPs系统 (UV、臭氧、芬顿和芬顿/UV) 处理实际药物废水,结果发现能够同时高效去除18种抗生素和10种ARGs。
生物法主要有传统的生物处理工艺、氧化塘和人工湿地处理等。生物处理具有经济性和可重复利用性,但经生物处理后形成的抗生素降解中间产物可能存在毒性增强的风险。传统活性污泥法难以去除养殖尾水中的抗生素 [例如磺胺甲恶唑(SMX)、四环素和文拉法辛等][99],而且污泥作为ARGs的蓄积库,能够加剧ARGs的水平转移。近年来,移动床生物膜反应器(MBBR)系统已被证实是处理含抗生素废水的有效技术[99]。Marti等[58]通过向MBBR中添加无色杆菌JL9(Achromobacter JL9) 以强化对养殖尾水中SMX的生物降解 (80.49%)。然而,MBBR中生物量较高,可能存在ARGs水平转移的风险,仍需探寻高效去除ARGs的耦合新工艺,比如组合AOPs技术 [H2O2/紫外线C波段辐照(UV-C),催化活化过一硫酸盐 (PMS)/UV-C和PMS/Fe(II)/UV-C等]对ARGs进行深度处理[100]。
6 总结与展望
目前水产养殖业中抗生素滥用形势依旧严峻[107],不仅加剧了ARGs水平转移的连锁传递,而且导致抗性菌株的丰度和抗性强度不断增加,抗性基因的生态污染和毒性效应持续恶化。如何在水产养殖环境中合理使用抗生素、消除抗生素耐药性和阻断其传播途径已成为人们关注的世界性难题。鉴于此,未来可从3个方面进一步开展ARGs研究:
1) 从整体角度来研究抗生素耐药性,即研究重点需囊括人类、动植物以及各种环境单元 (水、土壤和空气等) 介质,持续监测并借助数学建模研究ARGs的来源、分布和迁移传播机制,并建立关于ARGs的生态毒理效应评价体系和环境安全基准体系,为今后控制ARGs污染和提高水产品安全性提供借鉴。
2) 采取新的多元化替代性治疗策略以抑制抗生素耐药性的发展,如使用化学抑制剂 (包括酶抑制剂、外排泵抑制剂、细菌生物膜形成抑制剂和其他多重耐药机制靶向分子等) 作为抗生素耐药性感染的附加治疗。同时深入研究并明确影响耐药性传递的主要菌株,对其进行针对性灭活以阻断抗性基因的传递,养殖过程中应减少与重金属、微塑料等污染物接触,避免在共选作用下ARB向多重耐药菌发展。
3) 改进ARGs的检测方法,如采用第三代基因测序技术 (PacBio) 以获得更长的DNA序列,从而更精确地识别ARGs及其相邻基因,为研究MGEs和携带ARGs的细菌宿主提供有利信息。此外,针对ARGs迁移转化过程进行安全调控,并开发有效去除ARGs和抗性菌株的关键技术和集成工艺,以期进一步提高ARGs的去除效能。
