马氏珠母贝闭壳肌活性肽制备及其辅助降血糖功效评价
2022-10-25林海生秦小明曹文红高加龙郑惠娜章超桦谭绮晴
廖 津 ,林海生 ,伍 彬 ,秦小明 ,曹文红 ,高加龙 ,郑惠娜 ,章超桦 ,谭绮晴
1. 广东海洋大学 食品科技学院/国家贝类加工技术研发分中心 (湛江)/广东省水产品加工与安全重点实验室/广东省海洋生物制品工程实验室/水产品深加工广东普通高等学校重点实验室,广东 湛江 524088
2. 暨南大学 食品科学与工程系,广东 广州 510632
3. 大连工业大学海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034
目前,糖尿病 (Diabetes mellitus, DM) 患病人数呈逐年增加趋势,已成为人类健康的重大威胁之一[1]。根据国际糖尿病联盟 (The International Diabetes Federation, IDF) 的统计数据,2019年全球糖尿病患者已超4.63亿,预测至2045年仍将继续增长51%[2]。目前临床医学上,糖尿病患者的治疗通常采用服入α-葡萄糖苷酶抑制剂类型的药物,其能有效减慢人体对食品中葡萄糖的吸收利用,达到餐后降血糖的效果[3]。然而,传统药物治疗往往有较大的副作用[4]。因此寻找副作用小且经济的降血糖物质是未来研究的趋势。研究发现,水产动物来源的蛋白酶解物具有较好的α-葡萄糖苷酶抑制活性[5-6],同时也被认为是一种潜在的辅助降血糖功能食品的原料来源[7-8]。然而,以贝类为原材料酶法制备具有α-葡萄糖苷酶抑制活性的肽类的研究却鲜有报道。
海洋贝类是重要的渔业资源,其富含蛋白质、氨基酸、微量元素、牛磺酸等营养功能成分,是制备生物活性肽的优质原料[9-10]。现代酶解技术是蛋白高值化利用制备活性肽的主要方法之一。目前已报道贝类酶解物的生理功效包括抗氧化[11-12]、降血糖[13]、降血压[14-15]、促伤口愈合[16]和保护肝脏[17]等。马氏珠母贝 (Pinctada martensii)、华贵栉孔扇贝 (Chlamys nobilis) 和栉江珧 (Atrina pectinate) 是我国主要的养殖贝类,主要集中在广东、广西和海南等地,养殖产量极高。其闭壳肌大、味道鲜美、营养丰富。目前,除了鲜食外,闭壳肌主要被加工成干贝、即食贝柱、速冻贝柱、贝柱罐头[18]等方便食品,精深加工利用程度较低。目前尚未见有其在降血糖领域的应用报道。为了进一步挖掘海洋贝类生物活性肽的潜在辅助降血糖营养功能食品的开发价值,本研究选用新鲜华贵栉孔扇贝、马氏珠母贝和栉江珧闭壳肌为研究对象,采用酶法水解制得酶解产物,研究其对α-葡萄糖苷酶的抑制活性,并以小鼠作为动物试验对象进行降血糖活性验证,为海洋贝类资源高值化利用提供思路,也为开发新型辅助降血糖营养功能食品提供理论依据。
1 材料与方法
1.1 材料与试剂
马氏珠母贝和华贵栉孔扇贝均购自湛江市雷州市流沙湾养殖场;栉江珧购自湛江市东风市场。
风味蛋白酶 (57 821 U·g-1)、复合蛋白酶 (62 784 U·g-1)[诺维信 (中国) 生物技术有限公司];α-葡萄糖苷酶、对硝基苯基-α-D-吡喃葡萄糖苷 (p-Nitrophenyl-α-D-glucopyranoside, pNPG) (上海源叶生物科技有限公司);Folin-酚蛋白定量试剂盒 (北京鼎国昌盛生物技术公司);可溶性淀粉 (北京索莱宝科技有限公司);小鼠胰岛素 (INS) 酶联免疫分析 (ELISA) 试剂盒 (江苏雨桐生物科技有限公司);碳酸钠、甲醛、盐酸、氢氧化钠、三氯乙酸等均为分析纯。
雄性昆明小鼠,购自珠海百试通生物科技有限公司,饲养于广东海洋大学实验动物中心[SYXK(粤) 2019-0204]。
1.2 仪器与设备
UNIVERSAL 320R台式高速冷冻离心机 (德国Hettich科学仪器公司);VARIOSKAN FLASH全波长扫描式多功能酶标仪 (赛默飞世尔科技公司);SHZ-B水浴恒温振荡器 (上海博讯医疗仪器股份有限公司);HHS数显式电热恒温水浴锅 (上海博迅实业有限公司医疗设备厂);罗氏活力血糖仪、罗氏血糖试纸 [罗氏诊断产品 (上海) 有限公司];FDU-551真空冷冻干燥机、N-4000真空旋转蒸发仪 (EYELA东京理化器械株式会社)。
1.3 方法
1.3.1 不同蛋白酶酶解产物的制备
鲜活贝类洗净开壳取闭壳肌,沸水漂烫5 min后,纱布过滤,滤液浓缩冻干后,得到水提物;漂烫后的贝类组织按1∶3 (m∶V) 的料液比加水匀浆,调节pH至7.0,按照酶添加量5 000 U·g-1(依据原料蛋白质质量添加) 加入蛋白酶 (风味蛋白酶、复合蛋白酶),50 ℃水浴振荡器中进行酶解3 h,100 ℃ 灭酶,于 8 000 r·min-1离心 10 min取上清液,冻干得到酶解产物。通过测定酶解物中游离氨基酸态氮含量、短肽含量和α-葡萄糖苷酶抑制活性,筛选出最佳用酶。
1.3.2 酶解工艺对酶解产物 α-葡萄糖苷酶抑制活性的影响
以马氏珠母贝闭壳肌作为研究对象,以复合蛋白酶作为试验用酶,参照1.3.1所述酶解方法,分别考察酶解时间、酶添加量、酶解温度和酶解pH 4个因素对酶解产物中α-葡萄糖苷酶抑制活性的影响。在最佳酶解工艺条件下,制备马氏珠母贝闭壳肌酶解产物 (Enzymatic hydrolysate ofP. martensiiadductor muscle, EHPA)。
1.3.3 游离氨基酸态氮的测定
参考GB 5009.235—2016 《食品安全国家标准 食品中氨基酸态氮的测定》的操作步骤进行检测。
1.3.4 短肽含量的测定
参考柏昌旺等[19]方法稍加修改,取酶解上清液按照体积比1∶1 加入10%的三氯乙酸 (TCA),混匀后 4 ℃ 离心 (8 000 r·min-1, 10 min),取上清液稀释一定倍数测定。分别取40 μL样品溶液和200 μL Folin‒酚试剂甲液,室温放置10 min,加入20 μL Folin‒酚试剂乙液混匀静置30 min后,在500 nm处测定其吸光度。选用牛血清白蛋白 (BSA)作为标准品,按照相同方法建立标准曲线。样品测定吸光度对照标准曲线计算短肽质量浓度。获得吸光度数据,使用Excel 2020软件绘制短肽含量的标准曲线,得到回归方程:y=0.756 8x+0.030 4,该曲线的R2为0.993 8,线性较好,可作为Folin‒酚试剂定量测量的依据。
1.3.5 α-葡萄糖苷酶抑制活性测定
采用pNPG法测定α-葡萄糖苷酶抑制活性,参考Zhang等[20]和林海生等[21]的方法稍作修改。α-葡萄糖苷酶抑制率 (Ri) 计算公式如下

式中:A样品为样品组吸光度,样品+α-葡萄糖苷酶+pNPG;A样品空白为样品空白组吸光度,样品+PB (磷酸盐缓冲溶液) +pNPG;A对照为对照组吸光度,PB+α-葡萄糖苷酶+pNPG;A空白为空白组吸光度,PB+PB+pNPG;
1.3.6 EHPA 对小鼠糖耐量的影响
参考延海莹等[3]方法,EHPA以不同比例与蒸馏水混溶后得到受试物。所有小鼠试验前适应性喂养1周,禁食12 h后,采用血糖试剂盒检测空腹血糖,随机分为5组,不同剂量试验组分别为:低剂量组 500 mg·kg-1、中剂量组 1 000 mg·kg-1、高剂量组 2 000 mg·kg-1、分别记为 EHPA‒L、EHPA‒M、EHPA‒H,阳性对照组 (PC组,二甲双胍150 mg·kg-1)和空白对照组 (NC组),每组10只小鼠。连续灌胃受试物3 d,空白组灌胃蒸馏水,记录体质量,计算体质量增长率 (%)。灌胃第4 d,禁食12 h,测定空腹血糖。各组与可溶性淀粉250 mg·kg-1混合同时灌胃,测定灌胃淀粉后各组0.5和2 h的血糖。并计算血糖曲线下面积 (AUC, mmol·min·L-1)。
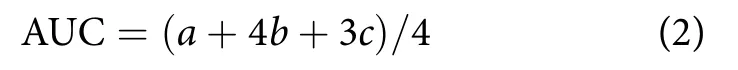
式中:a为灌胃前血糖 (mmol·L-1);b为灌胃0.5 h血糖 (mmol·L-1);c为灌胃 2 h 血糖 (mmol·L-1)。
1.3.7 EHPA 对小鼠空腹血糖的影响
小鼠禁食不禁水12 h,采用尾部静脉取血取小鼠尾尖血,使用罗氏活力血糖仪及血糖试纸测定小鼠血糖,重复2次。分别在灌胃前及结束后测定空腹血糖。

式中:Rh为降糖率 (%); FBG0为给药前空腹血糖浓度 (mmol·L-1);FBG1为给药结束后空腹血糖浓度(mmol·L-1)。
1.3.8 EHPA 对血清胰岛素的影响
EHPA对正常小鼠血糖的影响试验结束后,小鼠经眼球取血后,采用脱颈位法处死。室温血液自然凝固 10~15 min,10 000 r·min-1离心 10 min,收集上清液,置于-80 ℃保存。采集脏器称质量,取0.5 g肝脏加入9倍质量生理盐水后匀浆制备成组织匀浆液,-80 ℃保存,使用前10 000 r·min-1离心10 min取上清液4 ℃保存备用。根据试剂盒使用说明书操作,在450 nm波长下测定吸光度(Optical density, OD) 绘制标准品标准曲线,根据曲线计算各组小鼠血清胰岛素浓度并计算出各组胰岛素敏感指数和胰岛素分泌指数。
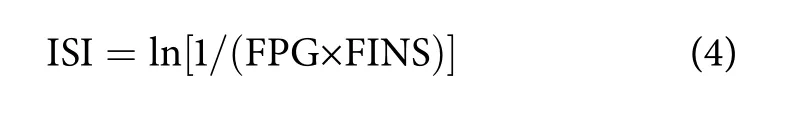

式中:ISI为胰岛素敏感指数;FPG为空腹血糖浓度 (mmol·L-1);FINS为空腹胰岛素浓度 (mmol·L-1);FBCI为胰岛素分泌指数。获得吸光度数据,使用Excel 2020 软件绘制胰岛素含量的标准曲线,得到回归方程:y=0.043 7x+0.011 2,R2为0.999 2,线性较好。
1.3.9 数据统计分析
每组试验至少重复3次,采用Excel 2020软件整理数据及作图,用SPSS 25.0软件进行统计学分析,表中数据为“平均数±标准误 ()”。
2 结果与分析
2.1 不同蛋白酶对贝类闭壳肌酶解效果评价
适当热预处理可加大酶对蛋白质的水解程度[22],并可有效调控蛋白质水解产物组成[23-24]。另外,高温可灭活易对试验造成干扰的贝类内源蛋白酶,并杀死微生物。因而,本研究采用热漂烫法对闭壳肌进行预处理,并将漂烫后水提物作为单独一组进行对比分析。不同蛋白酶对贝类闭壳肌酶解产物游离氨基酸态氮质量分数的影响见图1。酶解产物中游离氨基酸态氮质量分数显著高于水提物 (P<0.05)。风味蛋白酶酶解产物游离氨基酸态氮质量分数高于复合蛋白酶酶解产物,其中华贵栉孔扇贝风味蛋白酶酶解产物此指标最高。造成此差别主要是由贝类组织蛋白结构和蛋白酶作用位点的不同所致,复合蛋白酶主要成分是内切酶和端肽酶,而风味蛋白酶是氨基端外切酶[24]。

图1 不同蛋白酶对贝类闭壳肌酶解产物游离氨基酸态氮质量分数的影响注:不同小写字母的组间差异显著 (P<0.05),后图同此。Fig. 1 Effect of different protease on mass fraction of free amino acid nitrogen in hydrolysate of shellfish adductor muscleNote: Different lowercase letters indicate significant difference between groups (P<0.05); the same case in the following figures.
短肽浓度能够衡量酶解产物的品质[25]。三氯乙酸法是一种理想的短肽提取方法[26-27],通常采用三氯乙酸沉淀蛋白酶解液中的大分子肽段,并通过测定上清液中肽的浓度定义为短肽浓度[19],李佳芸等[7]发现马氏珠母贝酶解产物中93.88%的短肽分子量小于2 000 D,这与孙建忠[28]用三氯乙酸沉淀法提取的林蛙油短肽分子量接近。酶解产物短肽质量浓度的测定结果见图2。酶解产物短肽质量浓度显著高于水提物,表明酶解过程释放出大量短肽物质。3种贝类闭壳肌的复合蛋白酶酶解产物中,短肽质量浓度均显著高于其风味蛋白酶酶解物,马氏珠母贝和华贵栉孔扇贝闭壳肌的酶解产物中,短肽质量浓度显著高于栉江珧酶解产物 (P<0.05)。

图2 不同蛋白酶对闭壳肌酶解产物短肽质量浓度的影响Fig. 2 Effect of different protease on mass concentration of short chain polypeptide in hydrolysates of shellfish adductor muscle
综上,本研究所用的2种蛋白酶均能有效酶解贝类闭壳肌。采用风味蛋白酶有利于酶解产物的风味呈现[29],而从酶解产物中有效成分出发,复合蛋白酶更适合后续研究[30]。
2.2 不同酶解产物对α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶抑制活性是衡量糖尿病疗效的重要科学依据[31]。在酶解产物的短肽质量浓度(16 mg·mL-1) 相同的情况下,贝类闭壳肌酶解产物对α-葡萄糖苷酶抑制活性的影响结果见图3。3种贝类闭壳肌的复合蛋白酶酶解产物均大于风味蛋白酶酶解产物,且马氏珠母贝和华贵栉孔扇贝的复合蛋白酶解产物 (两者无显著差异,P>0.05) 显著强于栉江珧 (P<0.05)。另外,本研究发现,栉江珧的水提物也表现出较强的α-葡萄糖苷酶抑制活性,显著高于其他两种贝的水提物 (P<0.05)。海洋贝类水提物中富含矿物质、氨基酸、牛磺酸、胆碱、水溶性多糖等物质,多具有显著的生物活性[32]。
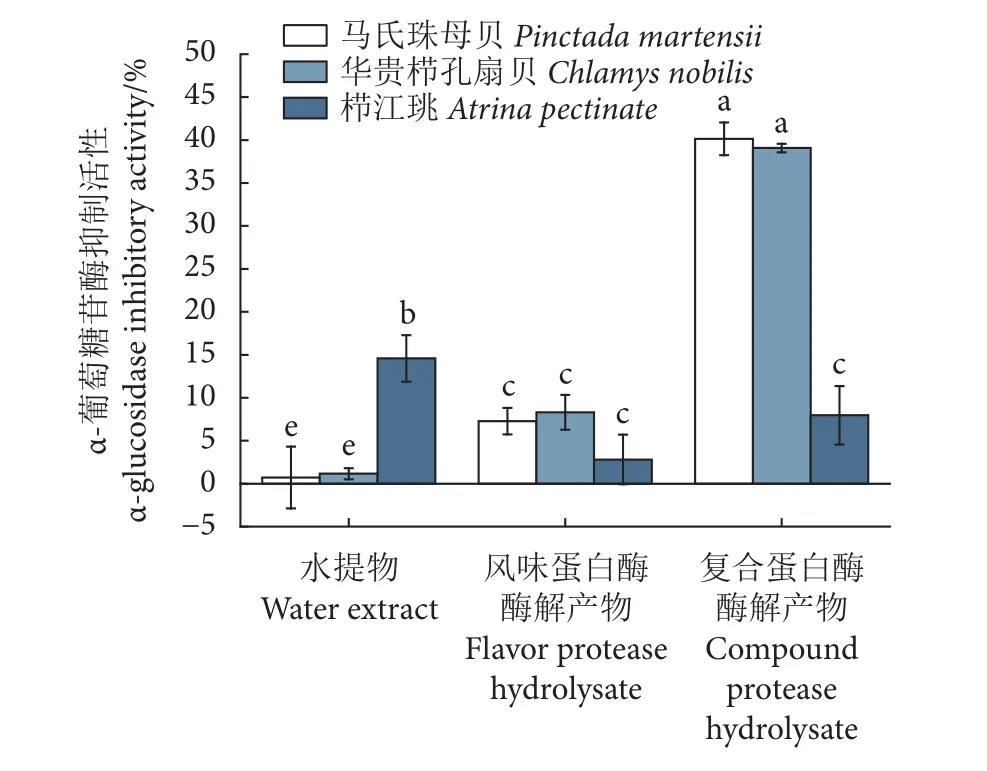
图3 贝类闭壳肌酶解产物对α-葡萄糖苷酶的抑制活性Fig. 3 Inhibition of α-glucosidase activity in hydrolysate of shellfish adductor muscle
综上,复合蛋白酶酶解马氏珠母贝的酶解产物,其短肽浓度和α-葡萄糖苷酶抑制活性均处于较高水平。而马氏珠母贝的闭壳肌作为珍珠产业的副产物,资源利用率低[33],基于资源绿色高值化利用理念,本研究将利用马氏珠母贝闭壳肌作酶解产物,并配合复合蛋白酶进行深入研究。
2.3 马氏珠母贝闭壳肌酶解工艺
考察了酶解时间、pH、温度和酶添加量对酶解产物α-葡萄糖苷酶抑制活性的影响。结果显示,当酶解时间为3 h时酶解产物α-葡萄糖苷酶的抑制活性达到峰值 (图4-a),当酶解时间超过3 h后,随着时间延长,酶解产物的抑制活性相较之前增长变慢,甚至出现下降,可能是由于起主要α-葡萄糖苷酶抑制活性作用的短肽被酶解成更小的物质,从而减弱或者失去了抑制活性。当酶添加量达到5 000 U·g-1时 (图4-b),则无法通过继续提升酶添加量来显著增强酶解产物对α-葡萄糖苷酶的抑制活性。蛋白酶过多时也会抑制水解能力[3]。当酶解温度达到50 ℃时 (图4-c) 抑制活性达到峰值,而温度过高会导致酶解液抑制活性也随之降低[33]。酶解pH为7.0时达到对α-葡萄糖苷酶抑制活性的峰值 (图4-d),而酶解环境过酸或过碱均会影响蛋白酶活性,导致对α-葡萄糖苷酶的抑制活性降低。
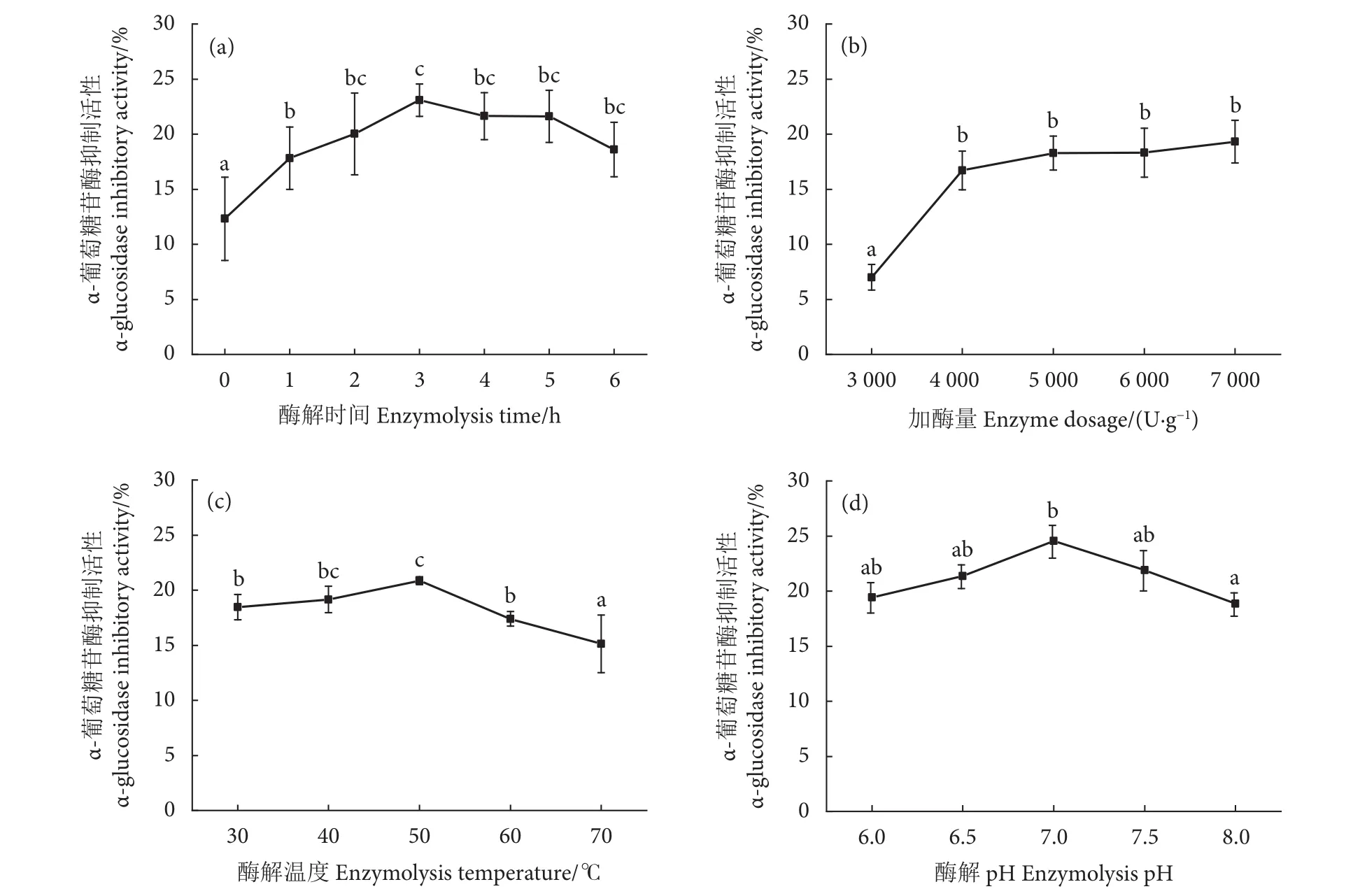
图4 酶解条件对产物α-葡萄糖苷酶抑制活性的影响Fig. 4 Effect of enzymolysis factors on α-glucosidase inhibitory activity
综上,以α-葡萄糖苷酶抑制活性为评价指标,选择较优酶解条件:时间3 h,酶添加量5 000 U·g-1,酶解温度50 ℃,酶解pH=7.0,该条件下制备的马氏珠母贝闭壳肌酶解产物对α-葡萄糖苷酶的抑制活性为24.54%。
2.4 EHPA短肽浓度对α-葡萄糖苷酶的抑制活性
酶解产物随着其短肽浓度的增加,对α-葡萄糖苷酶抑制活性增大,即酶解产物对α-葡萄糖苷酶抑制活性与短肽浓度有一定依赖性 (图5)。可见在EHPA中对α-葡萄糖苷酶抑制活性起主要作用的是短肽类物质。
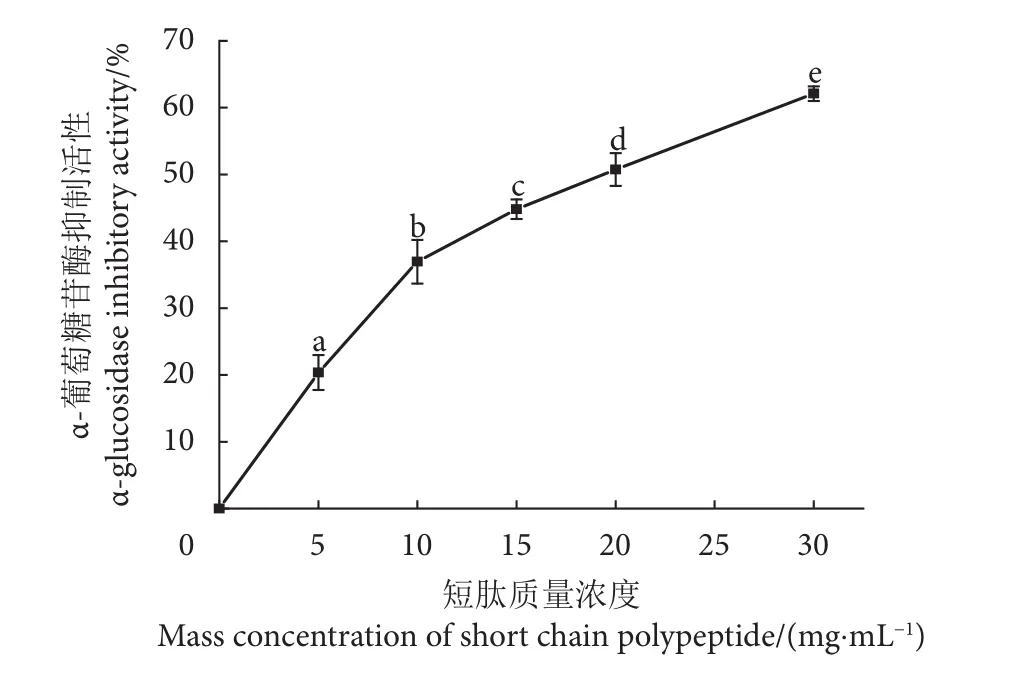
图5 不同短肽质量浓度的酶解产物的α-葡萄糖苷酶抑制活性Fig. 5 α-glucosidase inhibitory activity of enzymatic hydrolysates with different mass concentrations of short chain polypeptide
2.5 EHPA对小鼠血糖的影响
2.5.1 EHPA 对小鼠体质量的影响
EHPA的体外试验已证明其具有α-葡萄糖苷酶抑制活性,通过小鼠试验进一步验证其体内活性,结果见表1。在灌胃给药3 d后,EHPA低、中、高组体质量增长呈递增趋势,但组间无显著性差异(P>0.05),这与胡佳妮等[34]的研究结果一致,后者认为海洋水产蛋白肽会影响小鼠的食品利用率,而导致其体质量增长幅度不同。

表1 马氏珠母贝酶解产物对正常小鼠体质量的影响 (N=10)Table 1 Effect of P. martensii hydrolysate on mass of mouse (N=10)
2.5.2 EHPA 对小鼠空腹血糖的影响
EHPA对小鼠空腹血糖的影响见表2。与空白组相比,PC组和试验组的降糖率均有提高,其中EHPA-H组降糖率最高 (31.76%),试验组之间无显著性差异 (P>0.05)。结果表明,经过EHPA干预后,一定程度上可以降低小鼠空腹血糖浓度。
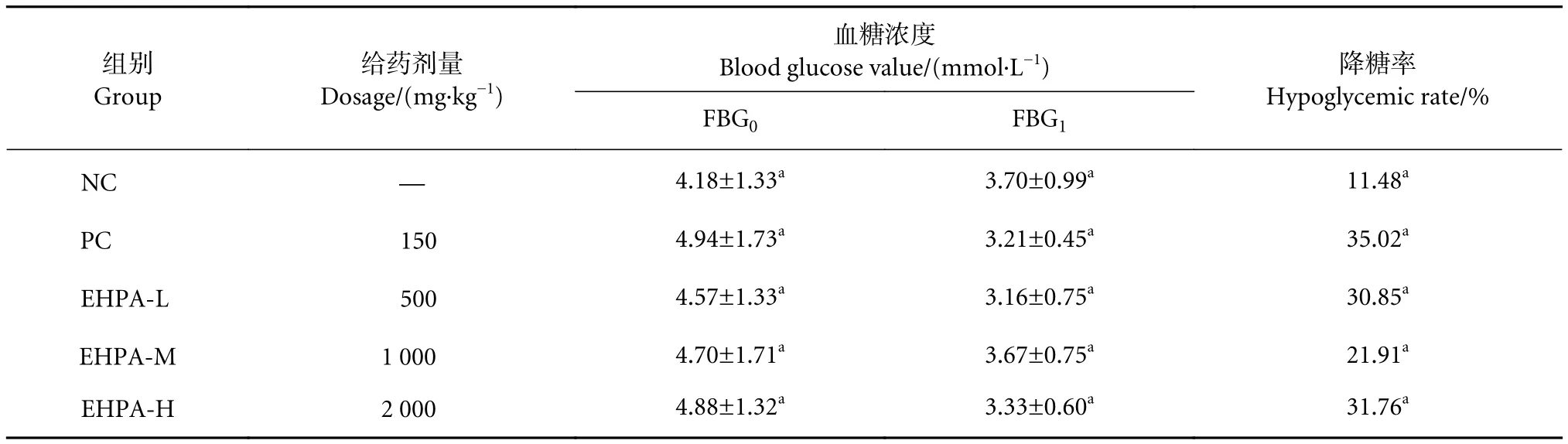
表2 马氏珠母贝酶解产物对小鼠空腹血糖的影响 (N=10)Table 2 Effect of P. martensii hydrolysate on fasting blood glucose of mouse (N=10)
2.5.3 EHPA 对小鼠糖耐量的影响
EHPA对小鼠糖耐量影响试验结果见表3。灌胃0.5及2 h后,与NC组小鼠相比,其他组血糖均显著降低 (P<0.05),其中PC组小鼠血糖降低最显著,其次为EHPA-H组。

表3 马氏珠母贝酶解产物对小鼠糖耐量的影响 (N=10)Table 3 Effect of P. martensii enzymatic hydrolysate on glucose tolerance of mouse (N=10)
与NC组的血糖曲线下面积相比,其他组均显著降低 (P<0.05),其中PC组血糖曲线下面积降低最为显著,对小鼠糖耐量改善明显,其次为EHPA-H组。
综上所述,连续灌胃3 d后会影响正常小鼠的糖耐量,这与王婷婷[35]报道的海洋水产类酶解物对大鼠葡萄糖耐量的影响结果一致。
2.5.4 EHPA 对小鼠血清胰岛素的影响
EHPA对小鼠血清胰岛素影响的试验结果见表4。与NC组的空腹血清胰岛素相比,PC组和试验组稍有提高,但各组间均无显著性差异。胰岛素敏感指数各组间均无显著性差异。与NC组胰岛素分泌指数相比,EHPA-L组有所提高,其余试验组均有一定程度下降,但各组间均无显著性差异 (P>0.05)。结果表明EHPA对正常小鼠胰岛素分泌几乎没有影响。
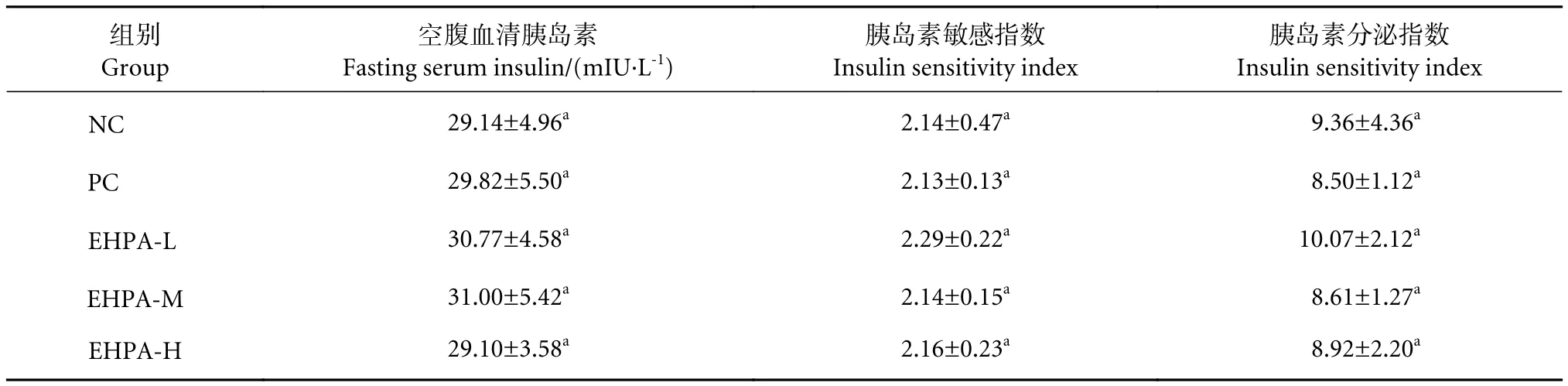
表4 马氏珠母贝酶解产物对小鼠血清胰岛素的影响 (N=10)Table 4 Effect of P. martensii hydrolysate on serum insulin of mouse (N=10)
3 结论
本研究通过比较不同贝类原料、蛋白酶、酶解因素等对酶解产物中游离氨基酸态氮、短肽浓度及α-葡萄糖苷酶抑制活性的影响,筛选出最佳贝类活性肽的制备方法,并通过动物实验评价其辅助降血糖功效。结果显示,3种贝类闭壳肌酶解产物均有α-葡萄糖苷酶抑制活性,其中马氏珠母贝、华贵栉孔扇贝酶解产物效果活性最强,而栉江珧水提物抑制活性较好。采用复合蛋白酶制备马氏珠母贝闭壳肌活性肽 (EHPA) 的条件为酶解时间3 h、酶添加量5 000 U·g-1、酶解温度50 ℃、酶解pH 7.0,该条件下酶解产物对α-葡萄糖苷酶的抑制活性为24.54%,且其抑制活性与其短肽的浓度成正相关,提示EHPA中具有降血糖活性的物质为短肽。有多项研究表明水生生物酶解产物具有降血糖活性,且其主要功效活性与其短肽关系密切[36-39],本研究的动物试验初步表明EHPA能影响糖耐量,具有辅助降血糖活性。不少研究指出动物组织水提物有降血糖活性[40-41],栉江珧的水提多糖具有多方面生物活性[32],其中起到α-葡萄糖苷酶抑制作用的物质值得深入探讨。
