共培养过程中胶红酵母对阿魏蘑产漆酶的影响及其发酵策略优化
2022-10-24王宁宁赵丽婷李由然顾正华石贵阳丁重阳
王宁宁,赵丽婷,李由然,顾正华,石贵阳,丁重阳
(1. 江南大学 生物工程学院 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
漆酶(EC 1.10.3.2)首次从日本漆树(Rhusvenicifera)的汁液中被分离出来,属于铜蓝氧化蛋白酶家族的一员[1-3],在造纸、污水脱毒与净化、染料的降解、纺织工业、食品、药品、生物传感器、生物诊断及个人护理等领域都有大规模应用[4-6]。自然界中生产漆酶的微生物大多为白腐真菌,但白腐真菌生产周期长以及漆酶产量低等因素限制了漆酶的工业化生产和应用。
共培养作为一种环保、高效的生产技术可以显著提高漆酶的产量[7-8]。在共培养过程中,微生物之间复杂的相互作用是影响产量的重要因素之一,由于微生物的生长活力和状态不同,目标产物的产量会受到不同的影响。如:Flores等[9]研究发现分别在P.ostreatus培养30和48 h时添加T.viride进行共培养产漆酶,前者的最高酶活比后者提高了56.58%;李爱华等[10]研究发现,将不同培养时间的R.mucilaginos与S.cerevisiae共培养,最终糖苷酶的酶活也具有显著差异,其中R.mucilaginos培养48 h后进行共培养获得的酶活最高;Rodíguez等[11]将FunaliafloccoseLPSC 232分别预培养3和6 d后与PenicilliumcommuneGHAIE 86进行共培养,结果发现,预培养6 d的共培养实验组漆酶的酶活为预培养3 d共培养实验组的2.73倍。
笔者所在课题组前期研究发现,在胶红酵母与阿魏蘑共培养过程中,胶红酵母所产β-胡萝卜素是共培养过程中促进阿魏蘑产漆酶的关键因子[12-13],并且在一定范围内,共培养的酶活随共培养体系中β-胡萝卜素含量的升高而升高[14];通过进一步研究发现,添加不同预培养时间的胶红酵母与阿魏蘑进行共培养对漆酶的酶活有显著的影响。因此,本文中,笔者通过对胶红酵母的培养工艺进行优化,以期在进行共培养时漆酶产量得到提高,在为共培养产漆酶的发酵工艺优化提供全新思路的同时,也为共培养过程中的微生物相互作用的研究提供一定的参考。
1 材料与方法
1.1 试剂与仪器
牛肉膏、蛋白胨,Oxoid公司;2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),美国BBI公司;其余试剂均购自国药集团化学试剂有限公司。
SPARK型酶标仪,瑞士TECAN公司;BSP-150型生化培养箱,上海博迅实业有限公司;UltiMate 3000型高效液相色谱,赛默飞世尔科技(中国)有限公司。
1.2 培养基和培养方法
1.2.1 培养基
PDA斜面培养基(g/L):土豆200,葡萄糖20,琼脂20;pH自然。用于阿魏蘑菌种保藏与转接。
YPD液体培养基(g/L):蛋白胨20, 酵母膏10, 葡萄糖20;pH自然。用于胶红酵母培养。
阿魏蘑种子培养基(g/L):麸皮粉 10,玉米粉 10,葡萄糖 20,KH2PO43,MgSO4·7H2O 2;pH自然。用于阿魏蘑种子培养。
发酵培养基(g/L):葡萄糖 20,玉米粉 10,麸皮粉 10,K2SO40.174 2;初始pH 9.0。用于阿魏蘑单培养与共培养的液态发酵。
1.2.2 培养方法
阿魏蘑种子培养:取2块0.5 cm2大小的菌块,接种于阿魏蘑种子培养基中,150 r/min、25 ℃培养168 h。
阿魏蘑单培养:向150 mL发酵培养基中接入体积分数3%的阿魏蘑种子液,150 r/min、25 ℃培养168 h。
胶红酵母一级种子培养:用接种环划取单菌落,接种于YPD培养基中,150 r/min、30 ℃培养24 h。
胶红酵母二级种子培养:将一级种子以体积分数1%的接种量接种于YPD液体培养基中,150 r/min、30 ℃培养48 h。
阿魏蘑与胶红酵母共培养:在阿魏蘑单培养48 h后,接入体积分数6%的胶红酵母二级种子液,继续培养120 h。
1.3 实验方法
1.3.1 葡萄糖质量浓度的优化
设置YPD液体培养基的葡萄糖质量浓度分别为10、20、40、60和80 g/L,培养获得的胶红酵母与阿魏蘑共培养,测定各共培养实验组的酶活,确定最优葡萄糖质量浓度。
1.3.2 氮源的优化
以YPD培养基中的含氮量为基准,以相同含氮量的酵母粉、蛋白胨、(NH4)2SO4、玉米浆作为氮源培养胶红酵母,测定各共培养实验组的酶活,确定最优氮源;设定氮源质量浓度为10、20、30、40和50 g/L,培养获得的胶红酵母与阿魏蘑共培养,测定各共培养实验组的酶活,确定最优氮源质量浓度。
1.3.3 装液量的优化
将胶红酵母培养基的装液量分别设置为40、60、80、100和120 mL,测定各实验组共培养产酶的情况,探究胶母培养基的装液量对共培养酶活的影响。
1.3.4 初始pH的优化
在上述实验得到的最优条件下,将培养基的初始pH分别调至6.0、7.0、8.0、9.0和10.0,测定各实验组共培养产酶的情况,确定培养基的初始pH。
1.3.5 培养温度的优化
将胶红酵母培养温度分别设置为20、25、30和35 ℃,测定各实验组共培养的产酶情况,确定胶红酵母最适培养温度。
1.3.6 响应面实验
综合单因素实验的结果,利用Tukey′s多重比较检验(P<0.05)进行方差分析,选择对共培养漆酶生产具有显著性的影响因子,利用Design Expert 10.0进行实验设计,通过响应面实验分析获得最优胶红酵母培养工艺;以初始条件培养的胶红酵母与阿魏蘑共培养作为对照,将最优培养工艺获得的胶红酵母与阿魏蘑共培养,测定漆酶的产量。
1.4 酶活的测定方法
1)将发酵液于10 000 r/min离心10 min获得上清液。
2)取适当体积的上清液于沸水中5 min进行灭活,将上清液和灭活后的酶液稀释适当的倍数。
3)将6 μL适当稀释后的发酵液加入264 μL 0.1 mol/L的醋酸-醋酸钠缓冲溶液(pH 4.5)的体系,置于酶标仪中预热至30 ℃。
4)预热完成后,向上述体系中快速加入30 μL预热至30 ℃的10 mmol/L ABTS溶液准确反应4 min,以灭活后的酶液作为空白对照(A0),测定420 nm处的吸光值(A1)。
漆酶的酶活定义:在上述反应条件和反应体系下,每分钟氧化1 μmol ABTS所需要的酶量定义为1个酶活单位(U)。
酶活按式(1)计算[15]。
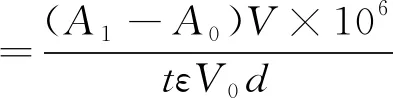
(1)
式中:A1、A0分别为实验组和对照组的吸光值;V为反应体系的总体积(L);V0为发酵液的体积(L);t为反应时间(min);d为光程,此处为1 cm;ε为消光系数(mol-1·cm-1),ABTS的ε420为36 000 mol-1·cm-l。
1.5 β-胡萝卜素的提取和测定方法
1.5.1β-胡萝卜素的提取
1)在10 000 r/min条件下离心5 min发酵后的酵母菌体,并用去离子水洗涤1次,冻干至恒质量。
2)加入与发酵液等体积的3 mol/L盐酸溶液,室温浸泡40 min,沸水浴4 min,冰浴冷却,10 000 r/min、10 min除去盐酸溶液。
3)加入与发酵液相等体积的丙酮溶液,室温萃取30 min,间或振荡摇匀。
4)10 000 r/min离心10 min后收集上清液,于减压旋转蒸发仪上45 ℃、40 r/min条件下将丙酮蒸出,用1 mL的正己烷收集蒸馏烧瓶中的沉淀,在10 000 r/min、5 min条件下收集正己烷溶液。
1.5.2β-胡萝卜素的测定
准确称取10 mg的β-胡萝卜素标品,溶解于正己烷溶液中,并定容至100 mL,制成0.1 mg/mL的标准液,将标准液进行适当稀释。
测定各浓度梯度标准溶液的峰面积,拟合出β-胡萝卜素的标准曲线,用以计算待测样品中β-胡萝卜素的浓度[16]。
采用Waters Acquity UPLC BEH C18柱(2.1 mm×100 mm)分离;Waters Acquity UC检测器检测,波长450 nm;流动相:纯乙腈;柱温45 ℃;流速1.0 mL/min;进样量20 μL[17]。
2 结果与讨论
2.1 胶红酵母培养基葡萄糖质量浓度对共培养酶活的影响
葡萄糖几乎是所有微生物都适用且优先选择的碳源[18],因此以葡萄糖为碳源进行研究。设定胶红酵母培养基中不同的葡萄糖浓度,测定培养获得的胶红酵母与阿魏蘑共培养的酶活,结果如图1所示。
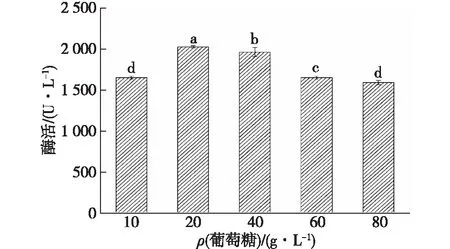
不同字母表示组间显著性差异(P<0.05),下同图1 胶红酵母培养基的葡萄糖质量浓度对共培养漆酶酶活的影响Fig.1 Effects of glucose concentration of R. mucilaginosa medium on co-cultivation laccase activities
由图1可知:随着胶红酵母培养基中葡萄糖质量浓度的升高,所培养后的胶红酵母添加到共培养体系后酶活出现先上升后下降的趋势,以20 g/L葡萄糖培养的胶红酵母添加到共培养体系后酶活最高,显著高于其他浓度所获得的酶活。
不同葡萄糖质量浓度对胶红酵母生长和β-胡萝卜素产量的影响如图2所示。由图2可知:过低浓度的葡萄糖培养胶红酵母时,碳源主要用于生长而无法积累过多的β-胡萝卜素用以促进共培养生产漆酶;过高浓度的葡萄糖培养胶红酵母时,高渗环境下会抑制胶红酵母正常的生长代谢,导致β-胡萝卜素的产量较低,同样不利于共培养产漆酶。这进一步说明葡萄糖对于微生物生长代谢的重要性。因此选定20 g/L葡萄糖进行胶红酵母的培养。
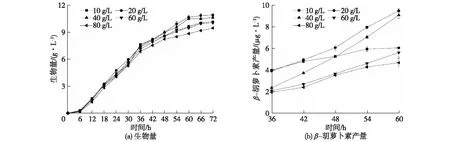
图2 不同葡萄糖浓度对胶红酵母生长和β-胡萝卜素产量的影响Fig.2 Effects of different glucose concentrations on the growth of R. mucilaginosa and β-carotene production
2.2 胶红酵母培养基氮源对共培养酶活的影响
以初始YPD培养基的含氮量作为基准,选取5种常见的氮源(包括复合氮、有机氮和无机氮),研究培养胶红酵母的氮源种类对共培养酶活的影响,结果如图3所示。
由图3可知:以单一的酵母粉作为氮源培养的胶红酵母添加到共培养体系后酶活最高,这可能是由于酵母粉中含有大量胶红酵母生长所需的前体物质,更适于胶红酵母的生长代谢,虽然YPD培养基中也含有酵母粉,但其浓度较低。因此选取酵母粉作为氮源培养胶红酵母。
在确定酵母粉为胶红酵母培养基的最适氮源后,进一步对酵母粉的最适浓度进行探究,结果如图4所示。由图4可知:随着胶红酵母培养基中酵母粉浓度的升高,所培养的胶红酵母添加到共培养体系后酶活出现先上升后下降的趋势,以30 g/L酵母粉培养的胶红酵母添加到共培养体系后酶活最高,显著高于其他浓度所获得的酶活。图5为不同酵母粉质量浓度对胶红酵母生长和β-胡萝卜素产量的影响。由图5可知:过低浓度的酵母粉培养胶红酵母时,营养物质主要应用于生长而无法积累过多的β-胡萝卜素以促进共培养漆酶生产;但随着酵母粉浓度的增高,同样不利于胶红酵母的生长代谢,从而使得共培养的酶活没有达到最高水平。因此选定30 g/L酵母粉进行胶红酵母的培养。
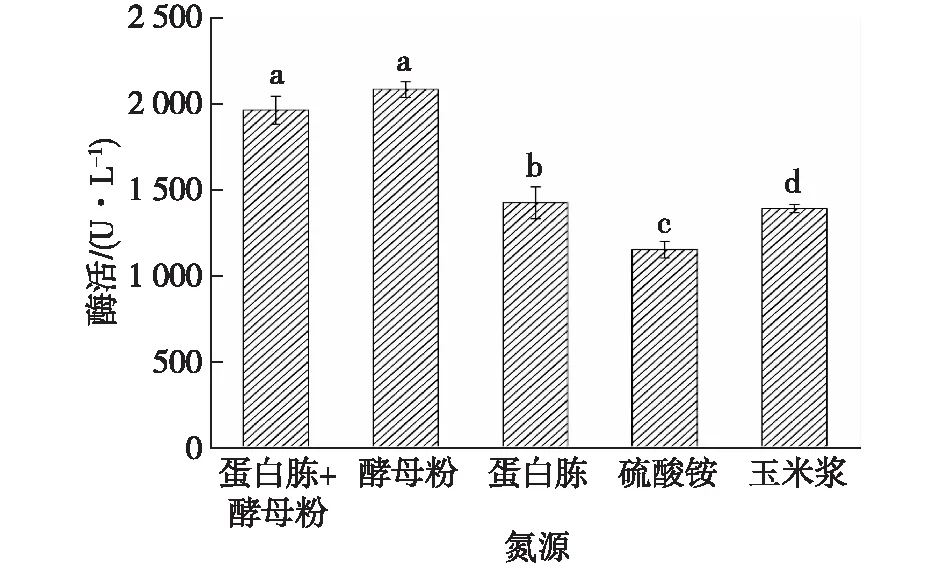
图3 不同氮源培养的胶红酵母对共培养漆酶酶活的影响Fig.3 Effects of R. mucilaginosa cultured with different nitrogen sources on co-culture laccase activity
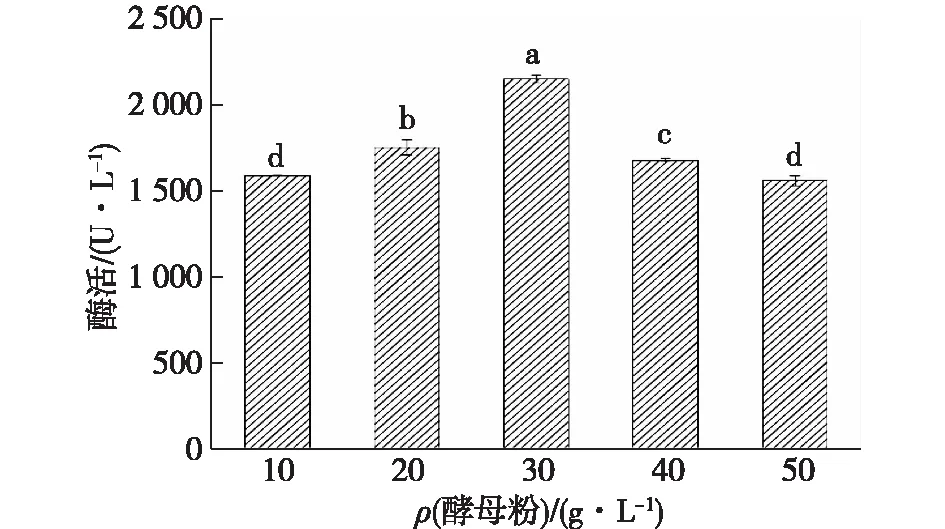
图4 胶红酵母培养基的酵母粉质量浓度对共培养漆酶酶活的影响Fig.4 Effects of yeast extract concentration on R. mucilaginosa medium on co-cultivation laccase activities
综上所述,以20 g/L葡萄糖、30 g/L酵母粉作为胶红酵母的培养基,将培养48 h的胶红酵母与阿魏蘑共培养获得的漆酶的酶活较对照组提高了9.5%。
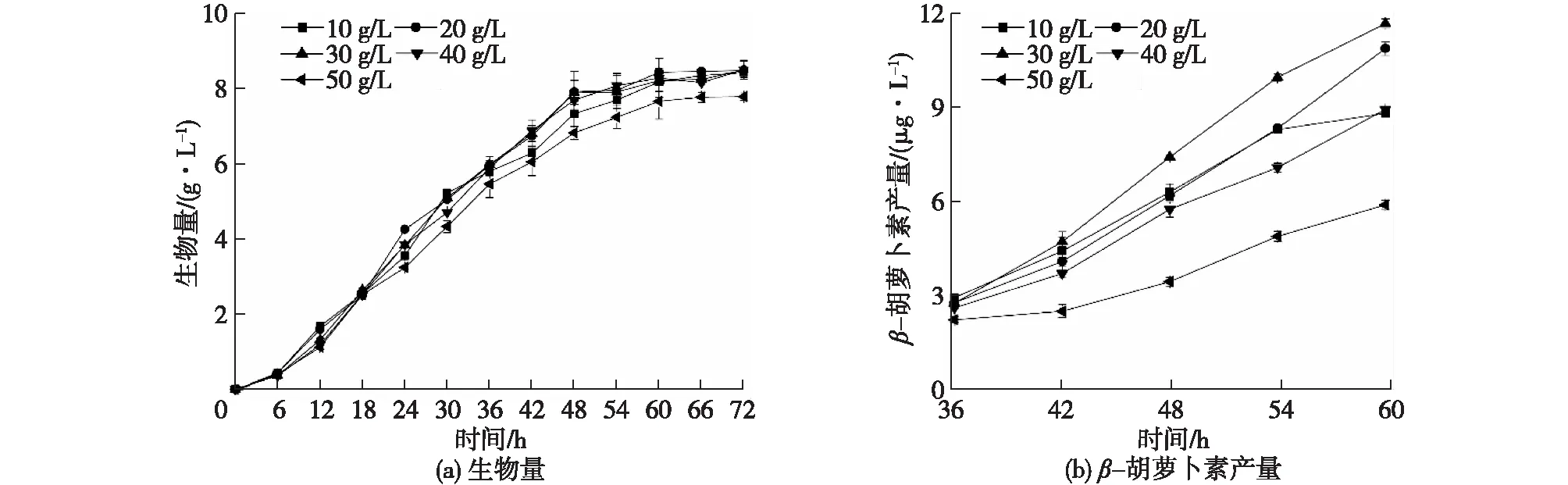
图5 不同酵母粉质量浓度对胶红酵母生长和β-胡萝卜素产量的影响Fig.5 Effects of different yeast extract concentrations on the growth of R. mucilaginosa and β-carotene production
2.3 胶红酵母培养基的装液量对胶红酵母和共培养酶活的影响
O2对微生物的生长与产物的代谢至关重要[19],装液量会直接影响发酵液的溶氧。因此以不同装液量培养的胶红酵母与阿魏蘑共培养,探究胶红酵母培养基的装液量对共培养酶活的影响,结果如图6所示。
由图6可知:随着胶红酵母培养基装液量的升高,所培养的胶红酵母添加到共培养体系后酶活也出现先上升后下降的趋势,以80 mL装液量培养的胶红酵母添加到共培养体系后酶活最高,高于其他浓度所获得的酶活。
图7为不同装液量对胶红酵母生长和β-胡萝卜素产量的影响。由图7可知:当装液量为40 mL时,溶氧充足,胶红酵母快速生长,获得较高的生物量,但较低的营养物质总量仅够维持微生物的生长而无法进一步实现β-胡萝卜素的大量积累,因而β-胡萝卜素的产量较低,从而使得与阿魏蘑进行共培养产漆酶时总酶活并不高。Han等[20]研究锁掷酵母SporidioboluspararoseusJD-2产β-胡萝卜素时发现,低溶解氧更有利于β-胡萝卜素的积累,因而当装液量为100 mL甚至更高时,β-胡萝卜素的产量比装液量为40 mL时更高,但由于溶解氧浓度不足导致微生物生长缓慢,从而导致与阿魏蘑共培养的酶活也不高。因此选定装液量为80 mL。
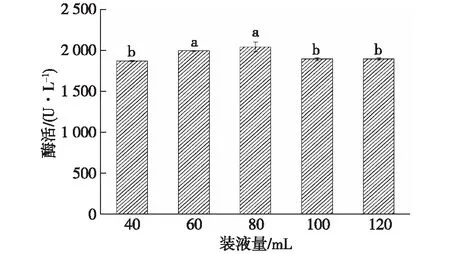
图6 胶红酵母培养基的装液量对共培养漆酶酶活的影响Fig.6 Effects of R. mucilaginosa medium volume on the co-culture laccase activity
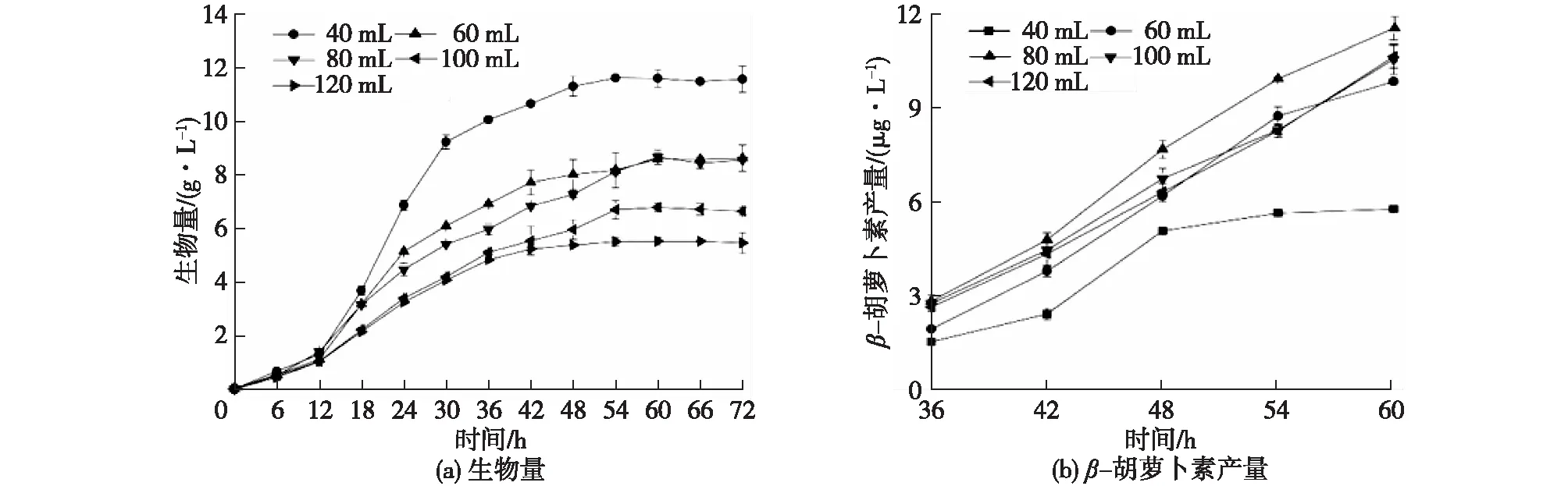
图7 不同装液量对胶红酵母生长和β-胡萝卜素产量的影响Fig.7 Effects of different medium volume on the growth of R. mucilaginosa and β-carotene production
2.4 胶红酵母培养基初始pH对共培养酶活的影响
培养环境的pH同样影响着微生物的生长与代谢[21],通过设定胶红酵母培养基的不同初始pH探究其对共培养酶活的影响,结果如图8所示。由图8可知:在一定范围内,共培养的酶活随胶红酵母培养基初始pH的升高而升高,在初始pH为9.0的条件下培养获得的胶红酵母更有利于共培养产漆酶。
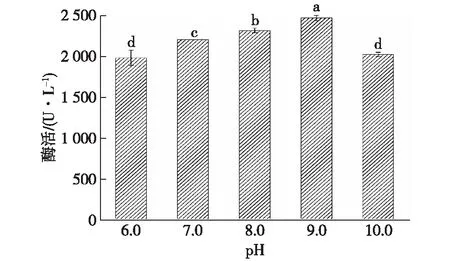
图8 不同初始pH培养的胶红酵母对共培养漆酶酶活的影响Fig.8 Effects of R. mucilaginosa cultured at different initial pH on co-culture laccase activity
图9为不同初始pH对胶红酵母生长和β-胡萝卜素产量的影响。由图9可知:以9.0的初始pH将胶红酵母培养48 h时,胶红酵母的β-胡萝卜素产量最高,从而与阿魏蘑共培养后共培养酶活也最高;而当初始pH达到10.0时,由于碱性较强的环境对胶红酵母的生长代谢产生消极的影响,导致共培养的酶活有所降低。因此,选择胶红酵母培养基的初始pH为9.0。

图9 不同初始pH对胶红酵母生长和β-胡萝卜素产量的影响Fig.9 Effects of different initial pH on the growth of R. mucilaginosa and β-carotene production
2.5 胶红酵母培养温度对共培养酶活的影响
培养环境的温度会影响微生物的生长和产物的代谢[22],通过设定胶红酵母的不同培养温度,探究其对共培养酶活的影响,结果如图10所示。
由图10可知:以25 ℃培养的胶红酵母添加到共培养体系后酶活最高。一般来说,红酵母的培养温度大多为25~30 ℃[23-27]。
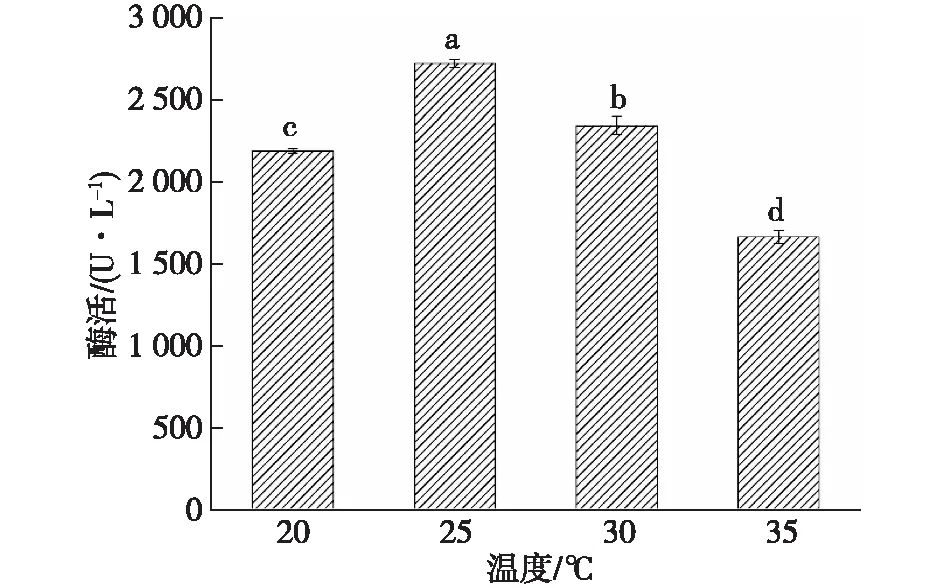
图10 不同温度培养的胶红酵母对共培养漆酶酶活的影响Fig.10 Effects of R. mucilaginosa cultured temperatures on co-culture laccase activity
图11为不同温度对胶红酵母生长和β-胡萝卜素产量的影响。由图11可知:当温度为20 ℃时,温度相对较低,胶红酵母的生长代谢相对缓慢,从而导致共培养的酶活有所降低;当温度为30 ℃时,温度相对较高,不利于β-胡萝卜素的生产,导致共培养的酶活有所降低;当培养温度为35 ℃时,较高的温度对胶红酵母的生长代谢已经产生了抑制作用,共培养的酶活也较低。史馨怡等[28]研究红酵母Rhodotorulasp.产类胡萝卜素时也发现,在一定范围内相对较低的温度会促进类胡萝卜素的生产。因此选定25 ℃为胶红酵母的培养温度。
综上所述,通过单因素实验得到胶红酵母的最适培养条件为葡萄糖20 g/L、酵母粉30 g/L、初始pH 9.0、装液量80 mL、培养温度25 ℃。将上述条件下培养48 h的胶红酵母与阿魏蘑进行共培养,总酶活比对照组提高了34.13%。
2.6 响应面实验
对单因素实验中的各因素进行方差分析(ANOVA),结果见表1。由表1可知:除装液量这一因素外,其余因素的P值均小于0.05,说明这些因素在大于95%的概率水平下是显著的。
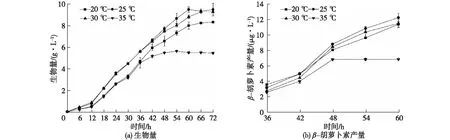
图11 不同温度对胶红酵母生长和β-胡萝卜素产量的影响Fig.11 Effects of different temperature on the growth of R. mucilaginosa and β-carotene production
根据方差分析的结果,对葡萄糖质量浓度(A)、酵母粉质量浓度(B)、初始pH(C)、培养温度(D)这4个因素利用响应面实验进行进一步优化,以期获得最优产酶条件共培养漆酶酶活(LAC)。利用Design Expert 10.0进行实验水平的设计结果见表2,实验结果见表3。
根据实验数据,利用软件Design Expert 10.0经过回归拟合所得的二次多项式为
LAC=2486.05-89.68A+156.56B+331.7C+247.28D-272.93AB+142.9AC-297.7AD+95.99BC+234.22BD+13.3CD-614.14A2-224.78B2-179.29C2-29.99D2。
通过对模型的方差分析(表4)可知,模型的P值小于0.01,表明模型二次方程极显著,失拟项不显著(P=0.176 8),一次项C、D极显著,B显著;二次项A2极显著,AB、AD、BC、BD、B2、C2显著,回归方程决定系数R2为0.952 9,说明该回归方程能较好地描述各因素与响应值之间的真实关系,可以用其确定胶红酵母最佳培养工艺[29]。
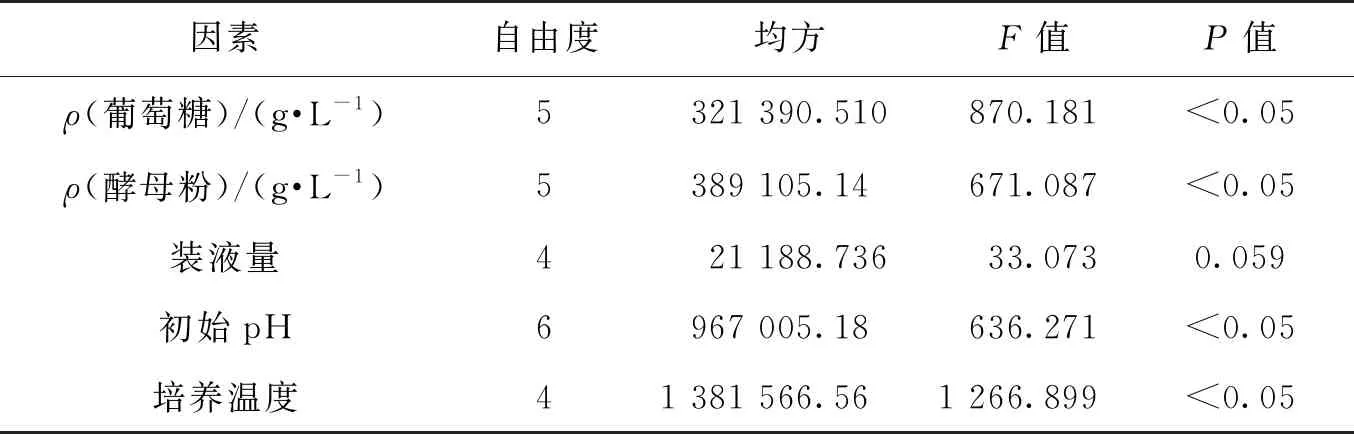
表1 单因素实验方差分析
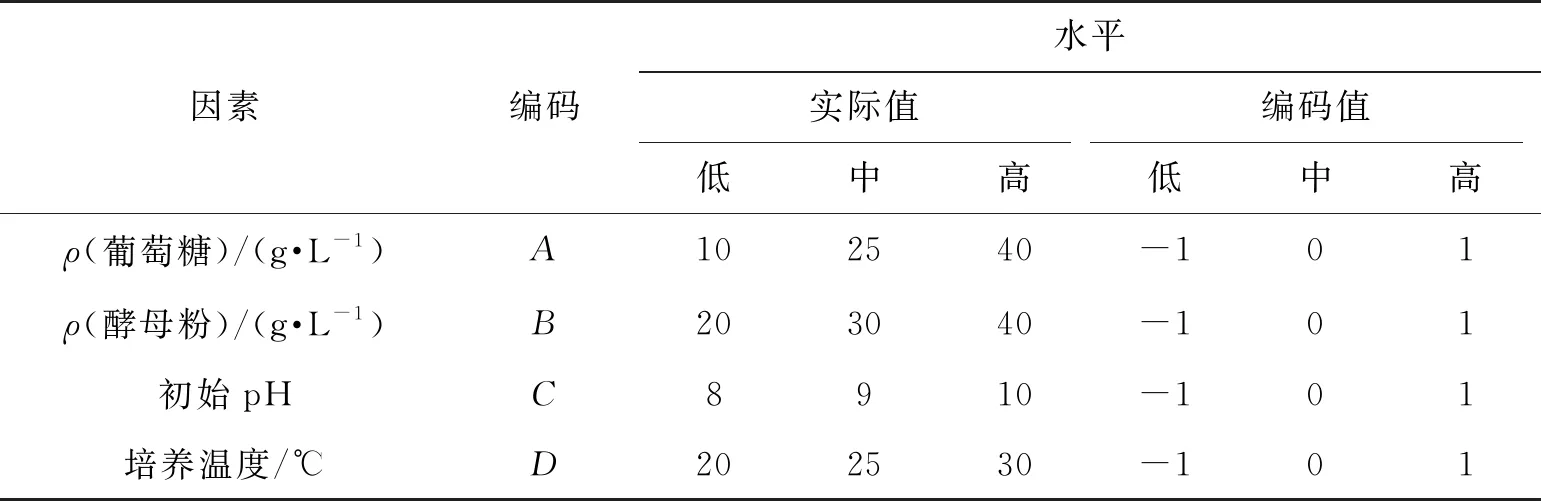
表2 响应面实验水平的编码
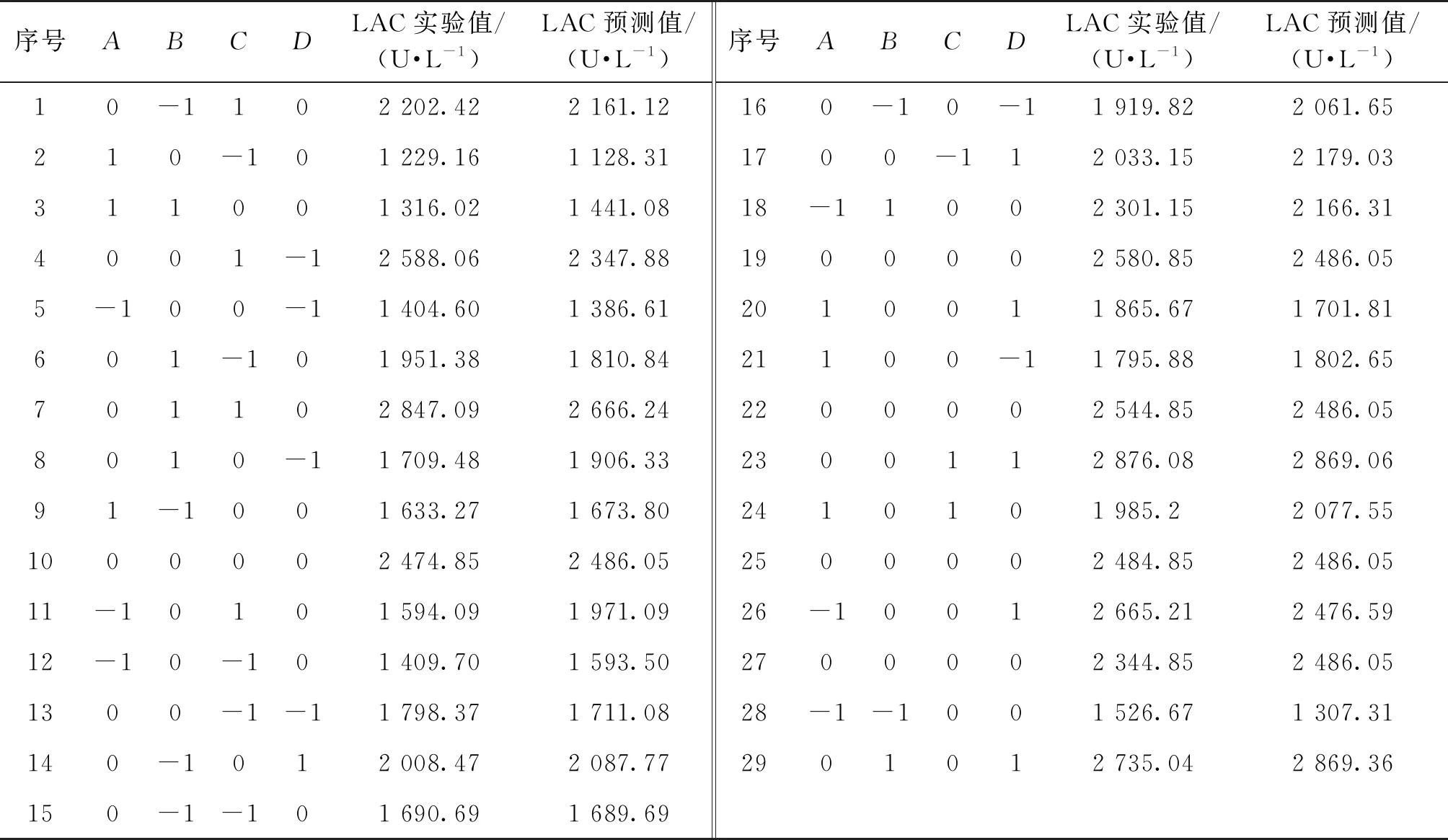
表3 响应面实验设计与实验结果
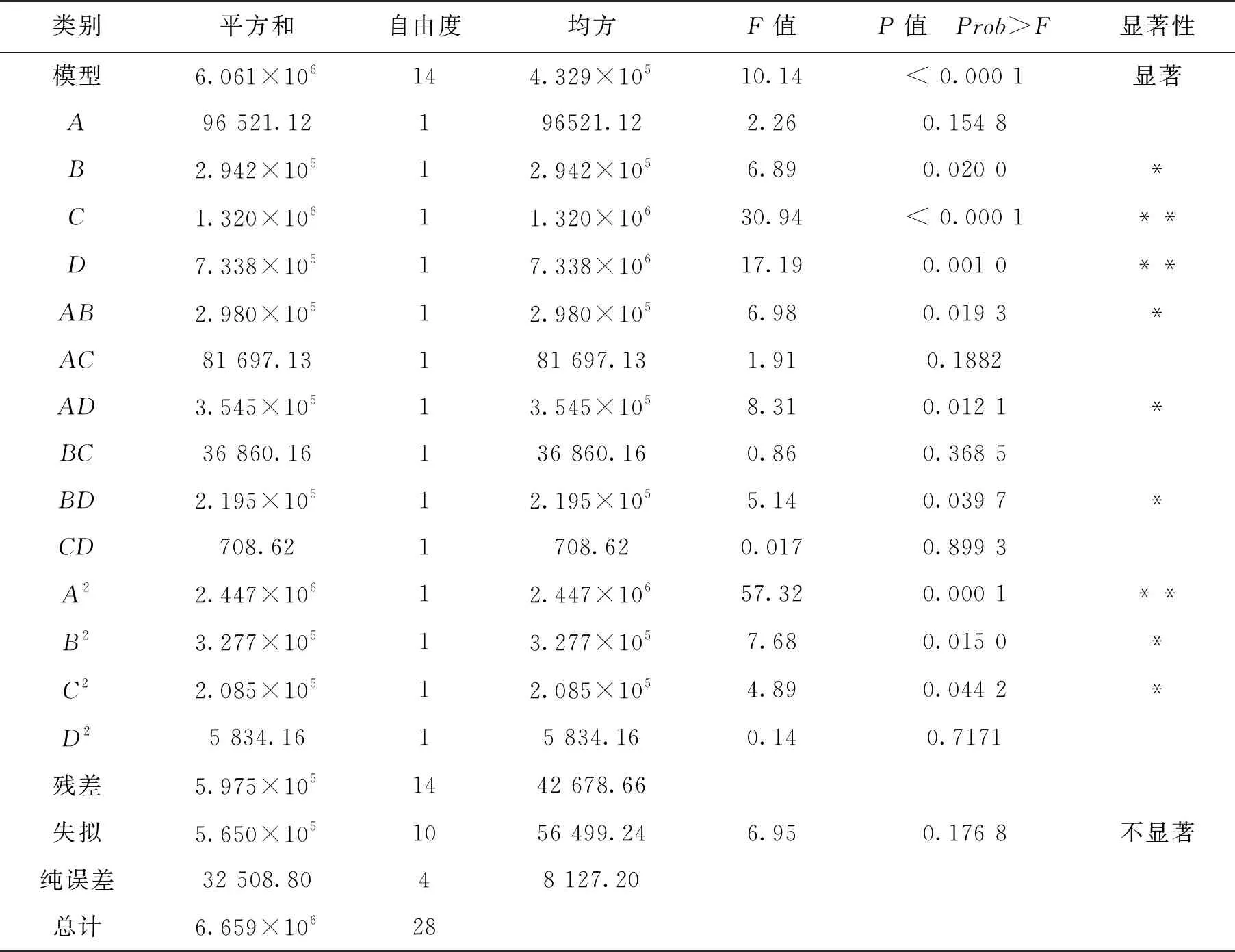
表4 响应面方差分析表
图12~14为不同因素的交互影响响应面图。当初始pH和温度位于最佳值9.8和28.5 ℃时,葡萄糖质量浓度和酵母粉质量浓度对共培养漆酶产量的交互影响效应显著(图12)。当酵母粉质量浓度和初始pH分别为38.5 g/L和9.8时,葡萄糖质量浓度和培养温度对共培养酶活的交互作用显著(图13),葡萄糖质量浓度在较低水平时,共培养酶活在一定培养温度范围内随着温培养度的升高而升高,说明温度对胶红酵母的β-胡萝卜素的产量影响较大。酵母粉质量浓度和培养温度的交互影响作用见图14,当酵母粉质量浓度和培养温度分别为38.5 g/L和28.5 ℃时,共培养酶活最高。
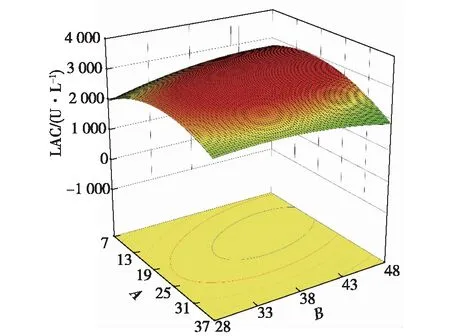
图12 葡萄糖质量浓度与酵母粉质量浓度交互影响的响应面图Fig.12 Response surface diagram of the interaction between glucose concentration and yeast extract concentration
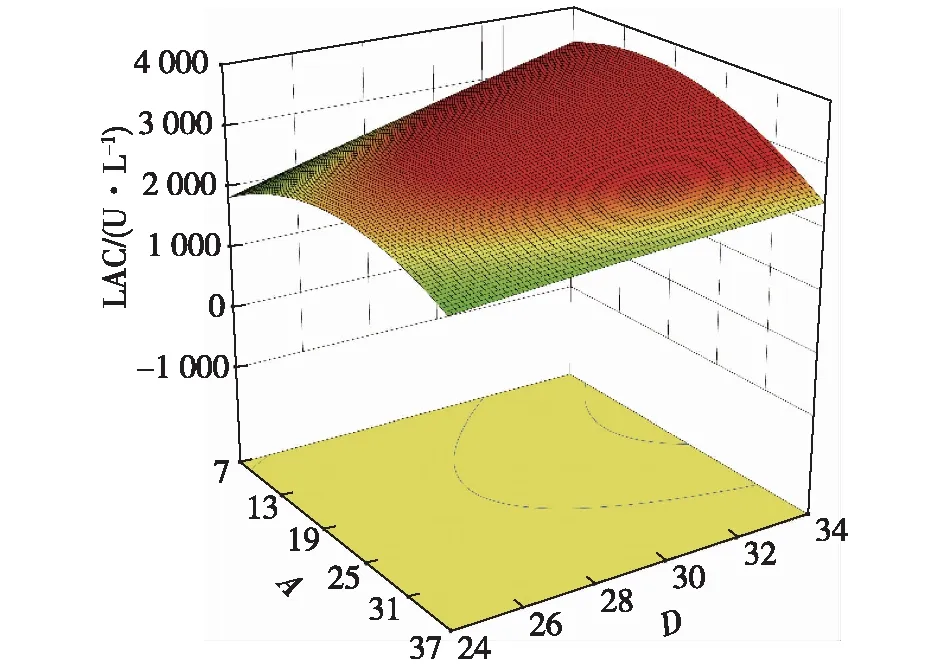
图13 葡萄糖质量浓度与温度交互影响的响应面图Fig.13 Response surface diagram of the interaction between glucose concentration and temperature
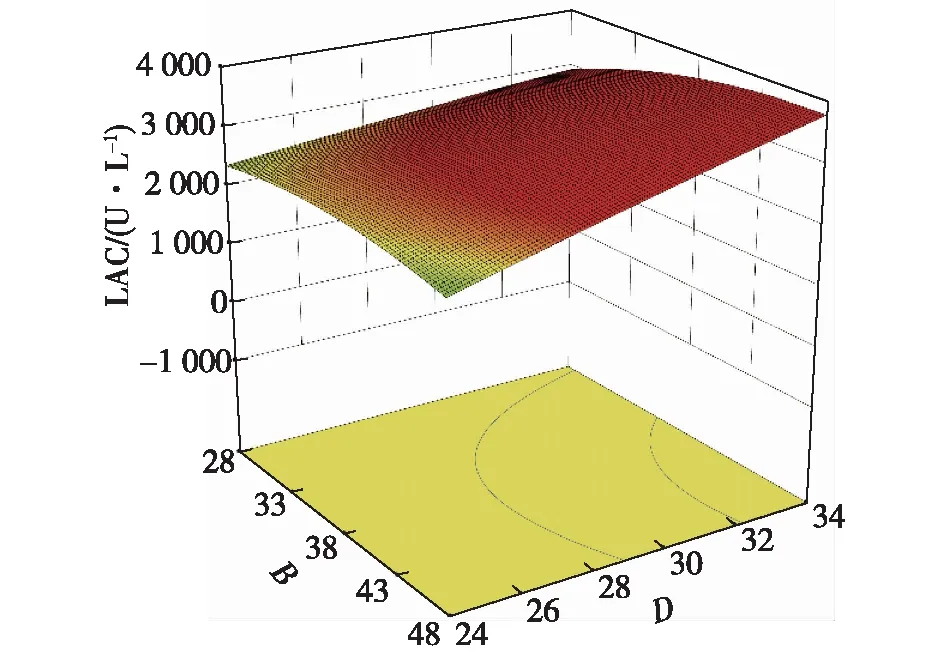
图14 温度与酵母粉质量浓度交互影响的响应面图Fig.14 Response surface diagram of the interaction between temperature and yeast extract concentration
对回归方程进行求导,结合图12、13和14求得该模型的因变量LAC最大时对应的葡萄糖质量浓度、酵母粉质量浓度、初始pH、培养温度分别为18.82 g/L、38.5 g/L、9.8、28.5 ℃,最大响应值(理论共培养漆酶酶活)为3 073.01 U/L。考虑到实际的实验操作,以20 g/L的葡萄糖、38 g/L的酵母粉、初始pH 10.0、装液量80 mL、28 ℃的条件培养48 h后,胶红酵母与阿魏蘑共培养进行实验验证,共进行4次实验,验证实验的平均值为2 983.64 U/L,理论值与实际值的相对偏差为2.99%,说明采用响应面法优化共培养漆酶的产量是可行的,具有实际应用价值[30]。通过对胶红酵母培养工艺的优化使得最高共培养酶活比对照组(以初始工艺培养的胶红酵母与阿魏蘑共培养)提高了50.19%,且将发酵周期缩短了24 h,实现了漆酶产量的提高和生产成本的降低。
3 结论与展望
漆酶在环境保护、造纸、纺织工业、食品、药品等诸多领域都有大规模应用,本文以胶红酵母培养条件为研究对象,得到最适于共培养的胶红酵母培养条件,以20 g/L的葡萄糖、38 g/L的酵母粉、初始pH 10.0、装液量80 mL、28 ℃的条件培养48 h后与阿魏蘑进行共培养,最高共培养酶活比对照组提高了50.19%,且将发酵周期缩短了24 h,在提高漆酶产量的同时降低了生产成本。本研究不仅为共培养产漆酶工艺优化提供新的研究方向,还为其他共培养体系提供了新的参考策略。后续还可以将最优工艺下培养的胶红酵母与其他产漆酶的真菌菌株共培养,扩大应用范围。
