内生真菌对盐胁迫下紫花针茅种子萌发和幼苗生长的研究
2022-10-24张鹏任茜孟思宇魏小星鲍根生
张鹏,任茜,孟思宇,魏小星,鲍根生
(青海省青藏高原优质牧草种质资源利用重点实验室,青海大学畜牧兽医科学院,青海西宁 810016)
土壤盐渍化通过干扰植物光合作用,抑制植物呼吸作用,降低蛋白质含量、水分亏缺、膜损伤等途径来抑制植物生长,甚至造成植物死亡,已成为一个亟须解决的全球性问题[1-2]。截至目前,全球共计有8.31×108hm2土地受到盐渍化威胁[3];其中,我国盐渍土壤总面积约为3.6×107hm2,约占全国可用土地面积的4.88%[4],且大多分布在甘肃、新疆、青海等西北干旱地区。青海省盐渍化土地面积约2.92×106hm2,主要分布于柴达木盆地、共和盆地和东部农业区[5],成为制约青藏高原地区生态修复和绿色生态农牧业发展的瓶颈问题之一。盐渍化土壤改良措施主要有水利改良措施、工程措施与农业措施相结合、施用土壤改良剂、生物改良等[6],采用水利改良措施、工程措施与农业措施相结合体现出费工费时费力,具有明显的局限性;施用土壤改良剂虽治理效果明显,但化学药剂残留易引起土壤污染。近年来,利用耐盐植物对盐渍化土壤进行生态恢复成为盐碱化土壤治理行之有效的方法。同时,许多研究发现除耐盐植物自身耐盐特性外,微生物与耐盐植物共生能显著提高宿主对盐碱胁迫的耐受能力。例如:盐胁迫条件下菌根真菌可通过改善寄主植物营养水平、提高植物组织中的K+/Na+以及通过积累如脯氨酸、甘氨酸、甜菜碱和可溶性糖等途径[7],提高宿主植物的耐盐性。同时,研究发现烟草(Nicotiana tabacum)、苜蓿(Medicago sativa)、墨西哥鼠尾草(Salvia leucantha)等植物接种印度梨形孢(Piriformospora indica)能增强其耐盐能力[8-10]。另外,徐亚军等[11]研究表明,与对照相比,接种死谷芽孢杆菌(Bacillus vallismortis)的小麦(Triticum aestivum)幼苗耐盐能力显著增加。由此可见,共生微生物在提高植物耐盐能力方面发挥重要作用。
禾草内生真菌(Epichloë)是指存在于植株地上部分,在植物体内完成绝大部分生活周期,但不导致宿主产生外部病害症状的一类真菌[12]。经过长期适应性进化,内生真菌与冷季型禾草形成互惠互利的共生体,禾草为内生真菌提供生长场所、繁殖载体(种子)及生长所需营养物质[13];作为回报,内生真菌通过产生次生代谢物(生物碱)和调控禾草生理生化及代谢途径增强禾草抗虫[14]、抗病[15]、抗旱[16]、耐寒[17]及耐盐碱[18]等生物或非生物逆境的耐受能力。近期研究发现:禾草内生真菌通过促进植物营养元素吸收、保持离子平衡[19],提高植物渗透调节能力[20]、增强禾草光合作用和水分利用效率[21]、分泌次生代谢物[22]、诱导相关耐盐基因表达[23]等途径提高禾草对盐胁迫的耐受能力。盐胁迫作为植物生长发育阶段所面临的最普遍的非生物逆境之一,有关内生真菌如何提高禾草苗期及生长期盐胁迫耐受能力的作用机理已基本明晰[24]。种子萌发和幼苗定植是植物生命周期中最重要且对外部环境最敏感的时期[25],这一阶段经历盐胁迫会对植物幼苗生长和定植产生致命伤害。内生真菌在禾草种子萌发阶段能侵染芽原基、叶原基等组织,从而影响非生物胁迫逆境下禾草种子萌发进程[26]。然而,有关内生真菌影响盐胁迫逆境下禾草种子萌发研究较少,仅聚焦于氯化钠、硫酸钠等单盐对带菌和不带菌禾草种子萌发影响,而有关多种单盐及复合盐对带菌和不带菌禾草种子萌发影响的研究鲜有报道。
紫花针茅(Stipa purpurea)是青海湖流域高寒草原最重要的多年生禾草[27],其茎叶柔软,适口性好,耐牧性强。据调查,青海湖流域土壤盐渍化现象比较严重,次生盐渍化现象也在不断加剧[28]。调查研究结果表明,青海高原紫花针茅的内生真菌侵染率为70%~100%[29],基于此,本研究以青海湖流域紫花针茅带菌(E+)和不带菌(E-)种子为研究对象,主要解决以下问题:1)随着盐浓度增加紫花针茅种子萌发和幼苗生长是否受到抑制?2)单盐或复合盐对紫花针茅种子萌发和幼苗生长的抑制作用是否存在差异?3)内生真菌能否提高盐胁迫逆境下紫花针茅种子发芽和幼苗生长?旨在尝试利用内生真菌-紫花针茅共生体开展高寒区盐碱草地生态修复和改良方面的研究,为利用共生微生物实现耐盐碱种质资源创新利用奠定理论基础。
1 材料与方法
1.1 试验材料
紫花针茅种子采集:2019年10月,在青海省海北州海晏县甘子河镇天然草地(37°07′09″N,100°38′42″E),采收紫花针茅成熟种子。采收地海拔3370 m,属典型高寒草原,草地建群种为紫花针茅,伴生种为冰草(Agropyron cristatum)和草地早熟禾(Poa pratensis)。为保证采集样品能真实反映样地紫花针茅种群分布特征和个体水平多样性,采收400株紫花针茅整株(地上部分),每株间隔25 m左右。采集样品置于4 °C冰箱内,以备后用。
内生真菌分离鉴定:根据李春杰等[30]禾草内生真菌检测方法,检测紫花针茅带菌率,发现紫花针茅内生真菌带菌率高达90%以上。同时,挑选20粒带菌紫花针茅种子进行种皮消毒,然后摆放在马铃薯(Solanum tuberosum)葡萄糖琼脂培养基上,室温黑暗条件下培养28 d,种子表面出现内生真菌菌丝后进行纯培养。参照鲍根生等[31]紫花针茅内生真菌鉴定方法,利用tub、tef和actin特异性引物扩增内生真菌序列并构建系统发育树,将采集地紫花针茅感染的内生真菌鉴定为Epichloëinebrians。
E-种子获取:部分E+种子用有效成分10%的甲基托布津浸泡6 h[32],对照组采用蒸馏水浸泡E+种子6 h。将E+、E-种子(甲基托布津浸泡处理)播种于装有灭菌细沙和土壤的250 mL花盆内,细沙与土壤比例为2:1。2020年5月,将E+和E-紫花针茅幼苗移栽至青海省海北藏族自治州西海镇多年生牧草试验站(36°49′29″N,101°45′26″E)。9月中旬,紫花针茅种子成熟期按单株收获方法分别采收E+和E-种子,随机挑选10株紫花针茅E+、E-种子50粒进行内生真菌侵染率检测。具体方法为:1%次氯酸钠浸泡种子过夜,种皮软化后用苯胺蓝染液染色,20×光学显微镜下检查种皮、糊粉层内是否出现蓝色光滑菌丝。检测结果表明紫花针茅E+、E-种子带菌率分别为100%、4%。
1.2 试验方法
1.2.1盐胁迫处理 选取籽粒饱满、无病虫害的紫花针茅E+、E-种子各5000粒,供试种子先用70%乙醇消毒1 min,然后用1%次氯酸钠消毒5 min,最后用蒸馏水冲洗数次后晾干。2021年6月,采用不同浓度的NaCl、Na2SO4、Na2CO3、NaHCO3单盐溶液及NaCl/Na2CO3混合盐溶液(NaCl和Na2CO3的比例按1:1进行配制)对紫花针茅E+、E-种子进行盐胁迫处理;由于青海湖流域土壤以重碳酸盐类钙型(HCO3-Ca)分布最为广泛[33],柴达木盆地盐碱化土壤主要以HCO3-、Cl-为主[34],且CO32-在溶液中会水解为HCO3-,因此选用NaCl/Na2CO3混合盐溶液。依据王正凤[35]在盐胁迫条件下E+、E-野大麦(Hordeum brevisubulatum)种子萌发特性研究结果,本研究单盐和复合盐设定低盐(100 mmol·L-1)和高盐(400 mmol·L-1)2个水平,添加同体积蒸馏水处理为对照。50粒消毒处理的紫花针茅E+或E-种子摆放于直径9 cm、铺有两层滤纸的培养皿内。同时,分别向每皿内添加不同类型盐溶液或蒸馏水3 mL,并记录每皿初始重量。每隔48 h,更换滤纸并补足盐溶液或蒸馏水至初始重量。依据试验设计:带菌状态(E+、E-)、3个盐浓度(0,100,400 mmol·L-1)、5种盐溶液(4种单盐和1种复盐)和各处理5个重复,共计150皿。将供试培养皿置于25 °C的培养箱(RTOP,杭州拓普仪器有限公司)内进行培养,光照和黑暗交替时间分别为8和16 h,每隔4 h观察并记录每皿种子发芽数量,胚根突破种皮2 mm视为发芽种子。连续观察直至3 d内未出现发芽种子视为发芽结束,统计种子发芽率。同时,每皿随机挑选10株幼苗测量幼苗高度和胚根长度。
1.2.2测定指标 发芽率(germination rate,GR,%)=(n/N)×100(n为发芽结束后发芽种子数量,N为供试种子数)[36];
发芽指数(germination index,GI)=∑(Gt/Dt)(Gt为第t天的发芽数,Dt为相应的发芽天数)[37];
发芽势(germination power,GP)=种子发芽达高峰时的发芽数/供试种子数[37];
相对盐害率(relative salt damage rate,RSD,%)=(对照发芽率-处理发芽率)/对照发芽率×100[38]。
1.3 数据分析
采用一般线性模型分析内生真菌、盐浓度和盐类型对紫花针茅种子萌发(发芽率、发芽指数、发芽势)和幼苗生长特性(幼苗高度和胚根长度)及相对盐害率的影响;其中,盐浓度、盐类型、带菌状态为固定因子,种子萌发和幼苗生长特性及相对盐害率为响应变量,综合分析盐浓度、盐类型及带菌状态对响应变量的影响,检测固定因子是否对响应变量存在交互作用。若盐浓度、盐类型、带菌状态对种子萌发和幼苗生长特性及相对盐害率存在显著影响,采用单因素方差分析盐浓度对种子萌发和幼苗生长特性及相对盐害率的影响;同时,采用独立样本T检验检测相同盐类型、同一浓度下E+、E-紫花针茅种子发芽、幼苗生长和相对盐害率之间的差异。为满足方差齐性要求,发芽率、发芽势和发芽指数数据采用对数转化,幼苗高度和胚根长度采用反正弦转化。所有数据均用平均值±标准差表示,采用SPSS 19.0进行数据分析。
2 结果与分析
2.1 内生真菌对盐胁迫紫花针茅种子萌发特性的影响
带菌状态、盐类型和盐浓度对紫花针茅种子萌发特性存在极显著影响(P<0.01,表1);其中,带菌状态与盐浓度、带菌状态与盐类型对发芽指数存在显著交互作用,带菌状态、盐浓度和盐类型对种子发芽率和发芽指数存在显著三者交互作用(P<0.05,表1)。随盐浓度增加,紫花针茅种子发芽率、发芽势和发芽指数快速降低,400 mmol·L-1盐浓度下,发芽率、发芽势、发芽指数最低(图1~3)。内生真菌侵染显著影响紫花针茅在不同盐浓度下种子发芽率,低盐或高盐浓度下,E+种子发芽率显著高于E-种子;而无盐条件下,E+、E-种子发芽率、发芽势和发芽指数差异不显著(图1~3)。不同盐类型对紫花针茅种子萌发抑制作用存在显著差异(表1);其中,NaCl对种子萌发抑制作用最弱(图1a、2a、3a),Na2SO4对种子萌发抑制作用最强(图1b、2b、3b)。
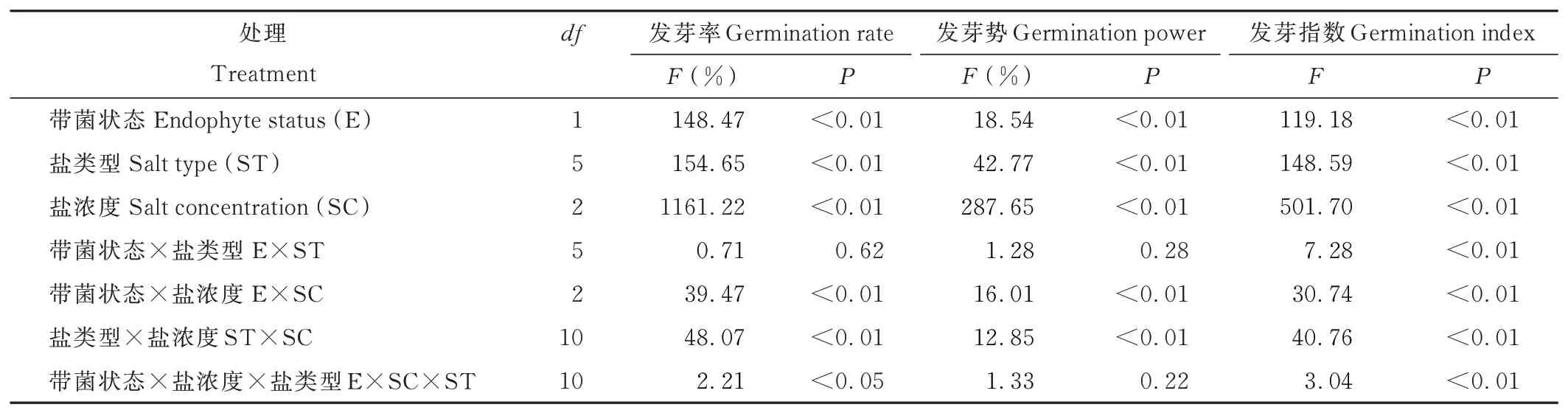
表1 内生真菌侵染、盐类型和盐浓度对紫花针茅种子发芽率、发芽势、发芽指数影响的三因素方差分析Table 1 Results of three-way ANOVA for endophyte infection status(E),salt type(ST)and salt concentration(SC)on seed germination rate,germination power,germination index of S.purpurea
2.2 内生真菌对盐胁迫紫花针茅幼苗生长特性的影响
与紫花针茅种子萌发特性结果相似,盐类型、内生真菌侵染状态、盐浓度对紫花针茅幼苗高度和胚根长度存在极显著影响(表2,P<0.01)。其中,带菌状态与盐浓度、盐类型与盐浓度对幼苗高度和胚根长度存在显著交互作用,同时,带菌状态、盐浓度和盐类型对胚根长度存在极显著三者交互作用(表2,P<0.01)。随盐浓度增加,紫花针茅幼苗高度和胚根长度快速降低,400 mmol·L-1盐浓度下,幼苗高度最低,胚根最短(图4和图5)。内生真菌侵染显著影响紫花针茅幼苗和胚根生长(表2,图4和图5),其中,同一类型盐溶液在相同浓度下E+植株幼苗高度和胚根长度显著高于E-植株(图4和图5,P<0.05);同时,对照组内E+植株幼苗高度也显著高于E-植株(图5,P<0.05)。不同盐类型对紫花针茅幼苗高度和胚根长度抑制作用存在显著差异(表2);其中,NaCl对幼苗高度和胚根长度抑制作用最弱(图4a和图5a),Na2CO3对幼苗高度和胚根长度抑制作用最强(图4d和5d)。
2.3 内生真菌对紫花针茅种子萌发相对盐害率的影响
内生真菌侵染、盐类型、盐浓度能极显著影响紫花针茅种子萌发相对盐害率(表2,P<0.01);其中,内生真菌侵染、盐类型、盐浓度对紫花针茅种子萌发相对盐害率存在极显著交互作用(表2,P<0.01)。随盐浓度增加,紫花针茅种子萌发相对盐害率持续增加,400 mmol·L-1盐浓度下,种子萌发相对盐害率最高;对照组种子萌发相对盐害率为0(图6)。同时,内生真菌侵染能显著缓解紫花针茅种子萌发相对盐害率,表现出E-种子萌发相对盐害率显著高于E+种子(图6)。另外,不同类型盐溶液对紫花针茅种子萌发相对盐害率存在显著差异(表2),其中,Na2CO3和Na2SO4种子萌发相对盐害率较高而NaCl最低(图6)。

表2 内生真菌侵染、盐类型和盐浓度对紫花针茅幼苗生长(幼苗高度和胚根长度)特性及相对盐害率影响的三因素方差分析Table 2 Results of three-way ANOVA for endophyte infection status(E),salt type(ST)and salt concentration(SC)on relative salt damage rate,seedling height and radicle length of S.purpurea
3 讨论
种子萌发和幼苗定植阶段是植物种群形成、扩张和持续更新的关键时期,也是植物对外界生物和非生物逆境响应的最敏感时期。Dissanayaka等[39]研究发现,植物是否能正常生长通常取决于种子萌发和成苗这两个关键阶段。也有研究表明,种子萌发阶段对外界环境十分敏感,易受环境因子的影响[40]。盐胁迫是种子萌发阶段最常见的胁迫因子,种子在盐胁迫环境中表现出发芽率低、发芽缓慢、发芽种子后期死亡现象频发等特征,尤其对于盐敏感型植物[41]。本研究发现,紫花针茅种子在不同盐种类胁迫环境中存在种子发芽率低、发芽速度慢、幼苗和胚根生长受抑现象,这主要与植物对盐离子的吸收有关:一方面,盐胁迫条件下,植物生理生化过程会遭到破坏,使植物体内积累大量盐离子,致使其渗透势增高,造成植物缺水[42];另一方面,细胞受到外界胁迫压力时,会导致细胞膜透性增大,进而损伤细胞膜的正常生理、代谢功能,对植物产生毒害作用[43]。也有研究发现,在低盐浓度的生长环境中,盐中的无机离子作为渗透调节物质,不仅可缩短种子萌发时间,提高发芽率,一定程度上也会促进胚根生长,提高发芽势、发芽指数、幼苗高度和胚根长度[44]。
不同类型盐溶液对植物种子萌发和幼苗生长影响存在明显差异。邸桂俐等[45]研究表明,随着盐浓度的增加,Na2CO3对于锁链稗(Echinochloa crusgalli)种子的发芽率、发芽指数以及发芽势的抑制作用大于NaHCO3和NaCl。同样,雷春英等[46]研究发现盐分对盐爪爪(Kalidium foliatum)种子萌发和幼苗生长的毒害性最大的为Na2CO3、Na2SO4,NaCl毒性最弱。本研究发现,不同类型盐对于紫花针茅种子萌发的抑制性不同,Na2SO4、Na2CO3对种子发芽势和发芽率抑制作用最大;此外,Na2CO3和Na2SO4相对盐害率最大,表明这两种盐对紫花针茅种子毒害性最强;与之相反,NaCl对紫花针茅种子萌发相对盐害率最低,表明NaCl对种子萌发的危害性最小,这与前人的研究结果相似[47]。造成这种现象的主要原因为:1)Na2CO3、Na2SO4均为强碱弱酸盐,碱性强,pH高,造成植物细胞结构与功能被破坏,离子平衡被打破[48];2)碱性盐对植物种子萌发和幼苗生长的毒害作用明显高于盐离子引起的毒害作用,造成种子幼苗和根生长时间缩短,甚至无根[45];3)NaCl在自然界中普遍存在,很多禾草都对其具备一定耐受性。同时,本研究也发现,Na2SO4对紫花针茅种子抑制作用最强,而NaCl抑制作用最弱。由此可见,不同类型盐对植物种子萌发的抑制作用表现出种间差异性,这可能与植物种子遗传背景、种子成熟环境及种子萌发阶段土壤盐类型等因素有关[49]。另外,NaCl和Na2CO3混合盐对种子萌发抑制作用较小,这与卢艳敏等[50]混合盐胁迫对白三叶(Trifolium repens)种子萌发的抑制作用低于相应浓度Na2CO3胁迫的研究结果相似。主要原因是Cl-代替了一半CO32-,造成CO32-盐害作用小。同时,Cl-、CO32-离子间竞争也能缓解了CO32-毒害作用[50]。
青藏高原西部、东部土壤以SO42-盐为主,Cl-、HCO3-盐次之,CO32-盐含量较低[51]。本研究发现SO42-盐对于紫花针茅种子萌发的抑制作用极强,但紫花针茅作为青海湖流域高寒草地主要优势禾草,其原因可能与分蘖是紫花针茅个体增加的主要繁殖方式的繁殖策略有关[52];同时,紫花针茅成株耐盐能力较强,其体内耐盐相关基因会在高盐浓度下超表达[53]。综上所述,紫花针茅采用间歇式种子萌发策略,寻找种子适宜萌发最佳土壤环境,形成更新群体。此外,成株强耐盐能力也为种群扩张提供保障。上述结论也从侧面支撑紫花针茅成为环青海湖盐碱化危害严重地区建群禾草的潜在原因。
众多研究表明,内生真菌能显著提高盐胁迫条件下野大麦[54]、醉马草(Achnatherum inebrians)[55]、中华羊茅(Festuca sinensis)[56]、高羊茅(Festuca arundinacea)[55]、披碱草(Elymus nutans)[57]、黑麦草(Lolium perenne)[58]等冷季型禾草种子萌发能力。盐胁迫逆境下,内生真菌通过提高抗氧化酶活性、降低丙二醛含量和增加脯氨酸含量等生理途径来增强禾草种子萌发能力[59]。另外,内生真菌也通过调节种子渗透能力、增强种子活性氧清除能力和降低膜脂过氧化伤害等途径缓解盐胁迫逆境对禾草种子伤害[59]。本研究发现,内生真菌能显著提高紫花针茅种子萌发和幼苗生长阶段的耐盐性,这可能与内生真菌促进禾草种子细胞渗透能力和增加抗氧化酶的活性,从而保护盐胁迫环境下紫花针茅种子细胞膜受损,维持细胞内外离子含量平衡,促进种子处于水分充盈环境,从而保证紫花针茅种子能正常完成种子萌发[60]。
大量研究表明,E+紫花针茅相对盐害率低于E-。强Na2CO3和Na2SO4盐胁迫环境下,E+种子对盐害耐受力显著高于E-,这与其他E+、E-禾草在盐胁迫下种子萌发和幼苗生长阶段的对比研究结果一致[61]。同时,盐胁迫环境中E+种子表现出萌发数量多、萌发速度快等特征,从而证实内生真菌能显著影响盐胁迫逆境下种子萌发进程,增加种子对盐胁迫环境的耐受能力[61]。另外,随着种子萌发过程结束,地上叶片持续伸展,内生真菌将在叶部细胞隙间不断扩张繁殖,表现出宿主生长同步性[62]。众多研究表明,内生真菌在盐胁迫环境中能提高禾草苗期光合能力,从而储备更多碳水化合物供地上组织生长和地下根系发育,进而表现出幼苗阶段E+植株叶片大、分蘖多、茎秆壮等表型特征;与之相反,E-幼苗由于缺少内生真菌侵染则在盐胁迫条件下表现出叶片窄短、分蘖稀疏和茎秆纤细等特征[63],本研究结果与其相吻合。
由此可见,内生真菌侵染能显著提高紫花针茅种子萌发和幼苗定植能力,这一结果也为紫花针茅成为青海湖流域高寒草原优势禾草提供直接证据,表明内生真菌侵染可能成为紫花针茅适应青海湖滨盐渍化土壤且成为建群物种的主要原因之一。同时,后续将开展E+、E-幼苗生长阶段内生真菌是否通过调控细胞内外盐离子平衡、清除活性氧能力及增加抗氧化物质等方面研究,从而揭示内生真菌提高紫花针茅耐盐性的生理生化机理。
4 结论
随盐浓度不断增加,紫花针茅种子发芽率、发芽势、发芽指数持续降低,胚根发育和幼苗生长受到严重抑制。同时,不同盐类型对紫花针茅种子萌发和幼苗生长特性表现出差异,Na2CO3和Na2SO4对紫花针茅种子萌发和幼苗生长相对盐害率最高。另外,内生真菌侵染能显著提高紫花针茅种子发芽率、发芽势、发芽指数、胚根长度和幼苗高度,表现出E+紫花针茅种子相对盐害率低于E-;其中,内生真菌侵染后紫花针茅对Na2CO3胁迫的耐受能力最强。综上所述,内生真菌侵染是紫花针茅适应青海湖流域盐渍化土壤且成为高寒草原优势禾草的主要原因之一,这将为利用内生真菌-紫花针茅共生体进行盐碱地改良和耐盐禾草种质创新奠定理论基础。
