外泌体介导miRNA-155靶向CTHRC1对胃癌细胞腹膜种植转移的影响
2022-10-24高正兴
高正兴,赵 琳
(北京市大兴区人民医院 检验科,北京102600)
胃癌(gastric carcinoma)通过早期的检测和筛查可有效降低其发病率和死亡率[1-2]。然而,据估计大约有一半的胃癌患者在晚期被发现,这种情况显示了预防和早期检测的重要性,特别是在高危人群中[3]。引起胃癌的风险因素有很多,遗传因素和环境因素是主要的两个方面[4]。有研究发现,有胃癌家族史会增加个体患胃癌的风险,其危险程度取决于家族中胃癌亲属数量及亲属血缘关系的亲密程度[5]。外泌体(exosomes)是一种包含RNA和蛋白质的小泡膜,可转运至受体细胞,改变受体细胞的基因表达,从而参与细胞增殖、分化和转移等过程[6]。miRNA-155是miRNA家族中的一种,已有研究显示,miRNA-155在多种肿瘤患者的血清中均呈现高表达状态,同时miRNA-155表达水平与患者肿瘤恶性程度具有一定的相关性[7]。胶原三螺旋重复蛋白1(CTHRC1)可参与血管受损后的重塑修复过程,其异常表达对肿瘤扩散、侵袭、迁移、黏附和转移均具有重要作用[8-9]。目前关于外泌体转运miRNA-155在胃癌中作用尚不清楚,因此本研究分离胃癌细胞外泌体,并探讨外泌体转运miRNA-155靶向CTHRC1对胃癌细胞腹膜种植转移的影响,报道如下。
1 材料与方法
1.1 细胞、试剂与仪器
细胞:自武汉普诺赛公司购买胃癌BCG-823和人腹膜间皮HMrSV5细胞株。
试剂:RPMI1640培养液(批号:148971)、胎牛血清(批号:194243)、胰蛋白酶(批号:1349781)购自美国GIBCO公司;于自美国Sun-Shine公司购买PKH26染色试剂盒;荧光素酶检测试剂盒购自南京建成生物有限公司;RT-qPCR试剂盒、RNA提取试剂盒、外泌体提取试剂盒和RNA反转录试剂盒(批号:9871023)购自上海优宁维生物有限公司;CTHRC1(批号:3154284)和β-actin(批号:9418721)蛋白抗体购自美国abcam公司;二抗(山羊抗兔)购于武汉三鹰公司。
仪器:BSC-1100IIB2-X生物安全柜、博科300LCO2细胞培养箱(中国博科公司);5320R4℃离心机(德国徕卡公司);Mini-PRO TEAN电泳仪(美国伯乐公司);EVOS M7000倒置显微镜(意大利赛默飞公司);BKQ-B75高压蒸汽灭菌锅(中国博科公司);LAS 4000成像系统、透射电子显微镜(GE Healthcare公司,美国);激光共聚焦显微镜(赛默飞世尔科技公司,美国)。
1.2 实验方法
1.2.1细胞培养 从液氮罐中取胃癌BCG-823细胞株、人腹膜间皮HMrSV5细胞株各一支进行细胞复苏,将复苏后的细胞置于RPMI1640培养基中,采用细胞培养皿进行分装,并放置在培养箱中进行培养(培养条件:5%CO2;37℃),细胞覆盖率合格后,加入胰蛋白酶细胞传代培养。
1.2.2细胞分组 实验分为阴性对照组、外泌体组和miRNA-155 mimic组。阴性对照组细胞加入miRNA-155阻断剂,外泌体组加入外泌体混悬液(100个/细胞),miRNA-155 mimic组加入外泌体转运miRNA-155 mimic混悬液(100个/细胞),48 h后进行相关检测。
1.2.3外泌体提取与鉴定 胃癌BCG-823细胞经1.2.1步骤培养后3 000(r/min)离心30 min,取上清于一支新的离心管中,加入1/3体积RiboTM Exosome Isolation Reagent,混匀,放置4℃冰箱中过夜(设为1号管);次日取2 ml于一支新的离心管中(2号管),2 000(r/min)离心30 min,去除上清液,继续加入1号管中的液体2 ml,重复上述离心步骤,到1号管中液体全部取完,此时2号管中的沉淀即为外泌体。取2号管中外泌体10 μl,采用透射电镜进行观察。
1.2.4外泌体转运miRNA-155 mimic的制备 取浓度为200 μg/ml Cy3-miRNA-155 mimic溶于1.2.3提取的外泌体混悬液中,定容至1 ml,在恒温培养箱中孵育1 h(37℃),离心10 min(9168rpm),用0.22 μm过滤器进行过滤后再离心120 min(120 000 rpm,4℃),弃上清,将沉淀溶于100 μl磷酸盐缓冲液中得到外泌体转运miR-324-5p mimic混悬液。
1.2.5总RNA提取及RT-qPCR 取出培养皿放入无菌操作台,弃去培养皿中的培养液。根据RNA提取试剂盒说明步骤分别提取胃癌细胞和外泌体总RNA,并利用反转录试剂盒得到cDNA保存至-80℃备用。RT-qPCR体系:SYBR Green qPCR SuperMix 16.25μl,特异性引物2.0 μl,模板cDNA3.25 μl,DEPC水补足至30 μl。反应条件为:95℃,10 min;95℃,10 s;60℃,30 s;70℃,30 s;共40个循环。设置6个复孔,根据公式(2-ΔΔCT法)计算、分析miRNA-155表达,引物序列见表1。

表1 引物序列
1.2.6外泌体吞噬实验 依照PKH26染色试剂盒说明书步骤严格执行,取1.2.1步骤中培养好的人腹膜间皮HMrSV5细胞,滴加外泌体(已用PKH26标记),DAPI染色,最后在显微镜(激光共聚焦显微镜)下进行观察。
1.2.7划痕实验检测细胞迁移力 将腹膜间皮细胞HMrSV5分为阴性对照组(加入miRNA-155阻断剂)、外泌体处理组(加入外泌体)和miRNA-155 mimic组,细胞按5×105个/mL接种于6孔板内,置于培养箱中培养48 h。划痕实验时吸头垂直孔壁划痕,并加入无血清培养基,划痕完成后在显微镜下(EVOS M7000倒置显微镜)观察,对迁移率进行分析计算。
1.2.8荧光素酶报告基因检测 构建CTHRC1-WT、CTHRC1-Mut基因pGL3载体质粒。采用24孔板培养细胞,然后以100 ng每孔的浓度转染至HMrSV5细胞,同时转染的还有miRNA-155的各组细胞,每组设置6个复孔,转染24 h后使用双荧光素酶报告基因检测试剂盒检测各组荧光强度。
1.2.9Western blotting检测相关蛋白表达 细胞分组同1.2.7,取出培养皿放入无菌操作台,弃去培养皿中的培养液,并加入1 ml PBS和100 μl蛋白酶K溶液,使细胞悬浮,经破碎细胞、离心,取上清置于管中。经SDS-PAGE电泳分离、转膜和封闭后用特异性抗体CTHRC1、内质网分子伴侣Calnexin、CD9、CD81和β-actin在4℃条件下孵育12 h,孵育后的条带清洗三次(1%吐温),二抗孵育2 h,LAS 4000成像并观察结果。
1.3 统计学方法
2 结果
2.1 外泌体鉴定
在透射电子显微镜下观察经提取后的外泌体,在细胞培养上清液中可见提取的80%以上微囊泡呈现杯口状,直径40-150 nm,见图1①。Western blotting鉴定发现,外泌体标志性蛋白CD9、CD81呈阳性,未见内质网分子伴侣Calnexin表达,见图1②。

图1 外泌体鉴定 ①透射电镜下观察外泌体结构;②蛋白CD9、CD81表达情况
2.2 各组miRNA-155表达水平比较
使用RT-qPCR技术检测外泌体及各组miRNA-155表达水平,外泌体中miRNA-155表达水平为(0.49±0.03),与对照组(0.21±0.03)比较,外泌体组内miRNA-155为(0.51±0.04)显著偏高,而与其他两组对比,miRNA-155 mimic组为(0.78±0.08)显著偏高(P<0.05),见表2。

表2 各组miRNA-155表达水平比较(%)
2.3 外泌体摄取
以腹膜间皮细胞作为受体细胞,胃癌BCG-823细胞作为外泌体的供体细胞,采用PKH26对外泌体标记后在显微镜下呈红色,其主要分布在人腹膜间皮细胞HMrSV5的细胞质内,且视野下大部分细胞均可见红色荧光,见图2。

注:A:PKH26标记的外泌体;B:HMrSV5细胞核;C:融合荧光
2.4 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5迁移力比较
细胞划痕检测细胞迁移力,结果显示,与阴性对照组比较,外泌体组和miRNA-155 mimic组细胞迁移力显著增加,与外泌体组比较,miRNA-155 mimic组细胞迁移力显著增加(P<0.05),见表3,图3。

表3 各组腹膜间皮细胞HMrSV5迁移力比较(%)

注:A:对照组;B:外泌体组;C:miRNA-155 mimic组
2.5 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞增殖的影响
CCK实验,结果显示,与阴性对照组比较,外泌体组和miRNA-155 mimic组细胞增殖显著增加,与外泌体组比较,miRNA-155 mimic组细胞增殖显著增加(P<0.05),见表4,图4。

表4 各组腹膜间皮细胞HMrSV5细胞增殖比较(%)

图4 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞增殖的影响
2.6 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞活力的影响
EDU实验,结果显示,与阴性对照组比较,外泌体组和miRNA-155 mimic组细胞活力显著增加,与外泌体组比较,miRNA-155 mimic组细胞活力显著增加(P<0.05),见表5,图5。

表5 各组腹膜间皮细胞HMrSV5细胞活力比较(%)
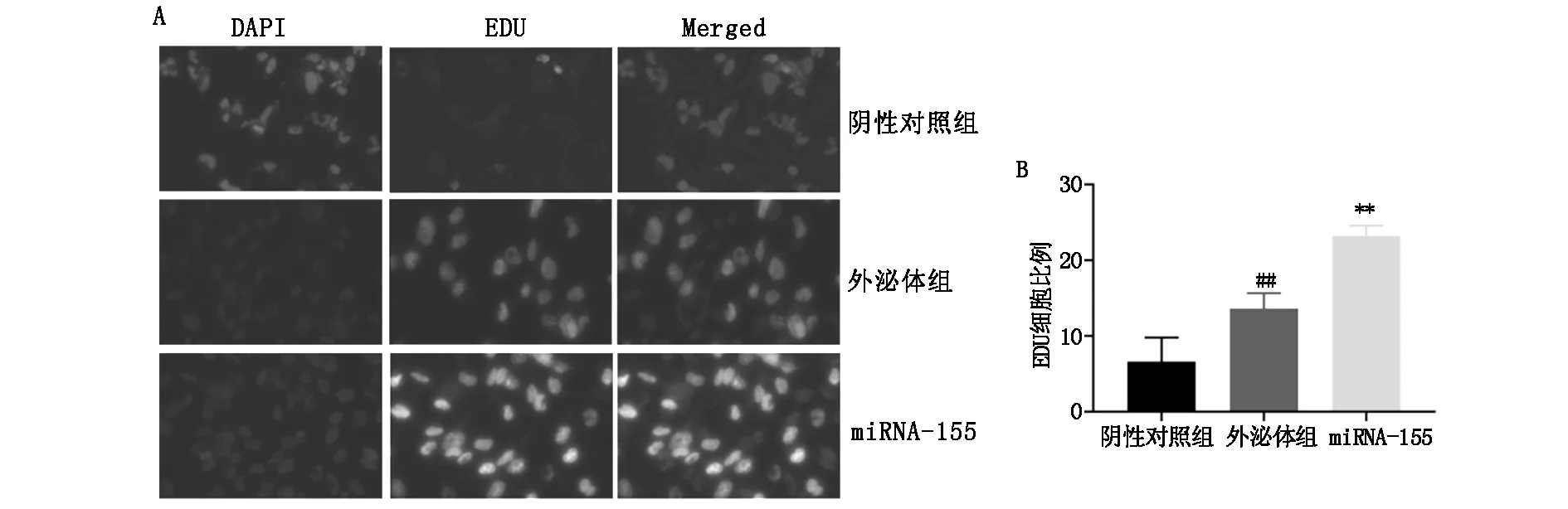
图5 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞活力的影响
2.7 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞迁移能力的影响
细胞迁移实验,结果显示,与阴性对照组比较,外泌体组和miRNA-155 mimic组细胞迁移显著增加,与外泌体组比较,miRNA-155 mimic组细胞迁移显著增加(P<0.05),见表6,图6。
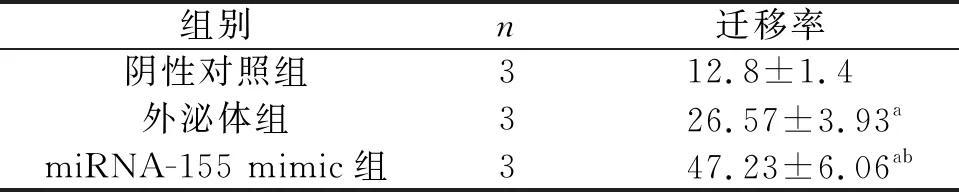
表6 各组腹膜间皮细胞HMrSV5细胞迁移比较(%)

图6 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5细胞迁移的影响
2.8 荧光素酶报告基因检测报告结果
双荧光素酶报告实验结果显示miR-155与CTHRC1的靶向结合位点,通过敲低BCG-823细胞中的miR-155可以发现,与NC组相比,miR-155 mimic与野生型CTHRC1共转染后细胞相对荧光素酶活性明显降低(P<0.05),而与突变组共转染后,miR-155 mimic荧光强度变化无统计学意义(P>0.05),如图7。

图7 miR-155与CTHRC1的靶向结合位点及各组双荧光素酶活性检测
2.9 外泌体转运miRNA-155对腹膜间皮细胞HMrSV5 CTHRC1蛋白表达的影响
与阴性对照组(0.66±0.05)比较,CTHRC1蛋白在外泌体组和miRNA-155 mimic组表达分别为(0.43±0.04)和(0.21±0.03),显著降低,三组比较,miRNA-155 mimic组最低(P<0.05),见表7,图8。

表7 外泌体对腹膜间皮细胞HMrSV5 CTHRC1蛋白表达的影响

注:A:对照组;B:外泌体组;C:miRNA-155 mimic组。
3 讨论
据统计,2015年全国胃癌发病病例为40.3万,占所有肿瘤的10.25%,与此同时,共有293800人因胃癌死亡,死亡率为21.48/10万[10]。胃癌的死亡率男性高于女性,具有显著的地区差异,城市发病率高于农村,经济较发达地区发病率较高,东南沿海地区发病率呈迅速上升趋势[11]。由于早期胃癌诊断困难,缺乏典型临床症状,且尚无有效的生物标志物,因此导致大多数病人在就诊时被诊断为晚期胃癌,从而治疗效果不理想。同时由于临床常规药物治疗的局限性和后期产生的耐药性,也限制了胃癌的治疗[12]。因此了解和评价胃癌的具体作用机制,寻找有效的、新颖的检测方法来提高胃癌早期的发现率、预后的预测及个性化治疗是一个迫切的问题。
研究表明多种恶性肿瘤患者外泌体中含有与复合体相关的微小RNA,而癌细胞外泌体中存在前miRNA,同时癌细胞外泌体也可介导miRNA高效快速沉默,以重新编程靶细胞转录体[13]。研究证实,miRNA-155能够经由巨噬细胞来源的胞外体向心脏纤维蛋白原内转移,而含有miRNA-155的外泌体可通过降低细胞因子信号转导1的表达促进炎症[14]。最新研究表明miRNA-155在活化的B和T细胞以及慢性胃炎症中的单核细胞/巨噬细胞中高度表达,miRNA-155介导的胃病变可能是由于miRNA-155的过度表达而引起的[15]。本研究在显微镜下观察经提取后的外泌体,在细胞培养上清液中可见提取的外泌体80%以上为直径40-150nm的微囊泡,呈现杯口状,外泌体标志性蛋白CD81、CD9呈阳性,使用RT-qPCR检测法进一步明确外泌体内与胃癌细胞内的miRNA-155表达量,结果发现外泌体内其表达量显著高于胃癌细胞内。表明外泌体作为一种包含RNA和蛋白质的小泡膜,其内miRNA相对含量显著高于细胞内,经由细胞排出后,作用于受体细胞,发挥其特有的生物学功能。
目前关于胃癌细胞腹膜种植转移的机制尚未阐明。有学者认为胃癌细胞种植到腹腔需要多种条件的共同作用,首先是胃癌细胞脱离原发病灶,并接触腹膜的间皮细胞,使间皮细胞发生异常改变,间皮细胞凋亡、脱落,形成有利于胃癌细胞定植的生存环境[16]。因此,本研究结果发现间皮细胞可吞噬胃癌来源外泌体,与外泌体融合后外泌体稳定的存在于间皮细胞胞质中。同时本研究用外泌体转运miRNA-155处理间皮细胞后发现,与正常的间皮细胞相比,在进行外泌体和外泌体转运miRNA-155处理后,间皮细胞转移力显著增强,提示胃癌来源外泌体可引起间皮细胞迁移力、细胞增殖、细胞活力和细胞迁移显著增加,间皮细胞获得更强的细胞迁移力、细胞增殖、细胞活力和细胞迁移显著增加,同时也为胃癌细胞的定植和扩散提供了有利的体内环境,其机制可能是外泌体中过表达的miRNA-155可促进细胞扩散。
CTHRC1在一些病理生理过程中起着关键作用,在多种肿瘤中CTHRC1的异常表达与肿瘤的发生、增殖、侵袭和转移有关[17]。肿瘤细胞中CTHRC1蛋白的低表达可能对附近微环境产生影响,诸如细胞外基质(ECM)以及基质细胞,对肿瘤的迁移与侵袭等具有促进作用[18]。有证据显示,CTHRC1异位表达于HepG2细胞内可降低细胞的侵袭与迁移活性,同时经由肺转移小鼠模型发现其对肿瘤转移具抑制作用[19]。有研究报道,miRNA-155可通过体外靶向CTHRC1在结直肠癌中发挥抑癌作用[20]。在本研究中,采用外泌体转运miRNA-155处理间皮细胞,发现处理后的间皮细胞CTHRC1表达显著低于未处理的细胞,表明低表达的CTHRC1可能会促进细胞的转移,结合荧光素酶报告基因检测验证miRNA-155的靶基因,结果显示CTHRC1为其下游靶基因。其机制可能是胃癌来源外泌体中过表达的miRNA-155靶向抑制CTHRC1的表达,因此导致间皮细胞的生物学状态发生改变,向利于胃癌细胞种植转移的方向转变。
综上所述,外泌体转运miRNA-155可能通过靶向抑制CTHRC1的表达,从而促进间皮细胞的转移,为胃癌的种植转移提供了有利的定植环境,增加了胃癌转移的风险。同时miRNA-155和CTHRC1具有成为临床胃癌治疗靶点的潜质。
