陕西地区静脉血栓栓塞症患者 MTHFR和MTRR基因多态性分析以及对临床诊疗的指导意义
2022-10-24张李婷马文兵
张李婷,马文兵,2*,关 栋,邓 祥
(1.西安交通大学第一附属医院 药学部,陕西 西安710061;2.西安交通大学生命科学与技术学院,陕西 西安710049)
静脉血栓栓塞症(VTE)是临床常见的一种血管综合征,由深静脉血栓(DVT)和肺栓塞(PE)构成,是同一疾病的两种不同形式。目前,静脉血栓已成为心血管疾病的第三位病因,也是肺癌等癌症的常见并发症[1]。VTE是一种复杂的多因素疾病,基因突变在其中发挥着重要作用[2],但VTE基因突变具有很大的民族和地域特征。寻找特异度高的诊断标志物,对VTE的治疗及预防具有重要意义。近年来研究发现,亚甲基四氢叶酸还原酶(MTHFR)和蛋氨酸合成酶还原酶(MTRR)基因多态性可能与深静脉血栓形成存在相关性[3]。MTHFR和MTRR基因变异引起相应的酶活性降低可阻抑同型半胱氨酸转化为甲硫氨酸,导致低叶酸血症和高同型半胱氨酸血症(HHcy)。HHcy对血管内皮细胞具有较大的毒性刺激作用,会引起内皮细胞功能损害,导致血小板黏附性增强,同时能够在血管内引起一系列的氧化应激反应,使脂质代谢紊乱,这一系列过程均会促进血栓的形成[4]。本研究通过对陕西地区VTE患者进行MTHFR和MTRR基因检测,探讨MTHFR和MTRR基因多态性与VTE发病风险的相关性,为VTE的防治提供理论依据。
1 资料与方法
1.1 数据来源
检索Pubmed、Web of Science、中国学术期刊全文数据库、万方科技期刊全文数据库。英文检索词为“venous thrombosis”“MTHFR”“MTRR”“Gene”,中文检索词为“静脉血栓”“MTHFR”“MTRR”“基因多态性”等,各检索词以“and”/“和”连接,按需要组合。
1.2 一般资料
选取2019-2020年本院诊断为静脉血栓栓塞并行MTHFR和MTRR基因多态性检测的患者439 例,其中男性285例,女性154例;年龄 16-94 岁,平均年龄(64.5±13.1) 岁。所有患者籍贯均为陕西地区汉族人口,无血缘关系,否认家族遗传病病史。
1.3 纳入标准
年龄≥16岁,符合临床静脉血栓栓塞诊断标准;排除肝肾功能严重损害患者,任何有凝血倾向高危患者,妊娠和哺乳期妇女,合并血液学、严重感染性疾病以及肿瘤的患者。
1.4 监测方法
患者静脉抽血2 ml置于EDTA抗凝管中,将待检血液标本颠倒混匀数次,吸取100 μl加入到400 μl样本萃取液(CQ-ENH型,济南广音医疗科技有限公司)中,混匀,上下颠倒震荡离心管10次,使血样与样本萃取液混匀,然后置于离心管架,静置10 min,待红细胞充分裂解,至呈现透明的红色液体。将静置后的透明红色液体,离心去除上清,白细胞萃取完成。取1.5 μl白细胞混悬液加到1支地高辛染色液,充分混匀并短暂离心,完成后盖紧管盖,置入荧光检测仪(西安天隆科技有限公司生产的多通道荧光定量分析仪Fascan 48S)。采用荧光染色原位杂交及染色体核型分析系统自动判读荧光信号值,获取荧光曲线图,进行MTHFR(677C>T)和MTRR(66A>G)基因分型,并作阳性质控。
1.5 统计学方法
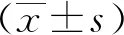
2 结果
2.1 Hardy-Weinberg平衡分析
对陕西地区VTE患者MTHFR(677C>T)和MTRR(66A>G)基因位点的检测数据进行Hardy-Weinberg遗传平衡检验(χ2=0.4556,P=0.4997;χ2=0.8189,P=0.1811),检验结果符合Hardy-Weinberg遗传平衡,该样本具有区域群体代表性。见表1。

表1 陕西地区VTE患者MTHFR和MTRR基因Hardy-Weinberg遗传平衡分析
2.2 439例VTE患者MTHFR和MTRR基因型及等位基因分布
在439份检测标本中,MTHFR和MTRR基因型分布由多到少分别为CT、TT、CC;AA、AG、GG,分别占患者总数的48.06%、30.07%、21.87%;67.43%、28.93%、3.64%。MTHFR CC及TT等位基因频率分别为45.90%和54.10%;MTRR AA和GG等位基因频率分别为81.89%和18.11%。见表2。
2.3 不同性别VTE患者MTHFR和MTRR基因型及等位基因频率分布
本研究将VTE患者分为男、女两个组,结果显示,男、女患者MTHFR和MTRR基因型分布差异无统计学意义(χ2=1.072,P=0.585;χ2=0.164,P=0.921),等位基因分布差异无统计学意义(χ2=1.094,P=0.296;χ2=0.167,P=0.683)。见表2。

表2 不同性别的患者MTHFR和MTRR基因型及等位基因分布
2.4 不同年龄段VTE患者MTHFR和MTRR基因型及等位基因频率分布
本次研究将VTE患者分为四个年龄段,分别为≤40岁、40-60岁、60-80岁和>80岁。结果显示,不同年龄段患者MTHFR和MTRR基因型分布无统计学意义(χ2=8.500,P=0.204;χ2=7.989,P=0.239),等位基因分布也无统计学意义(χ2=6.931,P=0.074;χ2=2.701,P=0.440)。见表3。

表3 陕西地区与国内外其他地区VTE人群MTHFR基因型以及等位基因分布频率比较

表3 不同年龄患者MTHFR和MTRR基因型及等位基因分布
2.5 陕西地区VTE汉族患者与国内外其他地区VTE人群MTHFR基因分布及等位基因分布比较
比较陕西地区VTE汉族患者和国内外其他地方人群,各少数名族以及不同种族之间MTHFR基因分布及等位基因分布差异。结果显示,陕西地区汉族VTE人群MTHFR基因型以及等位基因分布与欧美亚国家韩国、俄罗斯、荷兰、美国、希腊、加拿大、奥地利、土耳分布情况比较差异具有统计学意义(P<0.05),与我国其他地区台湾、福建、广西、广东、南昌和新疆分布情况比较差异具有统计学意义(P<0.05),与南京、沈阳、郑州、湖南分布情况比较差异无统计学意义(P>0.05)。陕西地区汉族VTE人群MTHFR基因型分布与北京、哈尔滨比较差异无统计学意义(P>0.05),而MTHFR等位基因分布与北京、哈尔滨比较差异具有统计学意义(P<0.05),见表4。
3 讨论
VTE是一种常见且严重的血栓疾病,是全球范围内可预防的主要疾病和死亡的原因[24]。越来越多的研究证实VTE是一种复杂的、多因素的疾病,是由易感性与遗传和获得性危险因素相互作用的结果。近年来,关于MTHFR基因多态性与VTE发病风险关系的研究报道较多,但结论不一致。有学者认为MTHFR多态性与VTE易感性有相关性[25],但也有研究表明两者之间没有相关性[26],除MTHFR C677T多态性外,MTRR A66G多态性是否能增加VTE易感性也是一个高度争论的问题。MTHFR和MTRR是叶酸代谢系统中的关键酶,其基因多态性可导致叶酸代谢关键酶活性降低,研究发现,若MTHFR第677位和MTRR的第66位产生突变,会导致相应的酶活性下降,影响DNA的合成和甲基化异常、引起叶酸代谢障碍,可能引起Hcy水平上升,Hcy是由蛋氨酸转化为半胱氨酸而形成的一种中间氨基酸,许多研究报道血栓性事件后,HHcy 是一种重要的独立促凝因子[27-28],也是VTE的危险因子[29-30]。因此,通过检测VTE患者的MTHFR和MTRR基因多态性对于个体化使用叶酸治疗意义重大,为VTE的防治提供理论依据。
本研究对陕西人群中VTE患者的MTHFR和MTRR基因多态性进行分析。通过对陕西地区439例汉族VTE人群进行基因检测,结果显示,陕西省汉族VTE人群MTHFR CC及TT等位基因频率分别为45.90%和54.10%;MTRR AA和GG等位基因频率分别为81.89%和18.11%。此外,MTHFR和MTRR基因型在439例临床样本中的分布频率,其中以CT(211)和AA(296)为主,分别为48.06%和67.43%,这一结果与杨博逸等人研究相似[31]。另外分析了不同性别VTE患者MTHFR和MTRR基因型、等位基因分布没有差异,说明性别对陕西地区MTHFR和MTRR基因多态性无明显影响。不同年龄段患者MTHFR和MTRR基因型以及等位基因分布无统计学意义,本次研究样本基数较大、年龄跨度大以及性别分布均衡,能够全面地体现陕西地区MTHFR和MTRR基因多态性的分布特征。
MTHFR基因型和等位基因频率分布有种族、地域的差异。CC基因型酶活性能够达到100%,CT基因型酶活性只有65%,而TT基因型酶活性仅有30%,酶活性降低将导致活性叶酸生成不足,同型半胱氨酸水平升高。大量研究证实我国MTHFR C677T位点突变频率较高,且存在显著的地理和种族差异[32]。本研究发现陕西地区的VTE人群TT纯合子等位基因和基因型突变频率分别为54.10%和30.07%,这一结果和其他研究相近[12]。陕西地区的VTE人群TT纯合子基因型突变频率远远高于其他国家如荷兰人约为10.06%,希腊人约为13.64%,加拿大人约为14.73%,奥地利人约为9.68%,土耳其人约为8.75%,墨西哥人约为13.68%,美国约为20.71%,韩国人约为23.15%。我国MTHFR C677T位点TT基因型频率平均约23.2%,但是南北地区之间似乎存在一定的差异。南方VTE人群TT基因型频率相对较低,如台湾(8.04%)、福建(8.34%)、广东(7.14%),广西(26.67%)、湖南(18.87%),而南昌(32.67%)、南京(25.00%)却高于陕西地区;陕西地区VTE人群TT基因型频率与中部城市郑州(27.18%)接近,而低于北方城市如新疆(28.40%)、哈尔滨(38.36%)、沈阳(33.33%),从上述数据上发现,我国TT基因型频率整体上呈现出北高南低的分布特点,这与Huang等研究结果一致[33]。本研究表明,不同国家、地区之间代谢型存在着一定差异,不同地区汉族MTHFR基因表型分布也存在差异。因此,通过MTHFR和MTRR基因检测评估VTE患者的血栓风险从而对于高风险的患者进行强化抗栓治疗可能会为该类患者带来获益。
综上研究表明,陕西地区VTE患者MTHFR和MTRR基因型主要以 CT、AA为主,等位基因以T和A为主,不同性别、年龄段患者基因型及等位基因分布差异均无统计学意义。本研究还通过对陕西地区VTE患者MTHFR基因多态性与国内外其他地区的对比分析,结果发现与国外MTHFR基因型以及等位基因分布均有差异,与我国其他地区台湾、福建、广西、广东、南昌和新疆分布情况比较有差异,与南京、沈阳、郑州、湖南分布情况比较无差异。陕西地区汉族VTE人群MTHFR基因型分布与北京、哈尔滨比较无差异,而MTHFR等位基因分布与北京、哈尔滨比较有差异。通过MTHFR和MTRR基因检测不仅有助于筛查高危人群,同时为临床医生进行强化抗栓治疗以及使用叶酸提供一定的参考依据。
