乳酸菌发酵茶花粉对α-葡萄糖苷酶抑制率的影响
2022-10-24罗粤鹏杨远帆于洋君何君竹
罗粤鹏 杨远帆,2,3 于洋君 何君竹 伍 菱,2,3
(1. 集美大学海洋食品与生物工程学院,福建 厦门 361021;2. 福建省食品微生物与酶工程重点实验室,福建 厦门 361021; 3. 厦门市食品生物工程技术研究中心,福建 厦门 361021)
抑制α-葡萄糖苷酶活性是控制餐后血糖及降低糖尿病的重要手段[1]。蜂花粉是蜜蜂采集的花粉与蜜蜂特殊的腺体分泌物天然凝集形成的一种不规则扁圆混合物,富含碳水化合物、蛋白质、维生素和多酚等活性成分[2],具有抑制α-葡萄糖苷酶的作用,能够有效控制餐后血糖升高,达到延缓和控制糖尿病的效果[3],使用蜂花粉抑制α-葡萄糖苷酶是近年来的热点研究[4]。
蜂花粉包括茶花粉、荷花粉、油菜花粉和玉米花粉等,其中茶花粉是中国大宗蜂花粉之一,营养丰富、功效全面,备受消费者青睐,其还原糖含量为36.25%,蛋白质含量为31.53%,脂肪含量为7.27%,多酚、黄酮含量丰富[5-6]。研究[7]发现,蜂花粉表层具有坚固的花粉壁,壁上的萌发孔通常为封闭状态,导致花粉细胞中活性成分难以溶出,造成花粉活性物质的生物利用率较低。此外,蜂花粉中还存在风媒花粉、昆虫唾液中的蛋白质及霉菌等致敏性物质,导致易敏人群产生花粉过敏症,制约蜂花粉的质量安全[8]。目前提高花粉活性物质生物利用度的研究方法主要有粉碎破壁法[9]、酶处理法[10]及微生物发酵法[11]等,其中微生物发酵法发酵条件温和、高效、容易操作、安全性高,能够在发酵过程中产生分泌酶,通过酶的作用打通花粉壁的萌发孔,促进生物活性物质的溶出。同时,微生物发酵可通过代谢水解蛋白质过敏原,减少或消除食物过敏原[12]。因此,微生物发酵是提高蜂花粉活性及降低其致敏性的重要方法。
乳酸菌是能从碳水化合物发酵过程中产生乳酸的一类细菌的总称,主要包括乳杆菌属、双歧杆菌属及乳球菌属等[13],目前被广泛应用于乳制品、果蔬发酵制品及酿酒工业中[14]。Vilma等[15]研究表明,鼠李糖乳杆菌发酵蜂花粉对于花粉中的酚类化合物具有显著的促进作用。Sun等[16]认为微生物发酵水解植食性植物原料后,其酚类物质含量和抗氧化活性的改变可能受到微生物种类、发酵温度及原料种类等多种因素的影响。课题组[6]前期研究发现,经嗜热链球菌和植物乳杆菌发酵后,茶花粉的水提物对α-葡萄糖苷酶的 IC50值由49.09 mg/mL降至38.79 mg/mL,表明乳酸菌发酵后的茶花粉能提高α-葡萄糖苷酶抑制活性。王聪等[17]采用蜂粮来源的乳酸菌Lactobacillussp. strain 2-3发酵油菜花粉,在最优感官评分发酵条件下其总酚含量和DPPH自由基清除能力相较于对照组显著提高,杨文超等[18]以乳酸菌活菌数和感官评分为试验指标优化蜂花粉的发酵工艺,优化后其适口性得到改善。目前以α-葡萄糖苷酶抑制率为指标的蜂花粉发酵工艺优化研究尚未见报道。
研究拟以茶花粉为原料,考察复合乳酸菌粉(干酪乳杆菌、嗜酸乳杆菌、鼠李糖乳杆菌、植物乳杆菌、青春双歧杆菌、乳双歧杆菌)接种量、发酵温度及发酵时间对α-葡萄糖苷酶抑制率的影响,旨在为发酵法提高茶花粉对α-葡萄糖苷酶抑制率提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
茶花粉:北京市华林蜂业有限公司;
α-葡萄糖苷酶(G0660-750UN)、对硝基苯基-α-D-吡喃葡萄糖苷(pNPG):美国Sigma公司;
磷酸氢二钾、磷酸二氢钾:分析纯,国药集团化学试剂有限公司;
复合乳酸菌菌粉[1×1010CFU/g,包括干酪乳杆菌(Lactobacilluscasei)、嗜酸乳杆菌(LactobacillusAcidophilus)、鼠李糖乳杆菌(LactobacillusRhamnosus)、婴儿乳杆菌(Bifidobacteriuminfantis)、青春双歧杆菌(BifidobacteriumAdolensentis)、乳双歧杆菌(Bifidobacteriumlactis)]:陕西森弗天然制品有限公司。
1.1.2 主要仪器设备
分析天平:BS223型,赛多利斯科学仪器有限公司;
高速万能粉碎机:FW80型,天津市泰斯特仪器有限公司;
分光光度计:Unico®7200型,上海尤尼柯仪器有限公司;
台式离心机:TDL-40B型,上海飞鸽仪器厂;
数显恒温水浴锅:HH-4型,上海精宏实验设备有限公司。
1.2 试验方法
1.2.1 茶花粉发酵工艺 茶花粉低温干燥后,粉碎过80目筛备用,准确称取茶花粉2.0 g,以料液比(m茶花粉∶V无菌水)1∶20 (g/mL)加入无菌水,115 ℃高压灭菌20 min,冷却至室温,接种一定比例的乳酸菌菌粉进行发酵, 100 ℃灭菌,5 000 r/min 离心20 min,取上清液[6]。
1.2.2 乳酸菌接种量对α-葡萄糖苷酶抑制率的影响 固定发酵温度37 ℃,发酵时间3 d,考察乳酸菌菌粉接种量(0.2%,0.4%,0.6%,0.8%,1.0%)对α-葡萄糖苷酶抑制率的影响。
1.2.3 发酵温度对α-葡萄糖苷酶抑制率的影响 固定乳酸菌菌粉接种量0.8%,发酵时间3 d,考察发酵温度(28,31,34,37,40 ℃)对α-葡萄糖苷酶抑制率的影响。
1.2.4 发酵时间对α-葡萄糖苷酶抑制率的影响 固定乳酸菌接种量0.8%,发酵温度37 ℃,考察发酵时间(1,2,3,4,5 d)对α-葡萄糖苷酶抑制率的影响。
1.2.5 响应面优化 以乳酸菌接种量、发酵温度、发酵时间为试验因素,应用Design-Expert 8.06软件中Box-Behnken设计三因素三水平的响应面试验,根据试验结果确定乳酸菌发酵茶花粉的最适工艺条件。
1.2.6α-葡萄糖苷酶抑制率的测定 参照Qi等[19]的方法。按式(1)计算α-葡萄糖苷酶抑制率。
(1)
式中:
R——α-葡萄糖苷酶抑制率,%;
a——样品组吸光度值;
b——样品空白组吸光度值;
c——对照组吸光度值;
d——空白组吸光度值。
1.3 数据处理
采用Excel软件制图,采用SPSS 19.0软件对数据进行显著性检验(P<0.05)。采用Design Expert 8.0.6软件进行响应面试验设计和结果分析,所有试验平行3次。
2 结果与分析
2.1 乳酸菌接种量对α-葡萄糖苷酶抑制率的影响
由图1可知,随着乳酸菌接种量的增加,茶花粉发酵液对α-葡萄糖苷酶的抑制率先增大后减小,并在添加量接近0.8%时达最高。当乳酸菌接种量为1.0%时,抑制率显著降低,是由于发酵体系中的葡萄糖等营养物质不足以提供乳酸菌生长所需要的能量,导致乳酸菌生长变慢。因此,乳酸菌适宜接种量确定为0.8%左右。

字母不同表示差异显著(P<0.05)
2.2 发酵温度对α-葡萄糖苷酶抑制率的影响
由图2可知,随着发酵温度的升高,茶花粉发酵液对α-葡萄糖苷酶的抑制率呈先上升后下降的趋势,当发酵温度为37 ℃时,抑制率高达35.28%。因此,适宜发酵温度为37 ℃左右。

字母不同表示差异显著(P<0.05)
2.3 发酵时间对α-葡萄糖苷酶抑制率的影响
由图3可知,茶花粉发酵液对α-葡萄糖苷酶的抑制率随发酵时间的增加先升高后下降。发酵第3天的抑制率最高(为36.61%),比未发酵的提高了92.48%。当发酵时间>3 d时,抑制率随发酵时间的增加而逐渐降低,与韩瑨等[20]的结果相似,因此适宜的发酵时间为3 d左右。

字母不同表示差异显著(P<0.05)
2.4 响应面优化试验
根据单因素试验结果,以乳酸菌接种量、发酵温度和发酵时间为响应因素,进一步采用Design Expert 8.0.6软件中的Box-Behnken设计,以α-葡萄糖苷酶抑制率作为响应值,对乳酸菌发酵茶花粉工艺进行优化。响应面试验因素和水平见表1,试验设计及结果见表2。

表1 响应面试验因素和水平

表2 响应面试验设计及结果
采用Box-Behnken设计多元回归拟合得到α-葡萄糖苷酶抑制率(Y)与各因素的回归方程为:
Y=38.46+3.56A+2.40B+2.38C+1.22AB+5.10AC-1.84BC-4.23A2-10.28B2-9.38C2。
(2)
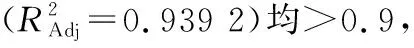
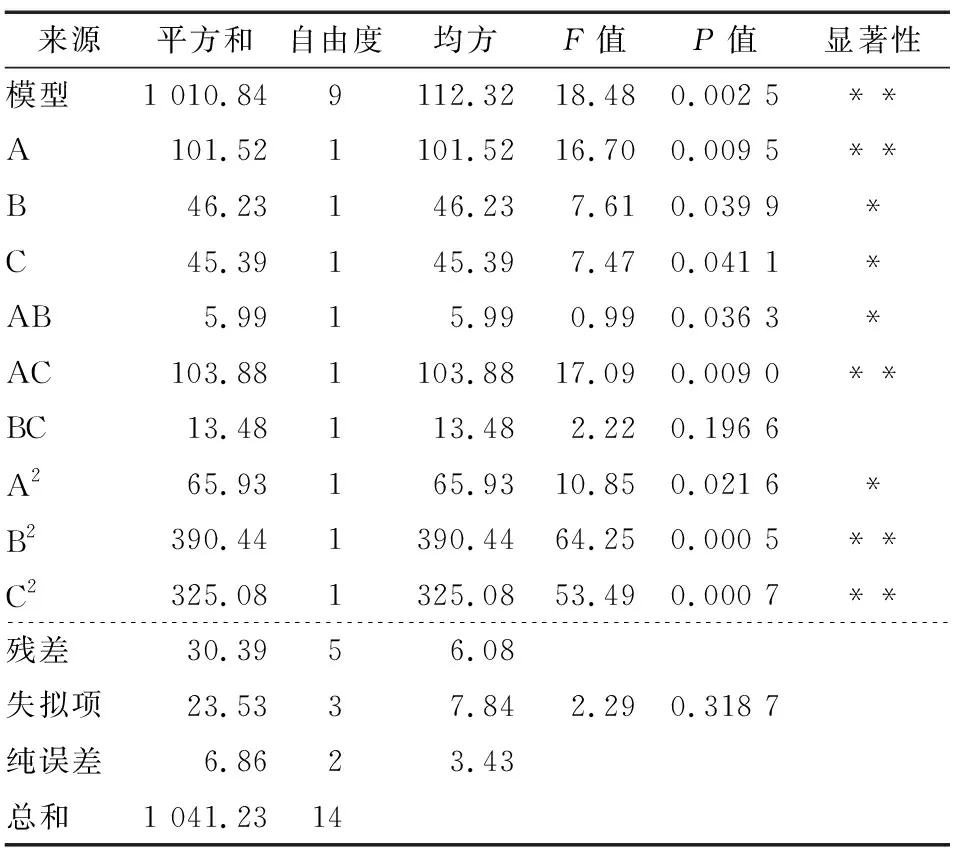
表3 方差分析结果†
由图4可知,各响应曲面向下且顶点均在试验水平范围之内,说明α-葡萄糖苷酶抑制率最强的优化条件在试验的水平范围内。所有响应面图皆呈凸面体,表明各因素水平的选择范围较合理,且乳酸菌接种量、发酵温度和发酵时间对α-葡萄糖苷酶的抑制作用均呈先增大后减小的趋势。其中,乳酸菌接种量对应的变化曲面较发酵温度的更陡峭,说明乳酸菌接种量比发酵温度对抑制率的影响更显著。乳酸菌接种量对应的变化曲面比发酵时间对应的更陡峭,说明乳酸菌接种量比发酵时间对抑制率的影响更显著。发酵温度的变化曲面比发酵时间的更陡峭,说明发酵温度相较于发酵时间对抑制率的影响更显著。

图4 各因素交互作用对抑制率的影响
乳酸菌接种量与发酵温度的交互作用显著(P<0.05),两因素间存在促进作用;乳酸菌接种量与发酵时间的交互作用极显著(P< 0.01);发酵时间与发酵温度的等高线图接近于圆形,表明这两个因素的交互作用对抑制率影响不显著,两因素间无明显促进作用,与方差分析结果相符。
2.5 最佳发酵工艺的确定及验证
利用Design-Expert 8.0.6软件分析优化得到最佳条件为乳酸菌接种量0.92%、发酵温度37.38 ℃,发酵时间3.28 d,α-葡萄糖苷酶抑制率预测值为40.03%。为满足实际操作条件,选取最适发酵工艺为乳酸菌添加量为0.9%,发酵温度37 ℃,发酵时间3 d,此时茶花粉发酵液对α-葡萄糖苷酶的抑制率为38.97%(n=3),是未发酵茶花粉的3.11倍,与预测值误差较小,说明以Box-Behnken试验方案优化所得的发酵工艺参数具有较高的可靠性。Sha等[23]研究发现,与对照组相比,发酵蜂花粉组酚类化合物含量增加了9.3%。Zhang等[24-25]研究表明发酵提高了蜂花粉中酚类物质种类和含量,其中,具有抑制α-葡萄糖苷酶活性的根皮素含量增加了3倍。因此,优化条件下茶花粉发酵液的α-葡萄糖苷酶抑制率远大于未发酵茶花粉,可能是茶花粉发酵液中对α-葡萄糖苷酶具有抑制作用的物质大量积累所致,但对于影响α-葡萄糖苷酶抑制率的物质需进一步研究和鉴定。
3 结论
试验表明,乳酸菌接种量对α-葡萄糖苷酶抑制率影响最大,其次是发酵温度。发酵茶花粉的最优工艺条件为乳酸菌接种量0.9%、发酵温度37 ℃,发酵时间3 d,该条件下茶花粉发酵液对α-葡萄糖苷酶的抑制率为38.97%,是未发酵茶花粉的3.11倍。后续可对乳酸菌发酵茶花粉引起α-葡萄糖苷酶抑制活性增强的具体物质进行探索。
