酒精性心肌病大鼠模型中凝集素样氧化低密度脂蛋白受体-1表达与细胞凋亡相关蛋白Bax、Cleaved caspase-3表达关系研究
2022-10-21张瑞琦张一凡冯占斌
芦 兰,王 鑫,张瑞琦,赵 伟,袁 博,张一凡,冯占斌
(1.西安医学院,陕西 西安 710021;2.西安市第九医院,陕西 西安 710054)
长期过量饮酒会对心脏造成严重损害,酒精是最重要的损伤因子,在体内可以分解为乙醛和脂肪酸乙酯等毒性产物,并通过激活多种信号转导通路改变心肌细胞的功能,引起心肌代谢和组织学异常,最终导致心肌肥大、心脏扩大、心肌纤维化、心肌细胞凋亡、心功能下降等一系列改变,临床上称之为酒精性心肌病(Alcohol cardiomyopathy,ACM)[1]。ACM的病理生理学改变涉及心肌细胞凋亡和心肌细胞功能变化等多方面因素,是导致非缺血性扩张型心肌病的主要原因,其特点是左心室舒张期内径(LVEDD)增加和左心室射血分数(LVEF)降低[2]。有研究发现:ACM患者的心肌组织中可见大量的凋亡细胞,ACM动物细胞模型中也同样检测到了Bax、Cleaved caspase-3等细胞凋亡标志物升高的现象,提示酒精与细胞凋亡密切相关[3-5],凋亡是导致ACM发病的主要因素之一[6]。
凝集素样氧化低密度脂蛋白受体-1(Lectin-like oxidized low-density lipoprotein receptor-1,LOX-1)是氧化低密度脂蛋白(Oxidized low-density lipoprotein,OxLDL)的清道夫受体之一[7],它的表达受多种促炎性细胞因子、氧化应激反应和机械刺激等因素调控[8],与心肌缺血损伤后的炎症反应和心脏重构有关。LOX-1已被证实在心血管疾病中起重要作用,如动脉粥样硬化等。研究表明,心肌缺血后LOX-1的表达量增多,促进心肌细胞的凋亡、局部炎症和成纤维细胞的活化,最终导致心肌功能的丧失[9]。LOX-1在ACM中的表达如何以及是否诱发细胞凋亡目前国内外报道较少。本研究计划建立ACM大鼠模型,并通过外源性shRNA干预,观察LOX-1和细胞凋亡相关蛋白Bax、Cleaved caspase-3的表达量变化,旨在探讨LOX-1与酒精诱导心肌细胞凋亡的关系,为ACM的防治提供新的研究思路和方法。
1 材料和方法
1.1 实验动物与分组 该研究得到了西安市第九医院动物护理委员会的批准,并遵守了美国国立卫生研究院(National Institutes of Health,NIH)的指导方针。选取2周龄的健康雄性SD大鼠(麟美生物,中国)9只,体重200~250 g,随机分为三组,正常对照组(n=3)、ACM组(n=3)和ACM+shLOX-1组(n=3)。所有大鼠均置于45 ℃和50%湿度的环境中,正常饮食,在12 h光/暗循环下自由活动。正常对照组:正常饲养16周不做干预处理;ACM组:第1周,50%的乙醇[6 ml/(kg·d)],每天灌胃1次,且自由获取5%的乙醇(用来替代水);第2周,50%的乙醇[8 ml/(kg·d)],每天灌胃1次,且自由获取10%的乙醇(用来替代水);第3周,50%的乙醇[10 ml/(kg·d)],每天灌胃1次,且自由获取20%的乙醇(用来替代水);第4~16周,50%的乙醇[12 ml/(kg·d)],每天灌胃2次,且自由获取20%的乙醇(用来替代水),诱发ACM,建立ACM大鼠模型(心脏彩超示模型组较正常组心腔扩大、心肌变薄视为ACM模型成功);ACM+shRNA组:相同方法诱发ACM,并在体内尾静脉注射预先设计的腺病毒相关的shRNA进行LOX-1沉默抑制LOX-1的表达。16周后,将各组大鼠处死,取出心脏标本,测定分析相关指标。
1.2 qRT-PCR 使用TRIzol试剂(Invitrogen,美国)从大鼠心肌组织匀浆液中分离总RNA。提取总RAN后,琼脂糖凝胶电泳检测RNA完整性;NanoQuant酶标仪(TECAN,瑞士)检测RNA纯度,RNA纯度=OD260/OD280,该比值应在1.8~2.0之间。按照SuperScript Ⅲ RT反转录试剂盒(ABI-invitrogen,美国)说明制备20 μl反应体系,使用StepOne Software荧光定量PCR仪(Applied biosystems,美国)进行反转录,反应条件:65 ℃ 5 min;85 ℃ 10 min。使用Step One Software荧光定量PCR仪(Applied biosystems,美国)按照superscript Ⅲ逆转录试剂盒(ABI-invitrogen,美国)制备反应体系,反应条件:95 ℃ 5 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 20 s 40个循环。各因子引物如表1,采用2-ΔΔCt方法计算相对表达量。

表1 qRT-PCR引物序列
1.3 Western blot 收集样品,用PBS在冰浴中以最大功率超声破碎细胞(3×10 s),使其在4 ℃下12000 r/min离心15 min,收集上清液,采用BCA蛋白定量法测定蛋白浓测量蛋白浓度。离心物的等分物在SDS聚丙烯酰胺凝胶上电泳,然后将分离的蛋白质转移到 PVDF膜(默克,美国)。随后使用抗LOX-1(1∶1000,ab60178)、Bax(1∶1000,ab32503)、Cleaved caspase-3(1∶1000,ab184787)的一抗,在4 ℃下处理12 h。用TBST(索莱宝,中国)冲洗后,加入二次HRP偶联的抗体,孵育1 h。接下来,在TBST洗涤后,使用 DAB试剂盒(索莱宝,中国)观察条带。通过 ImageJ1.53f(NIH,美国)获得蛋白的相对表达水平。
1.4 统计学方法 用Graphpad Prism 8.3.0(Graphpad LLC,美国)进行分析和绘图。数据均采用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析;相关性分析采用Pearson检验;P<0.05为差异具有统计学意义。
2 结 果
2.1 各组LOX-1及凋亡相关蛋白Bax、Cleaved caspase-3 mRNA表达量分析 通过qRT-PCR检测各组心肌细胞凋亡相关蛋白mRNA表达情况显示:ACM组LOX-1、Bax、Cleaved caspase-3 mRNA表达量明显高于Blank组[(1.51±0.02)与(0.97±0.03)、(2.21±0.08)与(1.05±0.04)、(2.10±0.09)与(1.07±0.09),均P<0.0.1)];ACM+shRNA组LOX-1、Bax、Cleaved caspase-3表达量明显低于ACM组[(0.64±0.01)与(1.51±0.02)、(1.63±0.02)与(2.21±0.08)、(1.58±0.01)与(2.10±0.09),P<0.01],见图1。
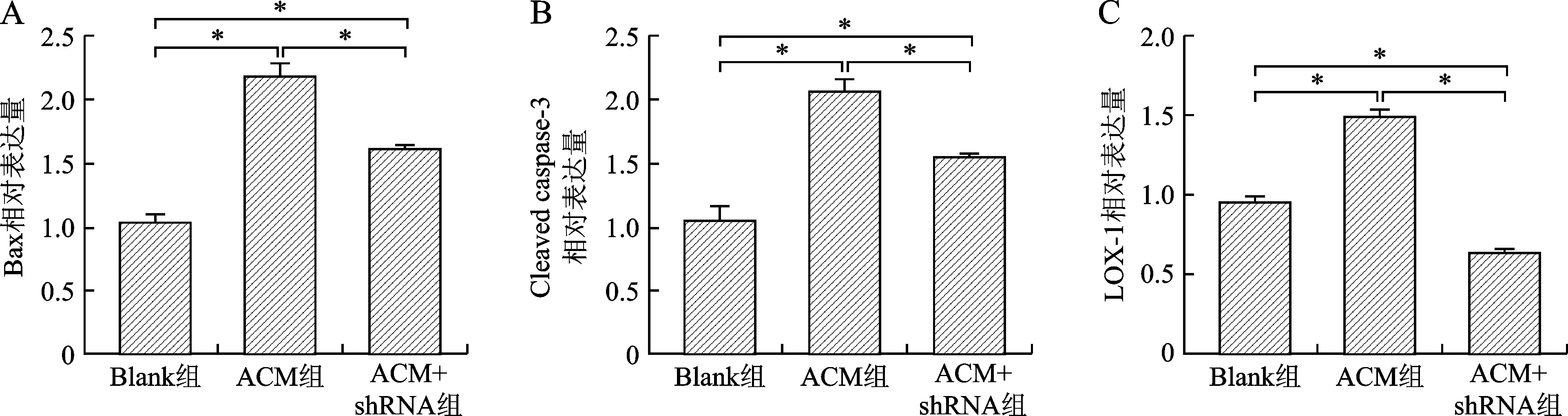
A:Bax mRNA表达量对比;B:Cleaved caspase-3 mRNA表达量对比;C:LOX-1 mRNA表达量对比。Blank组:空白对照组;ACM组:酒精性心肌病组;ACM+shRNA组:shRNA抑制LOX-1表达的酒精性心肌病组。*P<0.01
2.2 LOX-1及凋亡相关蛋白Bax、Cleaved caspase-3 蛋白表达量分析 通过Western blot检测各组心肌细胞凋亡蛋白表达情况显示:ACM组LOX-1、Bax、Cleaved caspase-3蛋白表达量明显高于Blank组[(0.99±0.02)与(0.89±0.02)、(0.61±0.01)与(0.30±0.01)、(0.61±0.01)与(0.20±0.01),均P<0.01];ACM+shRNA组LOX-1、Bax、Cleaved caspase-3蛋白表达量明显低于ACM组[(0.57±0.14)与(0.99±0.02)、(0.45±0.03)与(0.61±0.01)、(0.42±0.01)与(0.61±0.01),均P<0.01],上述指标提示蛋白检测结果与mRNA检测结果具有相同的趋势,见图2。
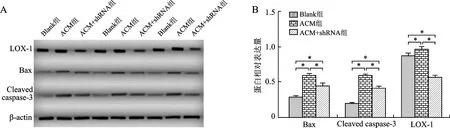
A:各组大鼠Western blot蛋白印迹图;B:各组大鼠LOX-1、Bax、Cleaved caspase-3 的蛋白表达量对比。Blank组:空白对照组;ACM组:酒精性心肌病组;ACM+shRNA组:shRNA抑制LOX-1表达的酒精性心肌病组。*P<0.01
2.3 LOX-1与凋亡相关蛋白Bax、Cleaved caspase-3相关性分析 使用Pearson检验对LOX-1与凋亡相关蛋白Bax、Cleaved caspase-3进行相关性分析结果显示,在ACM大鼠模型中 LOX-1与心肌凋亡相关蛋白Bax、Cleaved caspase-3呈正相关(r=0.323,P=0.080;r=0.370,P=0.082),见图3。
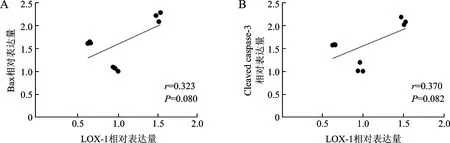
注:P>0.05表示相关性太弱。相关系数r在0.8~1.0之间是极强相关;0.6~0.8之间是强相关;0.4~0.6 之间是中等程度相关;0.2~0.4之间是弱相关;0.0~0.2则是极弱相关或无相关
3 讨 论
ACM是以酒精剂量依赖性的方式逐步进展的,过量饮酒是导致左心功能障碍的主要原因之一,酒精的毒性作用可导致心力衰竭、心脏传导阻滞、心房颤动、心肌重构、心脏代谢和功能异常[10]。目前,关于ACM的研究多集中在氧化应激、细胞器功能障碍、钙稳态失衡、细胞死亡、蛋白代谢异常、神经体液系统紊乱、炎症、基因改变、营养失衡及自噬等方面[11],其具体发病机制尚未完全明确。有研究提出酒精可抑制蛋白质的合成,诱导炎症和心肌细胞凋亡,且凋亡诱导的心脏组织的丢失是导致酗酒者射血分数和舒张末期升高的原因[5]。此外,这种凋亡导致的组织丢失也会引起心室壁变薄和心室扩张,最终导致心力衰竭发生[12]。酒精分解产生的乙醛被认为是导致组织和细胞毒性的主要物质,其毒性比乙醇更强,能显著抑制心肌蛋白质合成,损伤心肌收缩功能,破坏心肌兴奋-收缩偶联,导致氧化损伤和脂质过氧化反应[12]。因此,乙醛是导致酒精性心肌病最重要的物质,大量摄入酒精可诱导心肌细胞线粒体凋亡,并刺激氧化应激反应,提示酒精诱导的心肌细胞凋亡可能是由活性氧(ROS)信号通路介导的[13]。乙醛能够诱导ROS产生增加,激活ERK1/2、SPAK/JNK和P38 MAPK,进而导致细胞凋亡[14-15]。
1972年Kerr最先提出细胞凋亡的概念,它是细胞死亡的形式之一,是细胞的一种主动程序性死亡,与各种基因的激活存在密切关联[16]。细胞凋亡有时也被称为程序性细胞死亡(或更通俗地说是“细胞自杀”),细胞凋亡的启动依赖于一系列半胱氨酸-半胱氨酸天冬氨酸蛋白酶的激活[17]。caspase家族是在细胞凋亡发挥关键作用的一组半胱氨酸蛋白酶,其中Cleaved caspase-3在凋亡级联反应中处于核心地位[8]。Cleaved caspase-3可引起DNA损伤修复酶降解,与此同时激活核酸内切酶,从而引起细胞凋亡[18]。另外,Ge等[19]发现,长期大量摄入酒精会导致Cleaved caspase-3活性增高,并促进细胞凋亡。引起细胞凋亡的另一个因素是Bcl-2蛋白家族,包括抗凋亡蛋白(如 Bcl-2、Bcl-xL、Bcl-w等)和促凋亡蛋白(如 Bax、Bad、Bak、Bid和 Bcl-xs等),其中促凋亡蛋白Bax水平的高低与细胞凋亡调控直接相关,即Bax促进细胞凋亡[20]。这些研究结果均表明Bax、Cleaved caspase-3与细胞凋亡有明显的关系。
LOX-1是最早被鉴定为引起血管内皮细胞摄取ox-LDL的受体之一,随后在心肌细胞、巨噬细胞、平滑肌细胞、动脉粥样硬化斑块、血小板中也发现了LOX-1的存在,提示LOX-1在体内可能有多种功能。在正常生理情况下,LOX-1的表达较低,主要功能是参与ox-LDL的结合、内吞和蛋白降解,但在高血压(血管紧张素Ⅱ、内皮素-1)、糖尿病(葡萄糖)、缺氧和机械应激(剪切应力)等病理状态下却呈现出表达上调的现象。此外,LOX-1的激活与许多病理生理过程有关,包括内皮细胞和血管平滑肌细胞增殖、细胞周期信号改变及细胞凋亡等,但LOX-1介导细胞凋亡的机制,国内外报道甚少。
本研究通过构建ACM模型,并给予外源性shRNA干预从基因以及蛋白水平检测凋亡相关蛋白Bax、Cleaved caspase-3的表达量,研究发现:ACM组凋亡相关蛋白Bax、Cleaved caspase-3表达量明显升高,提示ACM大鼠存在心肌细胞凋亡情况;我们进一步通过shRNA抑制LOX-1表达后发现:LOX-1在ACM+shRNA组表达降低,而在qRT-PCR检测结果中,凋亡相关蛋白Bax、Cleaved caspase-3也出现协同性降低现象,提示LOX-1可能通过正向调节凋亡相关蛋白Bax、Cleaved caspase-3的表达参与酒精诱导心肌细胞凋亡的发展过程。Pearson检验结果提示:随着自变量LOX-1的增大,相关变量Bax、Cleaved caspase-3也会随之变化,且r值表明两变量存在正相关关系,但该现象缺乏统计学意义,可能与样本数量较少有关,难免存在统计学偏倚,在后续的研究中会进一步扩大样本量进一步验证现有结论。
综上所述,本研究结果发现:ACM模型中LOX-1及凋亡相关蛋白Bax、Cleaved caspase-3表达明显升高,且LOX-1与凋亡相关蛋白Bax、Cleaved caspase-3成正相关。推测LOX-1可能通过对凋亡相关蛋白Bax、Cleaved caspase-3的正向调节参与酒精诱导心肌细胞凋亡的发生发展过程。
