靶向T 细胞发育药物研究进展
2022-10-21陈红胡洪波
陈红,胡洪波*
(1. 四川大学华西医院免疫和血液中心,四川 成都 610041;2. 四川大学华西医院生物治疗国家重点实验室,四川 成都 610041)
T 细胞具有识别多种抗原和监测恶性肿瘤的能力。然而,内部和外部环境的影响,如衰老、感染、化疗和放射治疗等,将导致胸腺损伤和退化,进而引起初始T 细胞的输出量下降。胸腺退化导致机体对机会性感染、肿瘤和自身免疫性疾病的易感性增加。因此,胸腺再生机制将针对这些方面提供新的治疗选择。
1 T 细胞发育简介
胸腺是T 细胞发育的场所,在适应性免疫和中枢耐受中起着至关重要的作用。来自胚胎肝脏或骨髓的T 细胞前体细胞经血液循环迁入胸腺,这些细胞被称为胸腺定植祖细胞(thymus seeding progenitor,TSP)。TSP 从胸腺皮质-髓质交界处的大血管中进入胸腺后,发育为早期胸腺祖细胞(early thymic progenitor,ETP)[1]。根据分化抗原簇(cluster of differentiation,CD) 中CD4 和CD8 的 表 达,ETP 发育为成熟的T 细胞将经历3 个阶段,按照发育顺序依次是CD4-CD8-双阴性(double-negative,DN)细胞、CD4+CD8+双阳性(double-positive,DP)细胞以及CD4+或CD8+单阳性(single-positive,SP)细胞。小鼠DN 期的胸腺细胞可根据CD44 和CD25 的表达分为不同的群体,按照发育的先后顺序 分 别 是DN1(CD44+CD25-),DN2(CD44+CD25+),DN3(CD44-CD25+) 和DN4(CD44-CD25-)细胞[2-3]。
T 细胞发育是一个精细调控的过程,依赖胸腺特殊的微环境。胸腺上皮细胞(thymic epithelial cell,TEC)以及其他胸腺基质细胞分泌细胞因子,如干细胞因子(stem cell factor,SCF)和白细胞介素-7(interleukin-7,IL-7)等,并表达Notch 配体DLL4(Notch ligand delta-like ligand 4,DLL4) 以及主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类、Ⅱ类分子,支持胸腺细胞的生存、增殖、分化以及选择等[4-6]。在小鼠DN2或DN3 细胞发育阶段,Tcrd,Tcrg和Tcrb等T 细胞受体(T cell receptor,TCR)基因开始重排,根据TCR 基因类型,表达γδTCR 的细胞发育为γδT细胞[7-8]。重排成功的TCRβ 链与pre-Tα 链组成pre-TCR,pre-TCR 为胸腺细胞提供生存、增殖以及等位排斥的信号,这个过程被称为β-选择[9-10]。顺利通过β-选择的胸腺细胞大量增殖,发育为DN4 细胞,随后CD8 表达上调,被称为不成熟的单阳性细胞(CD4-CD8+TCRαβ-)[11-12]。随后进入CD4+CD8+DP细胞发育阶段,TCRα 链开始重排,并与TCR 链形成αβTCR。TCRαβ+DP 细胞在皮质胸腺上皮细胞(cortical thymic epithelial cell,cTEC)的作用下经历阳性选择,不能识别自身抗原肽-MHC 的DP 细胞被清除[13-14]。通过阳性选择的DP 细胞迁移到胸腺髓质区,自身反应性的TCR 以高亲和力识别来自由髓质胸腺上皮细胞和树突状细胞表达的自身抗原肽-MHC,导致其死亡而被清除,该过程被称为阴性选择[7,15]。虽然大部分自身反应性的T 细胞会在阴性选择中死亡,但一部分自身反应性的T 细胞可以存活,分化成为非经典的T 细胞,这种选择被称为激动选择[16-17]。激动选择后的非经典T 细胞主要可分为3 类,分别是FOXP3+调节性T 细胞(regulatory cell,Treg)、自然杀伤性T 细胞(natural killer T cell,NKT)和TCRαβ+CD8αα+T 细胞[16,18]。不识别自身抗原肽的T 细胞进一步分化为成熟的CD4+或CD8+SP 细胞,迁移到外周行使免疫功能。
2 胸腺器官发育和萎缩
人类胸腺器官于胚胎时期发育成熟,妊娠期12 ~ 13周即可检测到胸腺中CD4+和CD8+SP T细胞,第16 周胸腺功能发育成熟,第24 周可在外周淋巴器官检测到成熟T 细胞[19]。在青春期之后,人类胸腺发生明显的萎缩。在衰老过程中,TEC 数量减少,胸腺逐渐纤维化、脂肪化[20];共同淋巴祖细胞和ETP 数量随着年龄的增长而显著减少,ETP 的增殖能力降低,凋亡率增加[21];TEC 分泌的白血病抑制因子、抑制素、SCF 和IL-6 等含量增加,在小鼠中的研究证实这些细胞因子作用于胸腺萎缩[22];而胸腺内生长激素(growth hormone,GH)和胰岛素样生长因子(insulin-like growth factor,IGF)含量降低。此外,随着年龄变化的性激素(雌激素和雄激素)、促黄体激素释放激素(luteinizing hormone-releasing hormone,LHRH)水平等都是影响胸腺退化的内在因素[23]。不仅如此,压力、急性和慢性感染或针对癌症的放化疗等都将导致或加速胸腺萎缩[24]。
胸腺萎缩导致T 细胞发育减退,数学模型推测胸腺T 细胞输出随年龄增加呈指数级下降,半衰期为15.7 年;到55 岁时,只有5%的初始T 细胞来自胸腺[25]。初始T 细胞的平均T 细胞受体切除环含量被用来评估胸腺T 细胞的产出[26]。研究表明,健康成人中高达90%的初始T 细胞是通过T 细胞稳态增殖产生的,可存活5 ~ 10 年[27]。而人和小鼠在此方面存在巨大差异,小鼠的初始T 细胞仅存活6 ~ 10周,成年和老年小鼠初始T 细胞库几乎完全由胸腺产生的新近胸腺迁出细胞(recent thymic emigrant,RTE)维持[27]。因此,在衰老过程中,胸腺功能受损导致RTE 输出减少、记忆T 细胞的寡克隆扩增、外周TCR 库多样性降低、对新抗原的反应性降低,这些现象在60 岁以上的人群中尤为明显[28-29]。胸腺初始T 细胞产出降低导致的免疫功能衰退是传染病和癌症发病率随着年龄增加的主要原因[24]。在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)大流行期间,高龄(65 岁以上)被确定为发病和死亡的危险因素[30]。胸腺萎缩显著损害免疫损伤后的重建和恢复,导致接受化疗的癌症病人恢复时间延长。造血干细胞移植(hematopoietic stem cell transplantation,HCT)是治疗多种恶性血液疾病的常用方式,但移植后免疫功能缺陷,特别是T 细胞重建不足,与机会性感染、复发和死亡的风险增加直接相关[31]。
鉴于胸腺功能的动态变化特性及其对TCR 库多样性的产生和维持的重要性,临床上急需可以恢复T 细胞再生来增强免疫功能的策略。目前已有的策略包括利用胸腺素α1,IL-7 以及角质形成细胞生长因子(keratinocyte growth factor,KGF)等细胞因子和生长因子药物刺激T 细胞的发育和增殖;通过性类固醇消融(sex steroid ablation,SSA),GH,IGF1 调节激素水平(见图1)。本文针对恢复或增强胸腺T 细胞发育的临床药物研究进展进行了总结,将为病毒感染、癌症等治疗后的免疫重建策略提供参考。
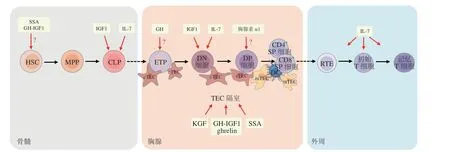
图 1 促进T 细胞发育和再生的策略Figure 1 Strategies to enhance T cell development and regeneration
3 靶向胸腺T 细胞发育的药物
3.1 多肽类药物
3.1.1 胸腺五肽 胸腺生成素Ⅱ是TEC 分泌的一种由49 个氨基酸组成的胸腺内源性多肽激素,可促进胸腺细胞的分化并增强辅助性T 细胞的功能[32]。胸腺五肽(thymopentin,TP5)是一种合成的五肽(Arg-Lys-Asp-Val-Tyr,Mw = 679.77),对应胸腺生成素Ⅱ的32 ~ 36 位氨基酸。TP5 显示出与胸腺生成素Ⅱ相似的免疫调节生物活性,用于治疗免疫缺陷疾病,如先天胸腺缺失、胸腺切除、老年胸腺萎缩性功能减退、老年慢性心力衰竭、感染、肿瘤以及自身免疫性疾病等[33]。文献报道TP5 治疗后,慢性心力衰竭患者外周血中CD4+T 细胞和NK 细胞比例增加,促炎细胞因子肿瘤坏死因子-ɑ 和IL-1β 的分泌降低[34];此外,每周3 次接受高剂量TP5 治疗的黑色素瘤皮肤和皮下转移患者中,有1/3 的患者症状得到缓解,且没有明显的副作用[35]。类风湿性关节炎是一种慢性自身免疫性疾病,研究表明,经TP5 治疗后,类风湿性关节炎患者的临床参数(肿胀关节数和压痛数)得到显著改善[36]。TP5 作为一种有效的自身免疫性疾病免疫调节剂,已在临床上使用了数十年。
TP5 的商品化形式是用于皮下或肌肉注射的冻干粉剂,药物在体内半衰期极短(小于30 s)、膜通透性差、胃肠道代谢广泛,导致重复注射和患者依从性差等[37]。鉴于此,研究人员开发了TP5 的新型药物递送系统,包括口服纳米颗粒、可吸入颗粒、聚合物纳米粒子、水凝胶、微针透皮给药、囊泡磷脂凝胶和磷脂相分离凝胶等TP5 载药方式,以期延长TP5 的免疫调节效果,提高患者的依从性[33]。
3.1.2 胸腺素α1 胸腺素α1(thymosin alpha1,Tα1)是一种由28 个氨基酸组成的小肽。胸腺法新(thymalfasin,商品名为日达仙)是Tα1 的乙酰化形式,其化学结构、空间结构和生物活性与天然的Tα1 基本一致;在不同的生理和病理条件下(感染、癌症、免疫缺陷、疫苗接种和衰老)表现出恢复免疫系统稳态的能力[38]。Tα1 是目前胸腺多肽类药物中临床应用最广泛的药物,拥有广泛的研究依据,具有高耐受性和较高的安全性[39]。
Tα1 调节胸腺细胞的分化和成熟,增加T 细胞的数量。体外研究发现Tα1 可能通过调控Notch 信号通路,促进胚胎干细胞产生T 细胞[39]。Tα1 也可以促进IL-7 的产生,增强骨髓来源的CD34+造血干细胞向T 细胞分化的能力[40]。此外,Tα1 还可以增强T 细胞CD25 和MHCⅡ类分子表达,并减少地塞米松诱导的胸腺细胞凋亡[38,41]。Tα1 在35 个国家和地区获批用于治疗乙型和丙型肝炎病毒感染[42]。2019 年以来,COVID-19 严重威胁着全球公共安全,COVID-19 重症患者多为免疫功能低下的人群。同时,淋巴细胞减少症(血液中淋巴细胞数量的减少)和细胞因子风暴也与COVID-19 的严重程度有关。Tα1 可在急性、慢性感染中发挥作用并可有效促进T 细胞产生,被应用于COVID-19 治疗[43]。临床研究表明Tα1 可增强免疫功能,增加胸腺RTE 的数量,增加重症和危重症患者的淋巴细胞数量,逆转CD8+T 细胞耗竭,并显著降低COVID-19 重症患者死亡率[44]。
3.2 细胞因子和生长因子
3.2.1 白细胞介素-7 IL-7 是由IL7基因编码的相对分子质量达25 000 的可溶性球状蛋白。IL-7 及其受体IL-7R 在T 细胞和小鼠B 细胞的发育、初始T 细胞的分化和存活以及记忆T 细胞的产生和维持中起着关键作用[45]。此外,IL-7 对于固有淋巴细胞的发育和维持同样至关重要[46]。IL-7 主要由基质细胞产生,在胸腺和淋巴结等淋巴器官以及肠、肺、肝和皮肤等非淋巴器官中高表达[47]。IL-7 信号由IL-7R转导,IL-7R 是IL-7Rα(由IL7R基因编码)和常见细胞因子受体γ 链(由IL2RG基因编码)组成的异二聚体复合物。淋系祖细胞、胸腺细胞和成熟的T细胞表达IL-7R[48]。IL-7R 通过Janus 激酶 (Janus kinase,JAK)/信号传导及转录激活因子(signal transducer and activator of transcription,STAT) 和磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信号通路传递信号,这2 种通路对T 细胞存活、生长和代谢都有影响[49]。缺乏IL-7 或IL-7Rα 致使T细胞和B 细胞发育受阻,表现出严重免疫缺陷和淋巴细胞减少[50]。此外,IL-7/IL-7R 信号传导与自身免疫性疾病、慢性炎症性疾病以及癌症有关[51-52]。
IL-7 可通过诱导T 细胞前体细胞和胸腺细胞增殖促进胸腺再生[53]。文献报道IL-7 治疗可增加胸腺初始T 细胞输出并促进外周T 细胞增殖[54-55]。此外,IL-7 耐受性良好,并以剂量依赖性方式增加病毒感染[例如人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染、乙型肝炎和丙型肝炎]、癌症和罕见疾病(如进行性多灶性白质脑病和特发性CD4 淋巴细胞减少症)患者的T 细胞数量,具有显著的免疫增强作用[50,56]。
细胞因子在体内的半衰期较短,因此,稳定长效的新型IL-7 制剂一直是未满足的医疗需求。糖基化IL-7(如CYT107)以及融合蛋白hIL-7-hyFc(与IgD/IgG4 免疫球蛋白结构域杂交的同源二聚体IL-7)目前正开展多项临床试验(见表1)[57]。

表 1 正在开展临床试验的IL-7/IL-7R 药物Table1 IL-7/IL-7R-related drugs in clinical trials

续表1
3.2.2 角质形成细胞生长因子 KGF 是一种天然存在的蛋白质。作为上皮细胞特异性生长因子,它参与刺激皮肤和肠道内层细胞的生长,帮助修复损伤并维持其结构[62]。2004 年,帕利夫明(palifermin,商品名:Kepivance)获得许可,用于预防化疗引起的黏膜炎[63]。KGF 可通过与其受体FGFR2IIIb 结合,激活PI3K/Akt 信号通路,从而促进TEC 增殖[62]。研究表明敲除Kgf的小鼠接受骨髓移植后,胸腺T 细胞发育以及外周T 细胞重建受损[64-65]。文献报道KGF 治疗14 天后,老年小鼠胸腺DP 细胞和CD4+SP 细胞数量相较于PBS 处理组显著增加,脾脏中CD3+T 细胞、CD4+T 细胞和CD8+T 细胞数量同样显著增加。这些研究提示KGF 可能有助于恢复移植和衰老导致的胸腺T 细胞分化减少[64]。然而,在对经历过抗CD52 抗体(anti-CD52 mAb,alemtuzumab)治疗后的多发性硬化症患者进行的试验中,KGF 对胸腺T 细胞发育有不利影响[66]。目前已经启动了多项探究KGF 对胸腺重建影响的临床试验(NCT01233921,NCT03042585,NCT02356159和NCT00593554)。
3.3 激素
3.3.1 性类固醇消融 性类固醇,尤其是睾酮的水平,与年龄相关的T 淋巴细胞、B 淋巴细胞以及淋系前体细胞的减少有关[67]。性类固醇消融(sex steroid ablation,SSA)已被用于增强胸腺功能[68]。SSA可通过诱导趋化因子C-C 基序配体25(C-C motif chemokine ligand 25,CCL25)和 Notch 配体(Notch ligand delta-like ligand 4, DLL4)的 表 达,促 进TSP 进入胸腺;同时,通过诱导Notch 配体DLL4的表达,促进胸腺细胞分化,增加初始T 细胞的输出[67,69-70]。另外,SSA 对骨髓微环境有直接的影响,可逆转衰老导致的关键造血因子Foxo1 的表达下调,促进造血干细胞的自我更新,并增强造血干/祖细胞的淋系分化潜能[71]。
LHRH 由下丘脑产生,并以脉动方式释放。LHRH 作用于垂体并控制黄体生成素激素和促卵泡激素的释放。当LHRH 以足够高的水平连续释放时,起初将引起睾酮水平激增,导致LHRH 受体脱敏,抑制黄体生成激素和促卵泡激素的产生,从而使睾酮达到去势水平[72]。LHRH 激动剂是一种LHRH 的合成类似物。常用的LHRH 激动剂包括戈舍瑞林(goserelin,商品名:诺雷德,Zoladex)、亮丙瑞林(leuprorelin,商品名:抑那通,Enantone)和曲普瑞林(triptorelin,商品名:达菲林,Depherelin),均为皮下注射,每4 周1 次[73]。
临床上使用的瞬时和可逆阻断性类固醇,用于治疗性早熟、子宫内膜异位症、激素敏感性前列腺癌和乳腺癌[74]。同时,这些性类固醇阻断剂被用于HCT 后的免疫重建。戈舍瑞林(Zoladex)可显著增加接受HCT 治疗的患者外周中性粒细胞和总淋巴细胞数量,尤其是初始CD4+T 细胞数量[71]。目前有2项临床试验正处于招募阶段,以评估LHRH 激动剂亮丙瑞林(NCT01746849)或LHRH 拮抗剂地加瑞克(Firmagon,NCT01338987)对改善HCT 后促进胸腺重建的作用。值得注意的是,最新的雄激素受体抑制剂和LHRH 拮抗剂具有立即阻断性类固醇的优势,而不会像LHRH 激动剂那样出现雄激素的初始激增。这些新方法为抑制性类固醇和介导免疫重建提供了更好的治疗方式[67]。
3.3.2 生长激素 GH 是一种对于免疫系统有着重要作用的激素,主要由垂体前叶的生长激素细胞合成和分泌,GH 水平随着年龄的增长而降低[75]。IGF-1是GH 的主要效应分子,由肝脏、骨骼肌等组织响应GH 刺激产生,IGF-1 调节TSP 定植胸腺、胸腺细胞的发育和迁移等过程[76]。GH 和IGF-1 影响多种细胞的增殖,如成纤维细胞、脂肪细胞和多种免疫细胞等。随着年龄的增长,GH/IGF-1 轴的活性下降可能导致机体体质量减少和脂肪组织质量增加,如胸腺在衰老过程中逐渐脂肪化[77-78]。GH 可用于增强老年人多个器官的完整性和功能[76-77]。GH 或IGF-1 可以逆转胸腺萎缩并增强骨髓中造血祖细胞的功能[76]。此外,促生长激素释放素(ghrelin)可显著逆转老年小鼠的胸腺萎缩,表现为更清晰的皮质和髓质区域分界、胸腺中脂肪细胞减少而TEC 数量增加,胸腺ETP 数量、外周RTE 数量及TCR 多样性增加等[79]。
一项针对51 岁至65 岁的志愿者开展的Ⅰ期临床研究评估了GH 在逆转免疫系统衰退中的作用。胸腺磁共振成像显示,在9 名接受治疗的参与者中,有7 名参与者胸腺中的脂肪组织被再生胸腺组织取代,外周中初始CD4+T细胞和CD8+T细胞显著增加,同时PD1+CD8+T 细胞减少[80]。GH 或IGF-1 可用于治疗HIV 感染、接受移植后和衰老等造成的免疫功能受损[77]。但GH 也有许多副作用,可能出现关节疼痛和神经压迫引起的疼痛,以及患糖尿病或癌症风险增加等,阻碍了GH 作为潜在治疗药物的长期使用。
4 结语
目前,临床上已有多种药物用于HIV 感染、HCT 后的免疫重建,这些药物多是从增加胸腺中T细胞前体细胞数量、促进胸腺细胞发育和改善胸腺微环境等角度进行开发。TP5 和Tα1 在体外被证实具有促进胚胎和成体干细胞向T 细胞分化和成熟的能力,具体机制还未阐释清楚;IL-7 和IGF-1 可直接作用于T 细胞前体细胞,促进其增殖并进入胸腺;同时,IL-7 和IGF-1 能够促进胸腺细胞发育和成熟。此外,IL-7 还参与T 细胞的存活、代谢及记忆细胞的产生等。SSA 主要靶向调节cTEC 上CCL25和DLL4 的表达,促进TSP 迁入胸腺并提供T 细胞发育必需的Notch 信号;KGF,GH/IGF-1 和ghrelin通过促进TEC 细胞增殖以恢复胸腺的结构和功能。
然而关于增强各种免疫缺陷环境中T 细胞再生尚无标准的方案,这些药物仍进行着多项临床试验。靶向T 细胞发育的药物开发不仅将使因多次化疗和放疗或病毒感染导致免疫系统受损的患者受益,还可用于增强肿瘤免疫治疗中的T 细胞反应。同时,提高TCR 库多样性和增加能够识别特定肿瘤抗原的T 细胞数量,可能显著改善免疫检查点阻断的临床疗效。不仅如此,逆转胸腺萎缩对于增强老年人的免疫力以及提高疫苗接种效率等方面都具有积极效果。
