cGAS-STING 信号通路相关靶向药物的研究进展
2022-10-21张颖李真王全逸王琛
张颖,李真,王全逸,王琛,2*
(1. 中国药科大学生命科学与技术学院,江苏 南京 210009;2. 中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009)
固有免疫在病原体入侵人体时首先发挥作用,是机体免疫的首道防线。当病原体突破体表屏障,侵入和扩散时,体内固有免疫细胞可直接吞噬、杀伤病原体或通过细胞表面的模式识别受体(pattern recognition receptors,PRRs)识别病原体,从而促进Ⅰ型干扰素(interferon,IFN)等炎症相关因子的表达和释放,同时树突状细胞(dendritic cell,DC)将抗原呈递至T 和B 淋巴细胞,以启动适应性免疫[1]。PRRs 不仅能够识别病原体上某些高度保守的病原相关分子模式,如肽聚糖和脂多糖(lipopolysaccharide,LPS)等,还能识别自身细胞在应激状态下或死亡时释放的损伤相关分子模式,如热休克蛋白和高迁移率族蛋白B1 等,并进一步调控机体免疫应答,刺激多种细胞因子的表达[2]。
越来越多的研究表明,环磷酸鸟苷-腺苷一磷酸合成酶-干扰素基因刺激因子(cyclic guanosine monophosphate-adenosine monophosphate synthasestimulator of interferon genes,cGAS-STING) 信 号通路是体内介导DNA 免疫应答的主要途径[3-4]。cGAS 既是生物合成酶,又是一种胞内DNA 感受器,能够识别细胞质中异常存在的双链脱氧核糖核酸(double-stranded deoxyribonucleic acid,dsDNA),催化第二信使的生成,触发STING 的活化,从而激活固有免疫[5]。当来自细菌、病毒、肿瘤细胞的外源DNA 或来自线粒体损伤、细胞凋亡的自身DNA在细胞质中积聚时,都能被cGAS 识别和结合[2]。cGAS-STING 信号通路与病原微生物感染、肿瘤、自身免疫性疾病的发生密切相关,该通路异常可能导致多种疾病的发生[6-8]。由于cGAS-STING 通路在抵御病原体感染、抗肿瘤免疫中发挥出强大的功能,近年来已引起广泛关注,成为免疫治疗中的“新星”。本文将对cGAS-STING 信号通路和该信号通路靶向药物的最新研究成果进行讨论和总结,为相关抑制剂、激动剂的研发工作提供参考。
1 cGAS-STING 通路信号转导及调控
1.1 cGAS 和STING 的结构特征
人源cGAS 肽链N 末端(N-terminal domain,NTD)通过与磷脂酰肌醇4,5-二磷酸相互作用,决 定cGAS 的 亚 细 胞 定 位;C 末 端(C-terminal domain,CTD)具有核酸转移酶活性[9]。cGASdsDNA 复合物由2 分子的cGAS 和2 分子的dsDNA组装而成,cGAS 通过CTD 结构域与dsDNA 的磷酸-脱氧核糖骨架相连[10]。同时,cGAS 上富含锌的区域与DNA 相互作用,这种离子作用促进两者之间的结合,使cGAS-dsDNA 复合物能够稳定存在[9-10]。cGAS 和dsDNA 的结合与dsDNA 序列的特异性无关,且长链dsDNA(>45 bp)更能有效地激活cGAS[11]。
人源STING(human STING,hSTING)包含1 个跨膜的N 末端区域和1 个C 末端区域,NTD 负责将STING 锚定在内质网膜及其他细胞器膜上;CTD 由二聚化结构域、配体与蛋白结合区域及C 末端结构域(C-terminal tail,CTT)组成[12]。未结合2',3'-环化鸟苷酸腺苷酸(2',3'-cyclic guanosine monophosphateadenosine monophosphate,2',3'-cGAMP) 时,STING以二聚体形式存在,2分子CTD面向胞质形成“开放”的V 型结合口袋;与2',3'-cGAMP 结合时,CTD发生构象变化,V 型二聚体采用更为紧密的“闭合”构象并形成“盖子”覆盖在cGAMP 的结合部位[13]。
1.2 cGAS-STING 信号通路
cGAS 与dsDNA 结合后被激活,其催化口袋会进行重新排列,激活的cGAS 以腺苷三磷酸(adenosine triphosphate,ATP) 和 鸟 苷 三 磷 酸(guanosine triphosphate,GTP)为底物,催化生成2',3'-cGAMP。2',3'-cGAMP 作为接收上游细胞信号并传递给下游接头蛋白的第二信使,结合STING 并使STING 蛋白构象发生变化,进而触发信号级联[14]。STING 构象的改变促使自身向高尔基体转位,随后进行翻译后修饰,分别在位于NTD 的第88 和91 位2 个半胱氨酸残基(Cys88/Cys91)处进行棕榈酰化,这有利于促进STING 寡聚化和招募TANK 结合激酶1(TANK binding kinase 1,TBK1)[15]。转录因子干扰素调节因子3(interferon regulatory factor 3,IRF3)可以调控Ⅰ型IFN 的转录,但TBK1 无法单独激活IRF3,需要STING 的协助。在TBK1 二聚体介导下,STING 的CTT 处第366 位丝氨酸残基(Ser366)发生磷酸化,使IRF3 发生磷酸化修饰而被活化,IRF3 二聚化并移动至细胞核内,驱动多种细胞因子包括Ⅰ型IFN 等的表达和分泌[16]。同时,转录因子核因子κB 也被STING 激活,进入细胞核后诱导白细胞介素6(interleukin 6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等细胞因子的基因表达[9]。cGAS-STING 信号通路见图1 所示。
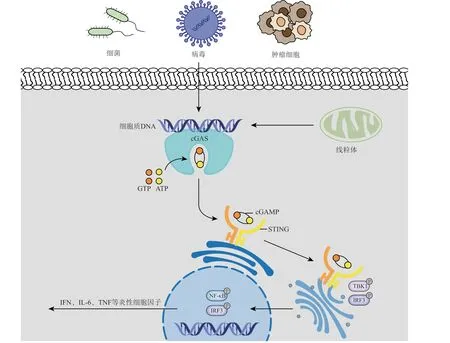
图 1 cGAS-STING 信号通路示意图Figure 1 Schematic diagram of cGAS-STING signaling pathway
一直以来,人们认为cGAS 只分布于细胞质中,但近来研究发现,cGAS 也存在于细胞核内,但核内DNA 并未激活cGAS 酶活性,刺激免疫系统应答。Michalski 等[17]通过低温电镜观察到,细胞核内cGAS 仅与染色质中的组蛋白结合,使得cGAS上的DNA 结合位点被阻挡,不能与DNA 相互作用,揭示了染色质抑制cGAS 从而阻止自身免疫反应的机制。
2 cGAS-STING 信号通路与相关疾病
侵入人体的病原体DNA 和肿瘤细胞泄露的DNA,被细胞质中的DNA 感受器cGAS 迅速识别、结合,生成能够转导细胞信号的2',3'-cGAMP。2',3'-cGAMP 将接收到的上游细胞信号递送给下游的接头蛋白——STING,STING 激活后触发免疫应答,分泌Ⅰ型IFN 和TNF-α 等细胞因子。Ⅰ型IFN具有双重功能,一方面增强细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)通过多种途径特异性杀伤抗原靶细胞的能力,抵御病原体的入侵,从而实现抗病毒感染;另一方面在肿瘤微环境(tumor microenviroment,TME)中通过招募更多的效应T细胞杀伤肿瘤细胞,参与免疫应答。若该通路中任一组分结构或功能异常,使信号传导受阻,无法顺利启动固有免疫或适应性免疫,将会导致多种疾病的发生;若异常积聚的DNA 缓慢、持续刺激,使cGAS-STING 通路一直处于激活状态,则导致炎性细胞因子的过度合成与释放,造成组织炎症或自身免疫性疾病。
2.1 cGAS-STING 信号通路与感染性疾病
在病毒的侵染进程中,进化出多种使cGASSTING 信号通路不能被有效激活的逃逸机制,避免病毒引起机体免疫系统应答。例如很多DNA 病毒和逆转录病毒,可以将核酸包裹在衣壳中,待顺利穿过细胞质后,进入细胞核中将核酸整合至宿主基因组进行复制[4]。如严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起严重的呼吸系统疾病新型冠状病毒肺炎(corona virus disease 2019,COVID-19)。研究发现,诱导STING 激活后,促使炎性因子的产生和肺部淋巴细胞的激活,在一定程度上规避了病毒S 蛋白突变造成的免疫逃逸:K18-ACE2 转基因小鼠感染后,通过鼻内吸入的方式给予STING 激动剂,显著抑制了感染过程,体内病毒载量显著降低[18]。Ma 等[3]研究发现,卡波西肉瘤相关疱疹病毒(Kaposi,s sarcoma-associated herpesvirus,KSHV)能够通过膜蛋白直接结合cGAS,破坏上游传感器cGAS 活性,通过KSHV 的病毒干扰素调节因子削弱STING 与TBK1 的结合能力和抑制STING 磷酸化,最终使cGAS-STING 信号通路失活。
2.2 cGAS-STING 信号通路与癌症
cGAS-STING 信号通路能够识别肿瘤细胞DNA,从而启动固有免疫诱导Ⅰ型IFN 的表达和分泌。为逃逸这种DNA 识别,肿瘤细胞已进化出多种途径从多方面抑制或破坏cGAS-STING 信号通路的激活。例如在人结肠癌细胞系中,肿瘤细胞通过超甲基化cGAS 和STING 启动子、降低cGAS 和STING 蛋白表达量、中断STING 向高尔基体的转位过程等机制,使cGAS-STING 信号通路发生异常[15]。
整合素相关蛋白(integrin-associated protein,IAP,即CD47)与信号调节蛋白α 结合后抑制巨噬细胞对肿瘤细胞的吞噬,通常在肿瘤细胞表面过度表达,成为肿瘤免疫逃逸的“帮凶”。Shi 等[19]观察到双歧杆菌通过在TME 中积累,刺激机体产生抗CD47 抗体,促进肿瘤组织内局部抗CD47 免疫,确定了肠道微生物优先在肿瘤部位定植的机制并通过STING 信号通路促进免疫治疗;同样,Kosaka等[20]发现在小鼠乳腺癌细胞EO771 中,cGAMP和抗CD47 单克隆抗体联合使用时可抑制肿瘤细胞生长,而单独使用抗CD47 单克隆抗体时无作用。研究表明小细胞肺癌(small cell lung cancer,SCLC)中DNA 损伤应答(DNA damage response,DDR)基因异常表达,DDR 异常与肿瘤突变负荷(tumor mutation burden,TMB)具有密切关系,TMB 可作为免疫检查点抑制剂(immune checkpoint inhibitor,ICI)抗程序性死亡受体1(programmed death 1,PD-1)抗体治疗效果评估的标志物,同时DDR 缺陷能提高肿瘤细胞表面程序性死亡配体1(programmed death-ligand 1,PD-L1)蛋白的表达,使得肿瘤细胞对ICI 治疗更为敏感[21]。在SCLC 体内模型中靶向DDR 的药物如DNA 修复酶抑制剂和细胞周期检查点激酶1 抑制剂,使DNA 损伤增加,激活了STING-TBK1-IRF3 通路,使CXCL10和CCL5 等炎性因子水平升高,增强CTL 的浸润,促进其杀伤肿瘤细胞的作用;而敲除cGAS 和STING 削弱了DDR 抑制和抗PD-L1 抗体联合使用的抗肿瘤作用[22]。这些研究表明STING 在抗肿瘤免疫中具有积极作用,cGAS-STING 信号通路将固有免疫与适应性免疫联系在一起,使机体产生长效抗肿瘤的免疫记忆性。
2.3 cGAS-STING 信号通路与自身免疫性疾病
病原体感染是激活cGAS-STING 信号通路的主要方式,但因损伤而泄露到细胞质中的细胞核和线粒体DNA 也能够激活该通路。细胞质中大多数游离的自身DNA 和RNA 能被机体内的核酸酶如3'-核酸修复外切酶1(three repair exonuclease 1,TREX1)、核糖核酸酶RNase H2、不育-α-基序结构域和组氨酸/天冬氨酸残基双联体结构域包涵蛋白1、RNA 腺苷脱氨酶降解。在自身免疫性疾病患者中发现核酸酶的基因突变伴随cGAS-STING 信号通路的激活[23]。如系统性红斑狼疮(systemic lupus erythematosu,SLE)由于TREX1的突变使得细胞内游离的自身DNA 不能被降解,致使cGASSTING 信号通路持续激活,在15% SLE 患者外周血单个核细胞中检测到cGAS 和cGAMP 水平升高[24]。除了核酸代谢酶功能异常外,单基因突变也可使STING 功能异常增强,甚至引起细胞因子风暴。例如家族性冻疮样红斑狼疮(familial chilblain lupus,FCL)患者的STING 为G166E 突变型,表现为STING 二聚体结构更为紧密,即使缺乏第二信使2',3'-cGAMP 也能够激活下游通路,释放Ⅰ型IFN[25]。STING 相关婴儿期发病血管病(STINGassociated vasculopathy with onset in infancy,SAVI)是一种由于STING 编码基因突变引起的自身免疫性疾病,包括V147L,N154S,V155M,G166E,C206Y,R281Q 和R284G 等多个突变位点,这些突变导致STING 寡聚化并激活,引起早发的全身炎症和皮肤血管病变[26]。综上所述,开发靶向STING的抑制剂将有助于自身免疫性疾病的治疗。
2.4 cGAS-STING 信号通路与其他疾病
除了上述疾病外,已有多项研究表明cGASSTING 信号通路与心血管疾病、代谢性疾病、神经退行性疾病等多种疾病密切相关。Zhang 等[27]发现扩张型或肥厚型心肌病患者和心肌肥厚小鼠心肌中的STING 表达水平与疾病进程相关,Sting基因敲除小鼠中心房钠尿肽、脑钠肽、β-肌球蛋白重链等肥大标志物表达下调,心肌炎症和纤维化减轻,并最终改善了心脏功能,体外分析证实STING 是与内质网应激密切相关的促进心肌肥大的重要信号。同样,STING 在动脉粥样硬化(atherosclerosis,AS)发展中也发挥了重要作用,细胞内压力升高使得核、线粒体DNA 受损,DNA 异常积累激活了cGASSTING 信号通路,STING 信号刺激巨噬细胞的促炎激活,释放大量炎性因子,导致机体产生无菌炎症,促进了AS 的发生和发展[28]。
研究表明,cGAS-STING 通路在大脑中异常激活可能导致神经炎症和神经退行性疾病。E3 泛素连接酶Parkin 和线粒体自噬相关蛋白PTEN 诱导的假定激酶1(PTEN induced putative kinase 1,PINK1)在损伤线粒体的自噬中发挥重要作用,线粒体功能损伤可能导致帕金森病(Parkinson’s disease,PD)。在Parkin 和PINK1 功能缺陷的小鼠模型中,受损的线粒体不能通过自噬被清除,导致泄露的线粒体DNA 激活cGAS-STING 信号通路,产生更多的炎症因子和Ⅰ型IFN,当Sting基因敲除时,炎症有所缓解[29]。Zhao 等[30]报道了一种具有治疗PD潜力的天然药物——醉茄素A,通过靶向多巴胺神经元中DJ1-Nrf2-STING 通路,下调STING 表达以减缓神经炎症诱发的细胞凋亡,在PD 中发挥神经保护作用。
此外,Donnelly 和Wang 等[31-32]报道了STING可通过直接调节神经元的活性以及通过免疫调节缓解骨癌伴发的疼痛。特异性敲除Sting基因的小鼠对伤害性刺激极为敏感,向正常小鼠鞘内注射STING激动剂显著提高了疼痛的阈值,对骨癌痛和神经病理性疼痛小鼠模型也同样具有镇痛效果。同时该研究证实STING 通路的激活上调了Ⅰ型IFN 的表达,Ⅰ型IFN 通过直接减弱伤害感受器的钠电流和钙电流影响神经元的兴奋性而实现镇痛,STING-IFN 信号轴作为生理性疼痛调节的关键,为治疗慢性疼痛提供了有希望的靶点。
3 cGAS-STING 信号通路靶向药物的开发
随着对cGAS-STING 通路的深入研究,科研人员发现该信号通路的紊乱将会导致疾病的发生,因此靶向cGAS 和STING 蛋白的药物开发备受关注。目前,已有一些靶向cGAS-STING 通路的药物进入临床试验阶段,有望应用于肿瘤和自身免疫性疾病的治疗。
3.1 cGAS 抑制剂
虽然某些金属离子(锌、锰、钴离子等)可以调控cGAS 酶活性,但由于所需浓度过高,易对人体产生不良影响,甚至引起中毒,因此有关cGAS激动剂的报道还未出现[33]。cGAS-STING 通路的过度激活可导致炎症和自身免疫性疾病的发生,使cGAS 成为一种有望治疗自身免疫性疾病的新型潜在靶点。抗疟疾药物阿的平(quinacrine,QC)是一种很有潜力的cGAS 抑制剂,鼠源cGAS dsDNA共结晶结构显示,QC 通过破坏dsDNA 构象,间接抑制cGAS 酶的活性。在人髓系白血病单核细胞中QC 的IC50为3.7 µmol · L-1,但该药物尚未在小鼠模型中进行测试[34]。cGAS 调控因子GTP 酶激活蛋白SH3 结构域结合蛋白1[GTPase-activating protein-(SH3domain)-binding protein 1,G3BP1]能够增强cGAS 和DNA 的结合,促进cGAS-DNA 复合物的形成。Liu 等[35]从绿茶茶多酚中发现的天然小分子表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),能够作为G3BP1 的抑制剂,干扰G3BP1 与cGAS 的结合,从而阻止cGAS 识别异常DNA,导致下游通路无法激活。EGCG 抑制cGAS 的有效性在自身免疫性疾病动物模型和艾卡迪综合征(Aicardi-Goutières syndrome,AGS)患者中得到了验证。该团队还发现cGAS 蛋白第384,394,414 位 处 赖 氨 酸 残 基(Lys384,Lys394,Lys414)的乙酰化对酶活性存在显著影响,其使cGAS 蛋白保持非活性状态,同时在AGS 患者细胞和小鼠模型中,发现阿司匹林可使cGAS 在上述位点发生乙酰化修饰,阻止cGAS 激活下游信号通路,抑制自身免疫反应[36]。Vincent 等[37]利用高通量筛选发现了cGAS 小分子抑制剂RU.521,共结晶结构显示,RU.521 通过占据cGAS 催化位点,影响第二信使2',3'-cGAMP 的形成而特异性抑制cGAS 信号通路。在后续研究中发现,相较于人源cGAS,RU.521 对鼠源cGAS 酶活抑制作用更明显,于是进一步筛选出能够显著抑制人源cGAS 蛋白的化合物G140 和G150[38]。
近日,Chu 等[39]报道了紫苏醛通过抑制cGAS活性抑制胞质DNA 引起的自身固有免疫。紫苏醛是从紫苏中提取的一种具有甲酰基的单萜化合物,给予紫苏醛后的小鼠更易感染1 型单纯疱疹病毒。接受紫苏醛治疗的AGS 疾病模型——Trex1基因敲除(Trex1-/-)小鼠的Cxcl10,Isg15,Isg56,Ifit3等多个干扰素刺激基因(interferon-stimulated genes,ISG)表达水平降低,自身免疫炎症明显减弱。Tan 等[40]根据cGAS 结构特征,采用生物电子等排、侧链延长等策略合成了Ⅰ和Ⅱ 2 个系列小分子抑制剂,并在此基础上运用骨架迁移获得系列Ⅲ和Ⅳ,再在系列Ⅳ的结构基础上进行环化或重排,进一步得到系列Ⅴ和Ⅵ;随后在人源急性单核细胞白血病细胞来源的THP1-Dual 细胞与小鼠单核巨噬细胞白血病细胞来源的RAW-Lucia ISG 细胞中,测试新化合物对cGAS 信号通路的抑制活性,结果表明这些新化合物均有较好的cGAS 抑制作用;其中,新化合物25 表现优异,LPS 诱导的急性炎症模型小鼠经腹腔注射该化合物后,小鼠血清中的TNF-α,IL-6,IL-12 细胞因子水平显著下降,表明其抗炎效果良好,具有应用于临床治疗的潜力。目前处于临床前研究的cGAS 抑制剂见表1。
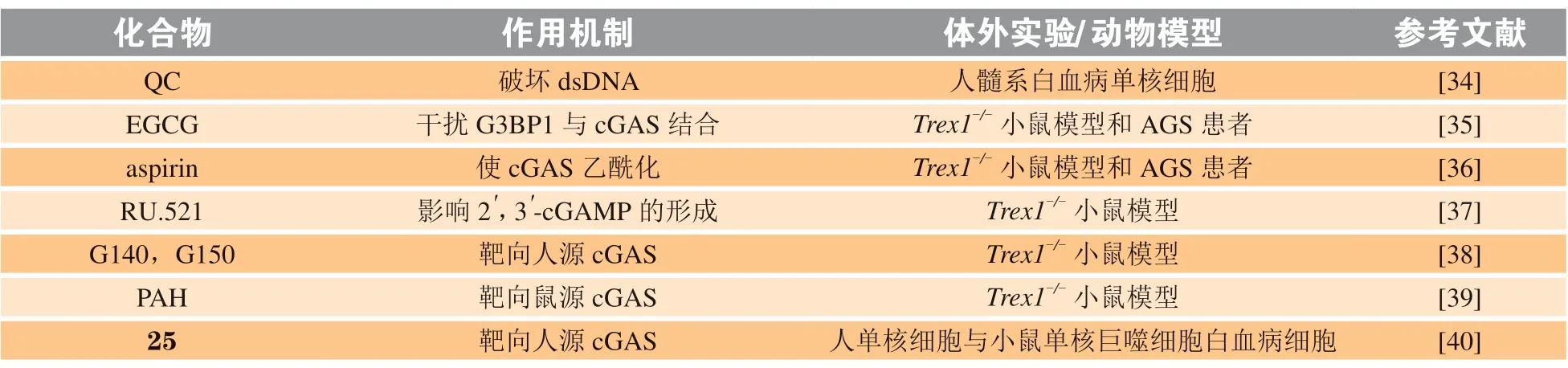
表1 处于临床前研究的cGAS 抑制剂Table 1 cGAS inhibitors under pre-clinical research
3.2 STING 抑制剂
随着对cGAS-STING 信号通路认识的加深,越来越多的研究发现,细胞内核酸代谢酶的缺陷或STING 蛋白突变会引起STING 过度激活,导致Ⅰ型IFN 等炎症相关细胞因子的持续表达与分泌,最终引起自身免疫性疾病,由此促进了STING 抑制剂的发展。目前STING 抑制剂的设计都是基于该化合物能够与2',3'-cGAMP 竞争性结合STING 蛋白。Siu 等[41]应用自动配体鉴定系统,发现了化合物C18,2 分子C18 能够结合1 个STING 二聚体蛋白,从而抑制STING 信号。Li 等[42]从药用植物紫苑中分离出的AstinC,能够与STING CTD区域结合,通过阻断STING 招募IRF3 的过程,抑制STING 下游通路。Trex1-/-小鼠模型中,给予AstinC,可显著缓解由于Trex1缺陷导致的自发性炎症。
近来,研究人员开始关注STING N 端序列中第88 位和第91 位的半胱氨酸残基(Cys88/Cys91)发生的棕榈酰化在激活STING 信号中的重要作用[11]。由此,Hansen 等[43]发现内源性硝基共轭亚油酸可与STING 蛋白Cys88/Cys91 发生共价修饰,破坏STING 棕榈酰化,影响STING 信号传导。通过化学筛选获得的化合物C-176 和C-178,也是通过阻止Cys91 位发生棕榈糖基化,抑制STING 通路,但C-176 和C-178 只能抑制鼠源STING(murine STING,mSTING),无法结合hSTING[44]。该研究团队进一步筛选出化合物H-151,是一种选择性的STING 抑制剂,作用机制与上述化合物相同,抑制hSTING Cys91 的棕榈酰化,减少TBK1 磷酸化,在Trex1-/-小鼠模型中显著改善了自身免疫性疾病发展的进程[44]。Hong 等[45]通过虚拟筛选和生物活性评价,发现了4 种对STING 具有显著抑制作用的化合物,并进一步确定小分子SN-011 能特异性结合在STING 与内源性配体2',3'-cGAMP 结合的口袋内,使STING 蛋白保持“开放”的V 型构象,阻碍STING 寡聚化、转位和激活。在体内外多种模型中,SN-011 能够显著降低Ⅰ型IFN 等促炎细胞因子的表达与分泌。此外,研究人员对比了SN-011和H-151 潜在的细胞毒性,向小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)、3T3 细胞和敲除Sting基因的MEF 中分别添加不同浓度的SN-011 和H-151,12 ~ 36 h 后检测细胞活力及细胞存活数,实验证明H-151 严重损害细胞活力甚至引起死亡,而SN-011 对细胞基本无影响,有望成为一种安全有效的STING 抑制剂。目前处于临床前研究的STING 抑制剂见表2。
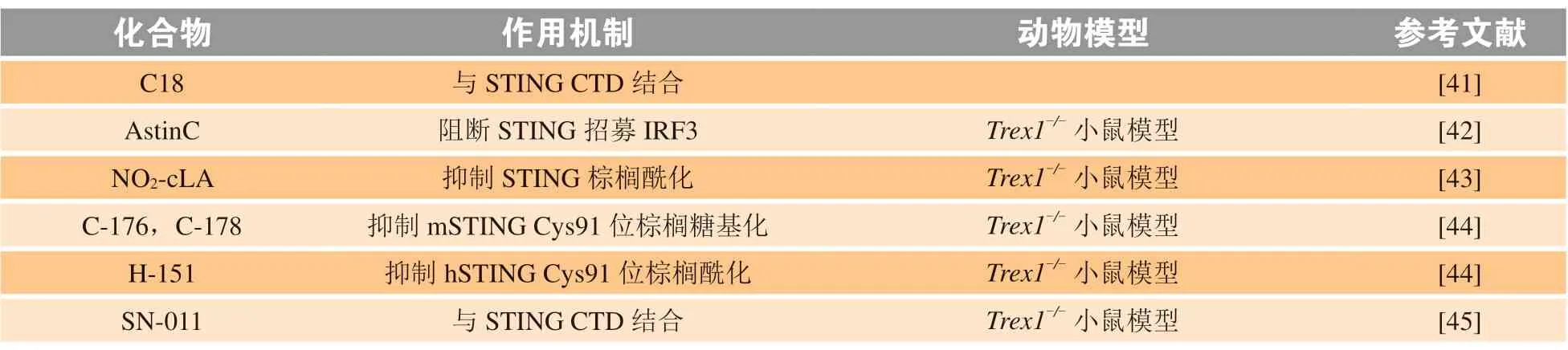
表 2 处于临床前研究的STING 抑制剂Table 2 STING inhibitors under pre-clinical research
3.3 STING 激动剂
STING 是启动下游Ⅰ型IFN 等炎症因子表达的重要分子,因此在病毒感染、癌症中,如何有效激活STING,介导机体免疫防御,成为近年来免疫治疗的研究热点。哺乳动物体内通过cGAS 生成的2',3'-cGAMP 以及细菌胞内的代谢物环化二核苷酸(cyclic dinucleotides,CDNs)都可与STING 直接结合,激活STING 下游通路。结构方面,2',3'-cGAMP与CDNs 主要是磷酸二酯键的连接位置不同。与STING 的结合能力方面,2',3'-cGAMP 是天然存在的最有效的STING 激动剂,研究表明2',3'-cGAMP与STING 结合的解离常数(Kd)是c-di-GMP 和3',3'-cGAMP 的1/300,是2',2'-cGAMP 的1/75[46]。然而,直接将天然CDNs 作为STING 激动剂应用于肿瘤免疫治疗,存在稳定性差、透过细胞膜难等问题,影响了诱导Ⅰ型IFN 表达的能力[47],且体内存在一种核苷酸外焦磷酸酶/磷酸二酯酶1,广泛分布于细胞膜和内质网膜,该酶可水解2',3'-cGAMP和CDNs,阻止STING 的激活[48]。因此,可对天然CDNs 进行脂质体包裹,或纳米颗粒多聚体包裹,增强CDNs 在体内的透膜性;也可利用硫原子替代磷酸二酯键中的氧原子,获得硫代磷酸酯结构的CDNs 类似物,使其不易被酶水解[46],如MLRR-S2-CDA(也称为MIW815 或ADU-S100),与目前最有效的天然STING 激动剂2',3'-cGAMP(与STING 的结合能力强于天然CDNs)相比,在小鼠B16 肿瘤模型中表现出更强的IFN-β 诱导能力和肿瘤消退现象。目前,通过对天然CDNs 改造、修饰,制备的CDNs 类似物在性能上得到了优化,其中一些作为候选药物已进行临床试验。据报道,由强生公司最近开发的一种CDNs 类STING 激动剂JNJ-67544412(简称为JNJ-4412)能与hSTING 所有主要等位基因结合,比其他CDNs 的亲和力更强[49]。在同系肿瘤小鼠模型中,瘤内注射JNJ-4412 使肿瘤细胞和血浆中促炎症细胞因子水平升高,CD8+T 细胞数量增加,肿瘤细胞加速凋亡。3',3'-cyclic AIMP 也是一种新型STING 激动剂,在肝细胞癌(hepatic cell carcinoma,HCC)小鼠模型中,腹腔注射3',3'-cyclic AIMP 后,STING 功能缺陷小鼠肝表面结节变小,肿瘤细胞凋亡数量增加。在HCC 发展后期,给予3',3'-cyclic AIMP,大部分肿瘤出现消退现象[50]。
在临床开发中,大多数CDNs 类似物的STING激动剂由于稳定性差,导致对肿瘤中重要免疫细胞脱靶以及渗漏而引起毒性作用,限制了它们在肿瘤治疗方面的应用。为解决这一问题,研究人员正试图用细菌载体将STING 激动剂靶向递送到肿瘤内抗原呈递细胞(antigen-presenting cell,APC)或是开发能在全身传递的新型化合物。例如,基于细菌载体的免疫治疗法STACT 就是利用减毒鼠伤寒沙门菌携带对TREX1 具有抑制作用的微小RNA。已有研究表明,在小鼠结肠癌细胞CT26 和MC38 肿瘤模型中,静脉注射STACT-TREX1 与体内炎症细胞因子的极低水平有关,STACT-TREX1 可特异性定植于肿瘤微环境,促进肿瘤消退及再攻时的持久免疫。与早期的STING 激动剂相比,STACT-TREX1 更具优势,其可靶向肿瘤细胞更精准地给药[51]。
对STING 激动剂的开发,除了CDNs 类似物的筛选,一些非核苷类的小分子化合物也正在研究中。5,6-二甲基呫吨酮-4-乙酸(5,6-dimethylxanthenone-4-acetic acid,DMXAA)是一种强效的小分子mSTING 激动剂,在多种小鼠模型中均表现出抗肿瘤活性,但由于种属特异性,无法激活hSTING,导致在非小细胞肺癌Ⅲ期临床试验中失败[52]。然而对mSTING 和hSTING 进行结构分析,发现二者仅存在细微差别[53]。Gao 等[53]发现,突变后的hSTING 能够与DMXAA 结合,且通过其结合的晶体结构,确定了hSTING 突变的3 个位点,每个位点均促进了hSTING 与DMXAA 的结合。这为STING 激动剂的设计提供了新方向,以DMXAA为基础进行结构改造,或许能克服种属问题,激活hSTING。其中,单甲基7-methyl-XAA和8-methyl-XAA已被确认能激活hSTING,具有一定的抗癌活性[54]。
此外,STING 蛋白的结合口袋较大,需要结合的配体相对分子质量约为700 ,但配体相对分子质量较大,就会存在与天然CDNs 相同的问题,因此小分子激动剂的开发成为研究热点。通过与STING 竞争结合的高通量筛选法,筛选到小分子STING 激动剂二聚氨基苯并咪唑(dimeric amidobenzimidazole,diABZI),其结构、化学性质与CDNs 类似物完全不同,但其效力比cGAMP 高约18 倍,能诱导IFN-β 的大量分泌[55]。将diABZI静脉注射到结肠肿瘤模型小鼠中,产生了很强的抗肿瘤作用。对diABZI 进一步优化得到的diABZI2,活性更高,比cGAMP 强400 多倍。目前处于临床试验中的STING 激动剂见表3,处于体外或动物实验的STING 激动剂见表4。

表 3 处于临床试验中的STING 激动剂Table 3 STING agonists under clinical trial
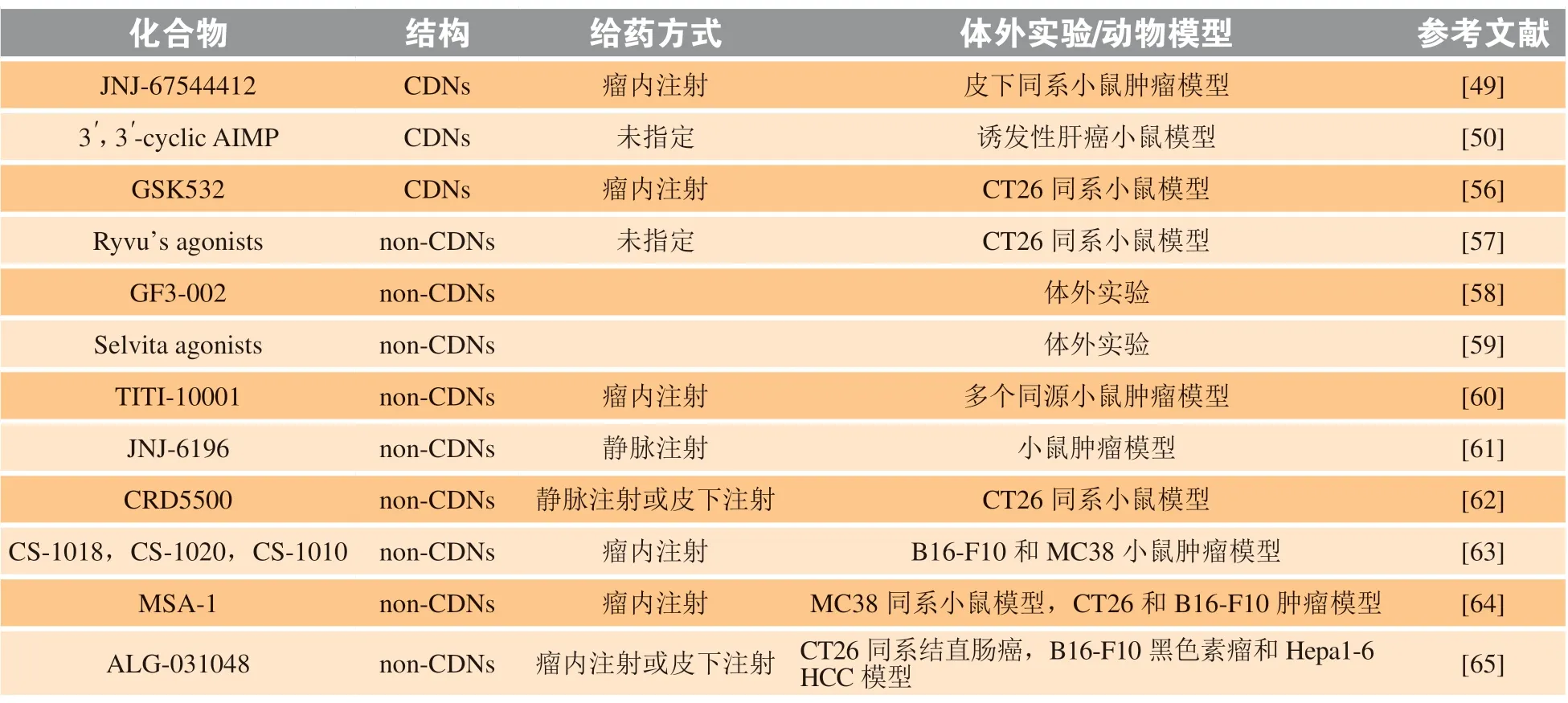
表 4 处于体外或动物实验中的STING 激动剂Table 4 STING agonists in vitro or in animal experiments

续表3
4 总结与展望
cGAS-STING 信号通路是一种细胞质DNA 传感途径,启动固有免疫后,驱动Ⅰ型IFN 等炎症相关细胞因子的表达与分泌,进而激活适应性免疫,在体内发挥重要的抗感染、抗肿瘤等免疫功能。体内存在多种调控机制以确保该信号通路的激活保持在适度的范围。当cGAS-STING 信号通路紊乱时,可能会导致病原体感染和自身免疫性疾病的发生,甚至促进肿瘤的发生、发展与转移。
大量临床前研究和临床研究表明,cGAS 和STING 靶向药物在增强肿瘤免疫、改善疾病方面极具潜力,如Bristol-Myers Squibb(BMS)公司开发的CDNs 类激动剂BMS-986301 在临床前研究中获得令人满意的结果,瘤内注射至CT26 和MC38 小鼠肿瘤模型,注射和非注射部位90%以上的肿瘤完全消退,而ADU-S100 仅能使13%的肿瘤消退[66],目前正在对晚期实体瘤患者进行BMS-986301 的临床试验,这些患者在接受肿瘤免疫治疗后往往无明显疗效;Fu 等[67]研发了一款肿瘤疫苗STINGVAX,在不同肿瘤模型中都表现出强大的抗肿瘤作用,其主要组分为CDNs,CDNs 可激活cGAS-STING 信号通路,促使大量CD8+T 细胞活化,同时产生免疫记忆。
虽然cGAS 和STING 相关药物研发前景广阔,但仍然存在一些问题,如:STING 配体结合口袋较大,而大体积配体的稳定性往往较差,对后续成药性造成困难[68];第1 代CDNs 类化合物的STING激动剂只能通过瘤内注射,其应用受到限制[48]。因此,应积极对现有化合物进行改造或筛选新型化合物,以期改善化合物性能,使其能够在全身稳定地给药。使用靶向药物时,cGAS-STING 信号通路被激活后是否引发负循环反馈,抑制STING 激动剂的作用,这一问题仍有待进一步的研究。
在开发药物的过程中,除了需要考虑物种特异性外,还应考虑个体的差异。个体由于自身情况不同,所需的药物有效剂量上可能存在差异,使用STING激动剂时,应兼顾安全性与有效性,使用过量会使STING 过度激活,从而可能会引发严重的炎症反应——细胞因子风暴[9],对身体产生毒性甚至导致死亡。此外,由于单核苷酸多态性,一些患者可能对常用的靶向药物不敏感,因此在肿瘤治疗中,应针对不同患者进行个性化治疗。
尽管cGAS-STING 信号通路的过程较为复杂,基于该通路的药物研发尚处于起步阶段,但已发现多个明确的切入点:配体结合、转位、棕榈酰化等,这些研究成果可指导新型靶向药物的开发。另外,一些辅助手段的发展,如cGAS 抑制剂筛选试剂盒和计算机辅助药物设计等也加快了cGAS 和STING靶向药物开发的进程。同时,对调控cGAS-STING信号通路过程中DNA 传感和信号转导分子的深入研究,将有利于了解该通路中每一组分的功能,开发某些间接靶向药物。进一步对cGAS 和STING 蛋白晶体结构和分子动力学的分析,也将有助于理解蛋白与配体间的相互作用,发现新的靶点。
