肝细胞肝癌免疫微环境与治疗研究新进展
2022-10-21魏瑗陈东萍吴锐奇王许燕邝栋明
魏瑗,陈东萍,吴锐奇,王许燕,邝栋明
(中山大学生命科学学院,广东 广州 510275)
肝细胞肝癌(hepatocellular carcinoma,HCC)是2020 年全球范围内诊断率第六高的癌症,也是癌症相关死亡的第三大原因。肝癌往往起源于病毒性肝炎、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)等具有慢性炎症的肝脏,因而其微环境组成非常复杂并在不同病人之间呈现高度异质性。目前手术切除、消融或肝移植是临床上肝癌的主要治疗手段,其对早期肝癌治疗具有较好的效果。然而,只有不到20%的患者在疾病的早期阶段被诊断出来。晚期或发生转移的肝癌患者术后复发率高达70%,5 年生存率低于10%[1-2]。
HCC 是一种化疗难治性肿瘤,对大部分在其他类型肿瘤广泛使用的化疗试剂耐受[3]。血管增生异常是肝癌的重要生物学特征,支持了肿瘤的进展及转移。随着小分子阻断血管生成通路的发展,HCC治疗模式发生了革命性的变化。多种血管生成抑制药物被批准用于肝癌一、二线治疗[4-5],然而,这些药物只能一定程度上改善患者的总体生存率,治疗的长期疗效依赖于其引发的免疫反应。因此,了解和评估原发性和治疗后肿瘤免疫微环境的组成及形成机制,对了解肝癌患者的耐药机制和寻找更高效的治疗方案具有重要意义。
肿瘤是一种免疫原性疾病,调控局部免疫反应的方向和类型作为肿瘤治疗新策略也正日益被探索。在多种肿瘤中,免疫检查点分子抑制剂(immune checkpoint inhibitor,ICI)可有效恢复肿瘤浸润T 淋巴细胞的能力,从而有效清除恶性肿瘤。对于有反应的患者,ICI 治疗还显示出长期的疾病控制潜力,包括已发生转移以及化疗难治性的实体瘤[6]。ICI 也被运用于肝癌治疗中,但其有效率仅不到20%[7],提示肝癌具有复杂的免疫微环境。因此,寻找新的或联合免疫治疗靶点是肝癌治疗领域迫切需要解决的问题。
本文介绍了肝癌免疫微环境的组成和形成机制,以及目前肝癌的临床治疗策略,重点讨论这些治疗策略和免疫微环境之间的相互作用及互作网络对治疗疗效的影响,并总结了肝癌免疫治疗的新进展,讨论相关的临床前研究对提高肝癌临床免疫治疗的启发。
1 肝癌免疫微环境
肝癌常起源于病毒感染或脂肪肝导致的慢性炎症。受遗传、病毒、环境等多重因素的复杂调控,肝癌免疫微环境呈高度的异质性。这些免疫组成及功能特征的差别,不仅决定了肝癌的进展,也影响了患者对治疗的响应。因此,理清肝癌免疫微环境的组成及其反应网络,对寻找潜在靶点和开发新型有效的肝癌治疗手段尤为重要。
1.1 肿瘤浸润T 细胞
细胞毒性T 淋巴细胞(cytotoxic T lymphocyte,CTL)是肝癌中杀伤肿瘤的“主力军”,它的高度浸润提示患者良好预后。CTL 通过分泌Ⅱ型干扰素(interferon-gamma,IFN-γ)促进肿瘤细胞抗原呈递和铁死亡,并通过穿孔素、颗粒酶和凋亡相关因子配体(Fas ligand,FasL)等效应分子直接杀伤肿瘤细胞。现行免疫治疗大多旨在恢复或增强CTL 的抗肿瘤功能,但肝癌中CTL 的失能受多机制调控:肝癌的代谢环境,如乳酸堆积、氨基酸缺乏和低氧环境常导致CTL 功能失常;肝癌微环境中的免疫调节分子如白细胞介素10(interleukin 10,IL-10)、吲哚胺2,3-双加氧化酶等能负调控CTL 的抗肿瘤功能[8];新近研究也相继鉴定了细胞毒性T 淋巴细胞相关抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4),程序性死亡受体1(programmed cell death 1,PD-1)和T 细胞免疫球蛋白黏蛋白分子3(T cell immunoglobulin and mucin-containing molecule 3,TIM-3)等共抑制分子及其配体在肝癌CTL 失能和耗竭中的重要作用[8]。除了上述免疫抑制分子,新近研究也鉴定了非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)和肝纤维化等肝癌诱导因素通过不同机制抑制CTL 抗肿瘤反应[9]。肝癌中CTL 的失能受多靶点调控,这导致单一的ICI 治疗在肝癌中收效不佳。合理的联合治疗方案成为恢复肝癌中CTL 抗肿瘤功能的重要策略。
与CTL 不同,辅助性T 细胞(helper T cell,Th)在肝癌中的亚群及功能则更加多样。除了经典的Th1 和Th2,包括Th17,Th22 和滤泡辅助性T 细胞(T follicular helper cells,Tfh)等多个亚群也在肝癌中被鉴定,并构成了肝癌局部炎症反应的重要来源。这些Th 亚群受到肝癌中抗原呈递细胞(antigen presenting cell,APC)的刺激增殖分化形成,并通过不同机制影响肝癌进展。已证实,肝癌中活化的巨噬细胞通过分泌细胞因子IL-1β,IL-6,IL-23,转化生长因子-β(transforming growth factor-β,TGF-β)和表达共抑制分子PD-L1 调控了Th17 和Th22 分化,进而促进肝癌血管生成[10-11]。同时,Tfh 的分化则受到IL-1β 和IL-23 的调控,这些Tfh 通过IL-21 和IFN-γ 诱导了免疫球蛋白G(immunoglobulin G,IgG)+浆细胞发育,进而促进M2b 型巨噬细胞极化[12]。
值得注意的是,肝癌具有免疫炎症与免疫抑制共存的微环境。介导免疫抑制的调节性T 细胞(regulatory T cell,Treg)也在肝癌中大量浸润,并与肿瘤侵袭及术后复发正相关[13]。已证实,C-C基序趋化因子配体(C-C motif chemokine ligand,CCL)17/CCL22-C-C 基序趋化因子受体(C-C motif chemokine receptor,CCR)4 轴在招募Treg 向肿瘤组织浸润过程中发挥重要作用。特别是在乙肝病毒相关肝癌中,病毒通过刺激肝癌细胞分泌趋化因子CCL17 和CCL22 来诱导CCR4+Treg 获得干性表型,这些干细胞样Treg 能够分泌更多IL-10 和IL-35 进而抑制CTL 功能[14]。新近研究也报道了巨噬细胞来源的CCL22 和肝窦内皮细胞来源的TGF-β 分别促进了Treg 的招募与发育[15]。此外,粒细胞也可通过活化Toll 样受体信号通路来促进CD4+T 细胞向Treg 分化。越来越多的证据表明,Treg 浸润是索拉非尼对肝癌治疗无效的原因,而联合索拉非尼和去除Treg 能够增强治疗效果[16]。尽管炎性Th 亚群及Treg 在肝癌微环境共存及平衡的机制尚不清楚,但这些T 细胞协同促进了肝癌的进展。
1.2 肿瘤浸润B 细胞
B 细胞是重要的适应性免疫细胞,主导了体液免疫反应。目前肝癌中针对B 细胞的研究相对较少。B 细胞也是肝癌微环境的重要组分,并主要分布于肿瘤的侵袭前沿区域。然而,这些肿瘤浸润B 细胞并未发挥免疫防护作用。相反,其浸润数量与肝癌患者术后早期复发正相关[17]。分泌抗体发挥效应功能是B 细胞最重要的特征。研究表明,肝癌中聚集大量分化成熟的B 细胞(浆细胞)。这些浆细胞由C-X-C 基序趋化因子受体3(C-X-C motif chemokine receptor 3,CXCR3)+B 细胞接受Tfh 及巨噬细胞的辅助在原位分化形成,并选择性呈现IgG+的表型[12,18]。然而,在自然杀伤(natural killer,NK)细胞缺失的肝癌微环境中,这些浆细胞分泌的IgG 主要诱导了M2b 型巨噬细胞的极化,最终促进肝癌进展并削弱表观遗传重编程的治疗效果[18]。
新近研究在肝癌中发现一群PD-1high调节性B细胞(regulatory B cell,Breg)。这些B 细胞呈现出不同于传统外周Breg 的表型,并在接受PD-L1信号时产生IL-10[19]。此外,IgG Fc 段受体II(Fc gamma receptor II,FcγRII)low/-Breg 也在肝癌中被鉴定,它们受树突状细胞(dendritic cell,DC)来源FasL 信号诱导分化并通过IL-10 抑制抗肿瘤T 细胞反应[20]。在NAFLD 相关的肝癌中,Breg 主要呈现IgA+表型,并同时表达PD-L1[21]。尽管在不同背景的肝癌中具有不同的表型及分化调控,这些Breg亚群通过促进局部免疫抑制共同促进了肝癌进展。
值得注意的是,并非所有的B 亚群均发挥促肿瘤功能,如黑色素瘤及骨肉瘤中,ICI 治疗能促使三级淋巴结构的形成[22]。在T 细胞与B 细胞紧密接触的三级淋巴结构中,T 细胞具有更强的增殖及效应功能,提示抗肿瘤B 细胞亚群的存在[22]。肝癌中是否存在抗肿瘤B 细胞亚群,它们的表型、分化及功能调控如何?阐明这些问题将有助于开发靶向B 细胞的肝癌临床治疗策略。
1.3 肿瘤相关巨噬细胞
肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是肝癌中数量最多的APC。已证实,肝癌细胞及受其影响的间质细胞通过分泌CCL2 促进外周血CCR2+单核细胞向肝癌组织浸润。此外,新近研究也发现,肝癌细胞来源的腺苷能够促进组织中TAM 增殖[23]。值得注意的是,巨噬细胞具有高度可塑性,可根据不同的组织微环境而展现出独特的表型和功能。肿瘤微环境是塑造TAM 表型和功能的决定性因素。肝癌微环境中IL-4,IL-13 和巨噬细胞集落刺激因子等细胞因子已被证实能促进TAM分化。此外,肝癌细胞来源透明质酸等可溶性因子,可通过模式识别受体信号,启动TAM 的激活和分化[24]。还有研究证实,肝癌的代谢微环境也能改变巨噬细胞的分化路径[25]。
一般认为,肝癌中TAM 下调表达抗原呈递分子人白细胞DR 抗原(human leucocyte antigen DR,HLA-DR),大量产生IL-10 和TGF-β 等Th2细胞因子,因而主要发挥促肿瘤效应。介导免疫抑制是TAM 的重要功能。肝癌中TAM 可通过上调PD-L1 表达抑制CTL 的抗肿瘤功能[26]。此外,肝癌中的巨噬细胞也能诱导癌细胞PD-L1 表达来抑制抗肿瘤反应[27]。除诱导免疫抑制,肝癌的癌旁间质区域还浸润着一群活化的巨噬细胞,它们通过分泌炎 性 因 子IL-1β,IL-6 和IL-23 诱 导Th17 和Th22分化,进而促进肝癌血管生成[10-11]。然而,肝癌中并非所有巨噬细胞都发挥促肿瘤功能。有研究报道,在ICI 治疗下CD169+巨噬细胞通过增强CTL 反应促进肿瘤消退[28]。事实上,正常肝组织中绝大部分巨噬细胞呈现CD169+表型,然而受肿瘤微环境调控,肝癌中CD169+TAM 的数量显著减少,因而无法有效清除肿瘤细胞[29]。因此,靶向调控TAM 表型和功能转变的关键分子,有望恢复TAM 的抗肿瘤功能。
1.4 肿瘤相关粒细胞
肿瘤相关粒细胞(tumor-associated neutrophil,TAN)也是具有高度可塑性的免疫细胞。已证实,肝癌中TAN 数量与患者生存时间负相关,且其高度浸润能够预测晚期肝癌患者对PD-1/PD-L1 封闭治疗的较差响应性[30],这些临床证据提示它们主要发挥促肿瘤功能。一般认为,TAN 主要通过分泌炎症介质来诱导血管生成、增强癌细胞上皮-间质细胞转化和耐药性,最终促进肝癌进展。新近研究发现,肝癌中粒细胞能够形成一种被称作中性粒细胞胞外陷阱(neutrophil extracellular trap,NET)的独特的细胞外诱捕网结构。这种结构可递送粒细胞胞内物质到微环境,从而加剧局部炎症反应[31]。此外,NET 递送的DNA 也可直接作用于肿瘤细胞,增强其迁移能力[32]。除介导炎症反应外,TAN 也被报道参与了抑制性免疫微环境的塑造。它可通过分泌CCL2 和CCL17 招募巨噬细胞和Treg,进而导致肝癌抵抗索拉非尼治疗[16]。尽管粒细胞是一种短寿的免疫细胞,但肝癌中大量富集的IL-17 可促进上皮细胞释放多种趋化因子,从而促进外周粒细胞向肿瘤补充[33]。这些粒细胞进入肿瘤后受到肿瘤进一步教化,通过上调其自噬水平获得更强的存活能力及促炎功能[34]。与此相应,使用小分子药物抑制粒细胞的趋化因子受体CXCR2 能有效阻断外周血粒细胞向肝癌组织浸润,并进一步提升ICI 对肝癌的治疗效果[35]。因此,趋化和促存活是肝癌维持局部粒细胞相关免疫反应的重要手段。
1.5 髓源抑制性细胞
髓源抑制性细胞(myeloid-derived suppressor cell,MDSC)是一群未成熟的、具有免疫抑制功能的髓系细胞。肝癌中MDSC 可通过表达精氨酸酶1和诱导型一氧化氮合成酶以及产生活性氧等直接抑制CTL 的抗肿瘤反应,也可通过诱导Treg 分化间接抑制免疫应答。鉴于MDSC 对CTL 的强烈抑制作用,阻断肝癌中MDSC 分化和浸润,有望恢复肝癌患者体内的抗肿瘤免疫反应。尽管肝癌中MDSC的来源和分化尚未完全清楚,但新近研究利用不同实验模型探讨了MDSC 的分化调控机制并获得了较好的进展。一方面,MDSC 的浸润是肝癌细胞遗传特性改变的产物。肝癌细胞内源表达的载脂蛋白B-mRNA 编辑酶复合物3B 和细胞周期相关激酶分子可通过表观遗传依赖的途径改变自身趋化因子CCL2和炎症因子IL-6的分泌,进而募集MDSC[36-37]。另一方面,肝癌微环境中肝脏星状细胞也可通过诱导髓系细胞p38 通路活化来促进MDSC 分化[38]。因此,肝癌中MDSC 的形成是癌细胞与微环境共同调控的结果。值得注意的是,MDSC 在细胞因子诱导的杀伤细胞(cytokine-induced killer cell,CIK)治疗模型中负反馈上调,该过程主要由治疗引起的炎性因子C-X3-C 基序趋化因子配体1 和IL-13 所介导,并最终削弱CIK 疗效[39]。因此,进一步阐明原发性及治疗后微环境中MDSC 的形成机制,对肝癌现有治疗疗效的提高及新靶点的开发具有重要意义。
2 肝癌现行临床治疗方案及其与免疫微环境的互作
近年来,肝癌治疗临床研究取得重大进展:早期肝癌以手术切除和射频消融等根治性治疗为主,中晚期肝癌则采取局部治疗联合系统治疗的方式。部分肝癌经联合治疗后甚至可达到转化切除的目的,最终使患者得以长期生存。因此,多学科综合治疗是延长患者生存时间,提高患者生活质量的有效策略。
2.1 局部治疗
2.1.1 手术切除/局部消融治疗 手术切除和局部消融是目前早期肝癌或小肝癌(≤5 cm)最常用的根治性治疗手段。尽管这些传统的治疗方法可有效地解决局部病变,但肿瘤的彻底消灭最终依赖于免疫系统的功能。研究表明,射频消融术(radiofrequency ablation,RFA)通过热效应灭活肿瘤细胞的同时,还可释放肿瘤抗原,从而激活抗肿瘤免疫应答,促进肝癌的消退[40-41]。然而,也有研究表明:RFA 虽可直接杀伤癌细胞,但其释放的危险信号及残留的癌细胞能够募集更多的TAM,从而诱导恶性炎症来抑制T 细胞的功能,最终加快肿瘤的转移[42-44]。由此可见,免疫系统的状况直接或间接影响了肿瘤对治疗的响应情况。
2.1.2 放射治疗 在目前的临床实践中,放射治疗(简称放疗)是不适宜手术切除和射频消融后复发的小肝癌患者的一种有效治疗方案。对于可完整切除的合并门静脉癌栓的肝癌,术前行新辅助放疗可有效改善患者的整体预后[45]。具体来讲,放疗杀伤肿瘤细胞时,这些细胞往往不会立即死亡,而是存活一段时间并保留免疫原性和产生多种因子的能力。这些因子不仅影响局部肿瘤浸润的免疫细胞,同时进入循环系统,引起全身性的免疫效应[46-47]。支持这一结论的是,血清中IL-6 水平可在一定程度预测放疗效果[45]。可见,除直接杀伤肿瘤外,放疗对塑造抗肿瘤免疫网络也具有重要的意义。
值得注意的是,肿瘤在响应放疗时,可能并不能有效产生免疫原性细胞死亡,反而会发生细胞凋亡因而无法诱导有效的抗肿瘤免疫应答[48];而过强的免疫原性死亡也会导致大量肿瘤抗原的释放而引起免疫耐受[49-50]。此外,放疗同时也会杀伤肿瘤微环境中的免疫细胞,导致T 细胞严重受损,无法发挥抗肿瘤活性[51]。因此,放疗技术在肝癌治疗方面的适用范围仍需进一步探讨。
2.1.3 肝动脉介入治疗 肝癌是一种血管异常丰富的肿瘤。临床上利用这一特性,将肝动脉介入治疗作为不能手术的中晚期肝癌常用的治疗手段之一。根据肝动脉插管化疗、栓塞操作和材料的不同,通常分为:1)肝动脉灌注化疗,即经肿瘤供血动脉灌注化疗药物,常用化疗药物有铂类、抗代谢药等;2)肝动脉栓塞,即单纯采用栓塞剂堵塞肝肿瘤的供血动脉;3)肝癌栓塞化疗,即把化疗药物与栓塞剂混合在一起或使用药物洗脱微球,经肿瘤的供血动脉支注入。尽管肝癌动脉栓塞可引起局部组织缺血、坏死,在一定程度上缓解肿瘤的进展,但其单独使用效果不理想,需与根治性手术切除等联合治疗才能有效果。近年来的研究表明,化疗可重塑肿瘤微环境中的免疫细胞,使之获得独特的表型/功能。例如:化疗可短暂削减包括Treg 细胞在内的总T 细胞的数量,从而打破原有肿瘤微环境中的免疫抑制状态。此外,巨噬细胞则被“教育”成分泌Ⅰ型IFN的炎性表型[52]。这些活化的巨噬细胞可通过Ⅰ型IFN 募集和诱导CD8+T 细胞的抗肿瘤效应,从而促进肿瘤的消退。然而,这些巨噬细胞同时可产生肿瘤坏死因子-α 和IL-1β 等炎症因子。这些炎症因子一方面能够直接促进肿瘤细胞对化疗的耐受,同时还可通过促进PD-L1 的表达诱导免疫耗竭,并进一步诱导Th17 和Th22 细胞极化,最终加强肿瘤生存和促血管生成的能力[10-11,53]。因此,尽管肝动脉介入治疗已被认为是一种有效治疗中晚期肝癌的治疗策略,但它也可能反过来加快肿瘤转移和血管生成,最终加快肿瘤进展。针对不同的肝癌患者选用不同的治疗方式,不同的治疗剂量,以及不同的疗程对于提高肝动脉介入治疗的效果极为重要。
2.2 系统治疗
系统治疗又称为全身治疗,是治疗HCC 的重要手段。在我国,大多数肝癌患者确诊时已达中晚期,局部治疗手段已难以满足临床治疗的需求,系统治疗则可以减轻肿瘤负荷,改善肿瘤相关症状,提高生活质量,延长生存时间。系统治疗包括靶向药物治疗和免疫治疗[54]。其中,索拉非尼是治疗晚期癌症的首个系统疗法,自2007 年起,它作为酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)是肝癌唯一的全身治疗选择。十多年来,系统治疗领域发展迅速,又有4 种药物在Ⅲ期临床试验中获得成功,且最终获得批准:2018 年仑伐替尼被批准为一线治疗药物,打破肝癌10 年无新药可用的困境;贝伐珠单抗分别与PD-L1 抑制剂阿替利珠单抗和PD-1 抑制剂信迪利单抗在2020 年和2021 年获批用于一线治疗。此外,多种TKIs 包括瑞戈非尼、卡博替尼及雷莫芦单抗等和免疫治疗药物如纳武利尤单抗、帕博利珠单抗及伊匹木单抗也被批准被用于二线治疗。自此,中晚期肝癌治疗进入精准、联合、多样化的时代。
2.2.1 靶向治疗 目前肝癌的靶向治疗多为抗血管生成药物,其作用靶点均是血管内皮生长因子(vascular endothelial growth factor,VEGF)及其下游的酪氨酸激酶通路。近年来的研究表明:VEGF 不仅促进血管生成,还可改变肿瘤浸润的免疫细胞的正常分化,使其获得独特的表型与功能。例如,VEGF 一方面可损害DC 的成熟和抗原呈递功能,从而促进Treg 及MDSC 等抑制性细胞的聚集;另一方面,它可直接或间接抑制CTL 的浸润和杀伤功能,并增加其PD-1 的表达,诱导免疫耗竭从而促进肿瘤的进展[55]。事实上,VEGF 对重编程免疫抑制微环境的能力,主要通过控制血管通透性(渗漏)来实现。具体来讲,肝癌异常的血管渗漏可增加间质液压力,导致肿瘤内部缺氧和酸中毒,从而抑制效应细胞的抗肿瘤免疫,并促进了免疫抑制性细胞数量的增加,进而营造了免疫抑制微环境,最终促进肝癌的复发和转移[56]。由此可见,靶向血管生成的药物不仅能够抑制肿瘤的血管生成,同时也逆转免疫抑制微环境从而抑制肝癌进展。
然而,靶向治疗在控制肿瘤方面的效果欠佳。新近研究发现:低剂量的抗VEGF 治疗可使异常和功能失调的肿瘤血管系统正常化,从而改善肿瘤缺氧和酸中毒等恶劣微环境,重编程免疫抑制环境,进而抑制肿瘤的生长和转移;相反,高剂量的靶向药物治疗导致血管死亡,反而加重肿瘤缺氧和酸中毒,加剧了肿瘤的耐药和免疫耗竭,导致肿瘤的转移[56-57]。尽管靶向血管生成被认为是一种有效的肿瘤治疗策略,但其需要联合局部治疗或其他系统治疗才能更好地提高中晚期肝癌的疗效。
2.2.2 免疫治疗 免疫疗法是21 世纪肿瘤治疗领域中最具前景也是最重要的成果之一。研究表明,肿瘤细胞表面表达多种免疫抑制配体,与活化T 细胞的抑制受体结合,降低其抗肿瘤免疫反应的强度,从而逃避机体的免疫监视。阻断这些肿瘤免疫逃逸的靶点药物称为ICI,其作用靶点主要包括PD-1,PD-L1 和CTLA-4 等。目前,以ICI 为代表的免疫治疗在中晚期肝癌治疗中取得显著疗效。
纳武利尤单抗是在临床实践中使用的第1 种PD-1 靶向药物,2017 年首次用于索拉非尼治疗失败后的晚期肝癌患者。262 例HCC 患者中,20%的患者反应良好,其疾病控制率为64%,无进展生存期为4.0 个月,中位应答持续时间为9.9 个月。跟踪其长期疗效发现,总生存率在6 个月时为83%,9个月时为74%,明显高于其他二线非免疫治疗的药物。此外,该药物的耐受性良好,只有3%的受试者由于不良反应而停药[7]。另一种抗PD-1 靶向药物帕博利珠单抗也可有效治疗索拉非尼治疗失败的晚期肝癌,其客观缓解率和1 年生存率分别为17%和54%[58]。事实上,单一ICI 治疗晚期肝癌并不理想。多项临床试验表明,PD-1 抗体单药治疗晚期肝癌的总体生存时间(OS)与索拉非尼无显著性差异(见表1)。近年,ICI 在晚期肝癌的应用主要在联合治疗领域。
已证实,VEGF 通路在建立和维持肝癌免疫抑制微环境中发挥至关重要的作用[59]。结合肝癌丰富的血管生成这一特性,联合VEGF 和PD-1/PD-L1抑制剂的治疗策略很有可能改善晚期肝癌治疗效果。Ⅲ期临床试验(IMbrave-150)表明[60],相比于索拉非尼治疗,晚期肝癌患者接受阿替利珠单抗(PD-L1抑制剂)联合贝伐单抗(VEGF 抑制剂)治疗后,客观缓解率和无进展生存率均增加1 倍,总生存率提高了12%,且身体功能和生活质量等均有明显改善。因此,该联合疗法于2020 年被FDA 批准用于晚期肝癌的一线治疗。此外,仑伐替尼与帕博利珠单抗联合方案也被证实在治疗Ⅰb 期不可切除的肝癌患者中具有良好疗效[61]。2021 年,国家药品监督管理局也正式批准信达生物的创新PD-1 抑制剂达伯舒(信迪利单抗注射液)联合达攸同(贝伐珠单抗注射液),用于既往未接受过系统治疗的不可切除或转移性肝细胞癌的一线治疗[62]。新近研究表明:ICI 联合抗血管生成治疗可有效改善免疫抑制微环境,使肝癌血管正常化,进而促进药物进入肿瘤,最终达到治疗肿瘤的目的[63]。由此可见,肿瘤是免疫细胞与周围微环境互作的结果,靶向免疫正常化是治疗肝癌的关键策略。目前,免疫治疗联合抗血管生成治疗的方案正开展多项临床研究,有望成为晚期肝癌一线治疗手段。
此外,尽管ICI 单药治疗效果有限,其在联合治疗领域捷报频传。纳武利尤单抗联合伊匹木单抗治疗晚期肝癌患者的研究结果显示,相比于索拉非尼治疗,该联合疗法的客观应答率为32%(见表1),且超过30%患者的治疗效果可持续至少24 个月[4]。因此,美国FDA 在2020 年加速批准了纳武利尤单抗联合伊匹木单抗治疗晚期肝癌患者的二线治疗。肝癌患者一般经历“肝炎-肝硬化-肝癌”的过程,肿瘤在与免疫系统共进化的过程中形成了免疫抑制的微环境。而联合PD-1 抑制剂和CTLA-4 抑制剂,可有效激活T 细胞杀伤肿瘤,促使癌细胞发生免疫原性死亡,激活DC 等的抗原呈递功能,募集外周T 细胞向肿瘤浸润,改变原有的T 细胞亚群构成,重塑抗肿瘤免疫网络,最终达到促进肿瘤消退的目的[64];另外,过强的免疫原性死亡也会导致大量肿瘤抗原释放而引起免疫系统的过度激活。事实上,纳武利尤单抗联合伊匹木单抗治疗的晚期肝癌患者出现了较高比例的免疫相关不良事件,其中18%患者由于这些不良反应不得不终止试验[65]。因此,基于不同个体以及特定的治疗方案制定合适的辅助治疗能更好地提高免疫治疗的疗效。
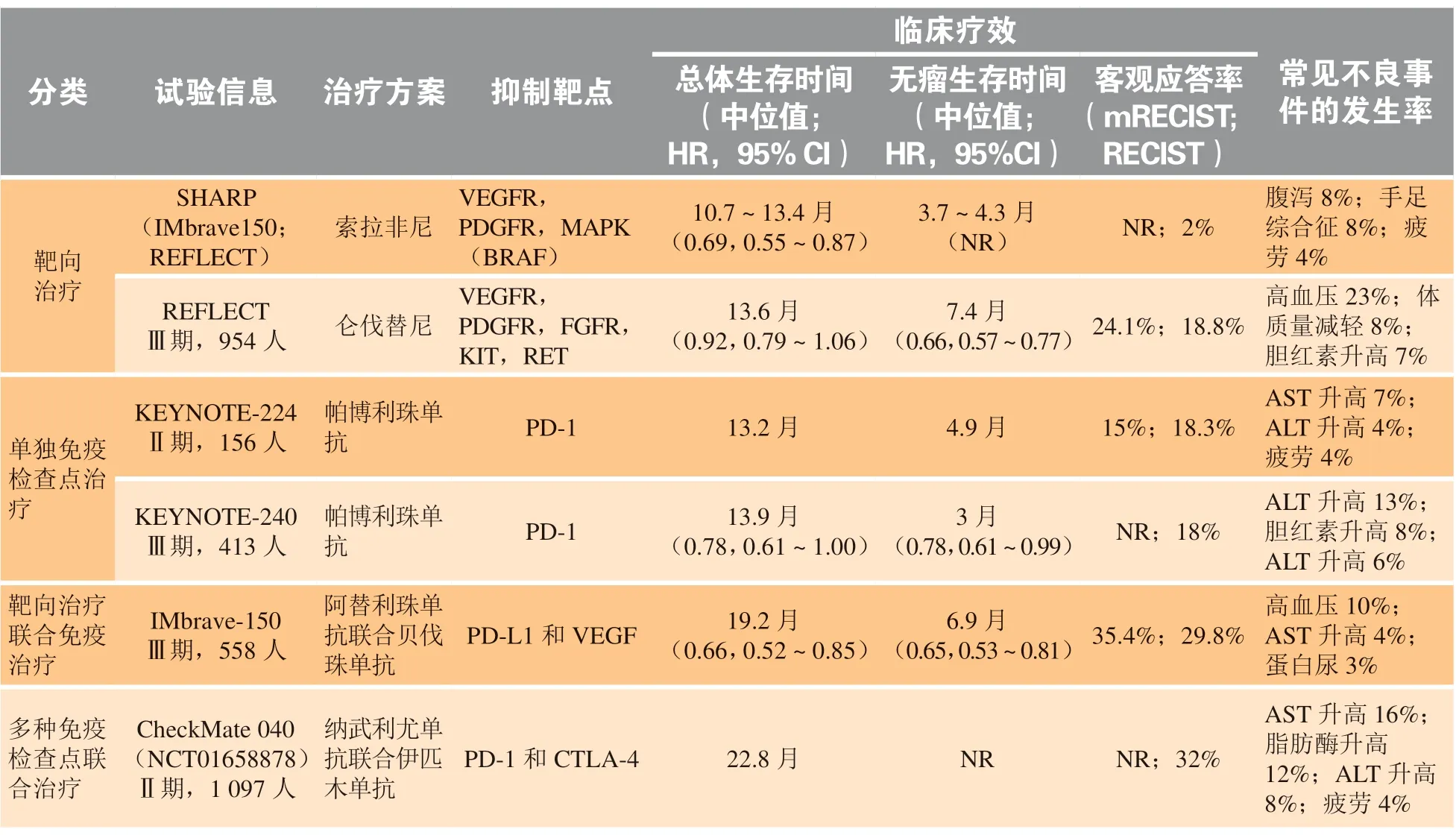
表 1 批准用于肝癌的系统疗法的临床特征和不良事件Table 1 Systemic therapies approved for hepatocellular carcinoma: patients’characteristics, outcomes, and adverse events
3 肝癌免疫新疗法
除了上述临床正在使用的肝癌疗法,还有许多具有潜力的免疫疗法正在被研究。这些新型免疫疗法已在临床前研究中被证实能有效激发抗肿瘤免疫,并最终达到控制肿瘤的目的。深入探讨这些疗法在体内的具体效应将为肝癌的临床治疗提供更多思路。
3.1 肿瘤疫苗
肝癌疫苗旨在诱导机体产生针对肝癌抗原的免疫应答,主要包括抗原肽疫苗和DC 疫苗。抗原肽疫苗是按照肝癌高表达的肿瘤相关抗原表位氨基酸序列化学合成的疫苗。Sun 等[66]总结了7 种在肝癌疫苗中常用的肿瘤相关抗原。总体看来,甲胎蛋白(α-fetoprotein,AFP)、磷脂酰肌醇聚糖3(glypican-3,GPC3)和多药耐药相关蛋白3 疫苗能诱导更多的抗原特异性T 细胞反应,但其临床结果并不令人满意。而纽约食管鳞状上皮癌抗原1(New York-esophageal squamous cell carcinoma 1,NY-ESO-1) 、滑 膜 肉瘤X 断裂点2、黑色素瘤抗原和端粒酶逆转录酶(telomerase reverse transcriptase,TERT)诱导抗原特异性T 细胞响应率较低,目前尚未进行临床研究。DC 疫苗就是通过体外制备负载肿瘤相关抗原的DC,并将这些细胞回输宿主来发挥抗肿瘤作用。临床研究表明,异体DC 疫苗可在73%的肝癌患者中产生特异性免疫反应[67]。然而,不管是抗原肽疫苗还是DC 疫苗,目前肝癌疫苗的临床试验缺乏令人满意的效果。这一方面受到肝癌的异质性的影响,另一方面也可能是因为肝癌中存在尚未被解析的免疫编辑机制。除了针对肿瘤相关抗原设计的疫苗,由肿瘤基因组突变产生的肿瘤特异性突变蛋白(新抗原)也是很有吸引力的疫苗靶标。尽管HCC 被认为是一种中度突变的肿瘤,但随着测序技术的发展,越来越多肝癌新抗原被鉴定出来,有望成为新的肝癌疫苗靶标[68]。患者个体化特异性的多靶点抗原肽疫苗或DC疫苗仍是治疗肝癌的一种有前途的策略。解除肿瘤免疫抑制的ICI 治疗与肿瘤疫苗联合治疗也将成为肝癌治疗的新策略。
3.2 过继性细胞疗法
过继性细胞疗法是将在体外进行基因工程修饰、激活并扩增的抗肿瘤免疫细胞后回输到患者体内,以期达到直接杀伤肿瘤或激发机体免疫应答来抑制肿瘤的目的。目前研究较多的有嵌合抗原受体T 细 胞(chimeric antigen receptor T-cells,CAR-T)治疗、T 细胞受体工程化T 细胞(T-cell receptor engineered T cells,TCR-T)治疗、嵌合抗原受体自然杀伤细胞(chimeric antigen receptor-natural killer cell,CAR-NK)治疗、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)治疗、CIK 治疗以及γδT 细胞治疗。
3.2.1 嵌合抗原受体T 细胞治疗 近年来CAR-T 在急性白血病和非霍奇金淋巴瘤的治疗上取得了显著的疗效,被认为是最有前景的肿瘤治疗方式之一。CAR-T 治疗是把能识别靶细胞的人工受体,通过基因工程修饰的方式表达到T 细胞上,并将这些改造后的T 细胞回输病人体内,从而达到杀伤靶细胞,治疗肿瘤的目的。目前在肝癌中CAR-T 治疗还处于实验研究阶段,其嵌合抗原受体靶向的目标包括GPC-3,CD133,NKG2D 和CD147 等在肝癌细胞
表面表达的肿瘤相关抗原。经典的CAR-T 是给T细胞装配识别肿瘤细胞表面分子的受体(嵌合抗原受体),这种抗原-嵌合抗原受体激活的方式使得CAR-T 具有不依赖主要组织相容性复合物(major histocompatibility complex,MHC)提呈抗原肽来活化的优势。但由于实体肿瘤的异质性、缺乏特异性靶点以及对肿瘤微环境的敏感性,CAR-T 治疗肝癌仍处于发展阶段。高通量测序背景下更加精准的抗原筛选加上改造内源性免疫检查点的方法可能是CAR-T 在实体瘤免疫治疗中有潜力的发展方向,如使用基因编辑系统破坏靶向GPC3 的CAR-T 细胞中的PD-1 的治疗策略[69]。
3.2.2 T 细胞受体工程化T 细胞治疗 尽管不依赖MHC 提呈抗原肽来特异地识别肿瘤,但CAR-T 无法识别肿瘤胞内或分泌出去的抗原,如肝癌相关抗原AFP。然而这种无法在细胞膜上表达的抗原可通过MHC 以抗原肽的方式呈递到胞膜上,从而可被T 细胞受体(T cell receptor,TCR)识别。TCR-T就是通过基因编辑技术将能特异性识别肿瘤抗原的TCR基因导入患者T 细胞内,使其表达外源性TCR,从而具有抗肿瘤的能力。例如Docta 等[70]鉴定出能识别人HLAA2/AFP158 特异性的TCR。此外,靶向GPC3,NY-ESO-1 及人端粒酶逆转录酶等肝癌相关抗原的TCR-T 也被考虑用在肝癌治疗中。与CAR-T 相似,目前在肝癌中研究较多的抗原在许多正常组织中也有低水平的表达,靶向这些抗原的TCR-T 治疗可能具有脱靶的毒性和副作用。因此,如何选择抗原、延长TCR-T 在体内的存活时间、增加TCR-T 在肿瘤的浸润及防止其耗竭是该领域亟待解决的问题。
3.2.3 嵌合抗原受体自然杀伤细胞治疗 CAR-NK 细胞与CAR-T 细胞原理类似:利用基因工程给NK 细胞加入能识别肿瘤细胞,并且能同时激活NK 细胞的嵌合抗体。与T 细胞依赖TCR 特异性识别抗原才能激活不同,NK 细胞属于固有免疫系统,其杀伤活性受细胞表面的杀伤抑制受体和杀伤活化受体的共同调控,当激活与抑制的平衡被打破,NK 细胞就可以行使相应的功能。加入嵌合抗原受体能显著提高NK 细胞的抗肿瘤能力,并在肿瘤治疗中显
示出良好的疗效。例如,GPC3 特异性及CD147 特异性的CAR-NK 细胞在肝癌治疗中都呈现出增强的抗肿瘤能力[71-72]。同时由于CAR-NK 细胞的寿命比CAR-T 短,还能一定程度地减少脱靶毒性。目前CAR-NK 细胞治疗主要的障碍是缺乏有效的基因导入方式。尽管利用逆转录病毒可以实现27%~52%的转导效率,但与逆转录病毒转导相关的插入突变和对NK 细胞活力的损害是该方法在临床应用最主要的限制因素[73]。
3.2.4 肿瘤浸润淋巴细胞治疗 TIL 治疗是在体外将肿瘤中分离出来的淋巴细胞加入IL-2 刺激增殖并回输患者体内。TIL 治疗的可行性在原发性肝癌患者的Ⅰ期临床试验中得到证实[74]。由于TIL 是从肿瘤标本中分离出来的,可以识别多种类型的抗原,因而其抑瘤作用优于针对单一抗原或突变的治疗方法。研究表明,HCC 中TIL 浸润量较低,但对肿瘤复发和患者预后却有显著影响[75]。与无明显淋巴细胞浸润患者相比,有明显淋巴细胞浸润的肝癌患者切除术后复发率降低而生存率升高[76]。然而,从肿瘤组织中分离TIL 并在体外扩增的难度限制了其在肝癌治疗中的广泛应用。
3.2.5 细胞因子诱导的杀伤细胞治疗 CIK 疗法是将人外周血单个核细胞在体外用多种细胞因子(anti-CD3,IL-2 和IFN-γ 等)培养后获得CD3+CD56+的T 细胞,并将该群T 细胞回输体内。这群细胞同时表达T 细胞标记CD3 和NK 细胞标记CD56,功能上既具有T 细胞的抗肿瘤活性也兼具NK 细胞的非MHC 限制性的优点,因此被认为是新一代抗肿瘤过继性细胞免疫治疗的首选方案。Lee 等[77]通过长期追踪试验证实CIK 治疗可有效延长HCC 患者的总体生存时间和无瘤生存时间。但也有研究认为CIK免疫治疗主要针对早期肝癌,而对晚期肝癌缺乏疗效。研究人员发现CIK 细胞可以增加肿瘤中免疫抑制细胞的浸润,从而抑制其抗肿瘤活性,因此靶向MDSC 是提高CIK 治疗疗效的有效策略[39]。此外,CIK 联合传统的肿瘤治疗方式,如经导管动脉栓塞化疗以及射频消融等,也能显示出一定的治疗优势[78-79]。这些发现表明CIK 免疫治疗可以提高肝癌患者的总体生存率并减少复发。
3.2.6 γδT 细胞治疗 通常用于制备CAR-T 疗法的细胞是适应性免疫系统的αβT 细胞。γδT 细胞属于先天免疫系统的一部分,其TCR 不需与MHC 结合,也不需要APC 的提呈,可以直接识别结合抗原分子并显示出更强的细胞毒性。γδT 细胞可以识别非肽抗原,如癌细胞中高表达的磷酸化代谢物。已报道肿瘤中γδT 细胞的浸润是患者预后良好的最佳预测指标,γδT 细胞治疗也是肝癌患者很有希望的细胞免疫治疗方案[80]。尽管γδT 细胞在临床试验中也显示出良好的安全性,但其临床疗效非常有限。特别是,这些细胞的功能状态受到杀伤活化受体和杀伤抑制受体信号的严格控制,因而极易受到微环境的抑制信号影响而发生耗竭。总体来说,γδT 细胞治疗是一个相对较新的研究领域,存在着一些自身挑战,但仍不失为一个值得探索的方向。
3.3 溶瘤免疫治疗
溶瘤免疫疗法利用溶瘤病毒能在肿瘤内复制并特异性攻击肿瘤的特点来抗肿瘤。除直接杀伤肿瘤细胞外,溶瘤病毒还可诱导长期有效的抗肿瘤免疫。在肿瘤微环境中,溶瘤病毒本身可以产生病原体相关分子被免疫细胞识别,另外溶瘤病毒还可增强肿瘤抗原的表达,并促进抗原特异性CTL 细胞浸润至肿瘤[81]。因此,溶瘤病毒治疗可能是克服肝癌免疫抑制的一种有效方法。此外,溶瘤免疫治疗还可以与多种免疫疗法联合使用,从而放大其抗肿瘤免疫反应,例如,将粒细胞-巨噬细胞集落刺激因子的过表达序列插入溶瘤病毒序列中,这些因子在外周招募髓样细胞,以增强肿瘤微环境中的免疫反应[82]。目前,溶瘤病毒JX-549 已进入肝癌临床研究阶段,更多的临床前研究也在紧密进行中。溶瘤免疫治疗有望在未来肝癌临床治疗中扮演举足轻重的角色。
3.4 联合免疫治疗
ICI 治疗是目前应用最广泛的免疫治疗方案,已在多种肿瘤的临床治疗中获得令人瞩目的成果。然而,其在肝癌中的临床缓解率仅不到20%[7]。事实上,肝癌处于复杂的免疫微环境中,单一免疫治疗方案无法有效恢复抗肿瘤T 细胞的功能,多靶点联合治疗成为肝癌免疫治疗未来发展的重点。如何进一步恢复和增强肿瘤特异性T 细胞的功能和反应是指导联合治疗的重要原则。肿瘤微环境中T 细胞的浸润构成了治疗响应的初始要求。然而,治疗所面临的一个难题是,相当部分肝癌呈现出低效应T细胞浸润的“沙漠型”免疫特征[83]。T 细胞在肝癌中的募集和维持依赖于Th1 型趋化因子,如CXCL9和CXCL10。然而,由于表观遗传改变,肿瘤细胞失去了表达Th1 趋化因子的能力[84]。因此,染色质修饰失调可能是肝癌免疫沙漠或免疫抑制微环境形成的关键因素,也提示靶向表观遗传重编程可能成为改善当前肝癌免疫治疗效果的策略。新近研究利用小鼠模型证实,废除EZH2 介导的组蛋白修饰和DNMT1 介导的DNA 甲基化可以显著提高肝癌PD-L1 治疗的效果[85]。值得注意的是,除了调控趋化因子的表达,表观遗传重编程也被报道能增强肿瘤抗原表达水平及解除内源性甲基化编程对T 细胞功能的限制,因而对恢复局部抗肿瘤T 细胞反应具有多重的正向调控作用[86]。肝癌临床免疫治疗将受益于对表观遗传调控机制进一步的深入研究。
其他免疫抑制分子的负反馈表达也是导致肝癌ICI 治疗无效的重要原因。在其他肿瘤的组学研究中,研究人员发现PD-1 抗体耐药患者TGF-β 信号通路显著激活[87]。双重靶向TGF-β 信号和PD-1 能有效恢复宿主免疫并抑制肿瘤的进展[88]。因此,具抗PD-1/TGF-β 双功能的融合蛋白目前已被开发并应用于多种晚期实体瘤的临床试验[89]。TGF-β 也是肝癌中重要的免疫逃逸和促肿瘤因素。联合TGF-β阻断的免疫治疗策略也应该在晚期肝癌的临床应用中考虑。此外,新近研究表明,经PD-1/PD-L1 抗体治疗的晚期肝癌患者中免疫检查点受体TIM-3 的表达也上调[90]。除了直接调节杀伤性T 细胞功能外,这些代偿分子还可通过动员Treg 和单核细胞样髓源抑制性细胞(monocytic myeloid-derived suppressor cells,M-MDSCs)引起继发性免疫抑制[90]。事实上,尽管改变模式不同,阻断任何单一的免疫检查点分子都会导致其他检查点通路的代偿性上调[91]。鉴于多层免疫调节限制了效应T 细胞的抗肿瘤功能,肝癌的临床治疗中应考虑多靶点的顺序联合靶向。尽管多靶点治疗方案目前大多处于临床前研究阶段,这些研究仍为肝癌的个性化精准治疗及治疗的可持续性效果提供了可靠的理论基础。
值得注意的是,并非所有肝癌患者都适用ICI治疗。一项对1 600 多名晚期HCC 患者进行PD-L1或PD-1 抑制剂试验的荟萃分析表明,免疫治疗不能提高NASH 相关HCC 患者的生存率,且PD-1 或PD-L1 抗体治疗的NASH 相关HCC 患者总体生存率比其他治疗方式的患者更低[92]。这提示非病毒性HCC,尤其是NASH-HCC,对免疫治疗的反应性可能较低。机制研究表明,NASH 相关的异常T 细胞激活会非特异引起组织损伤,进而导致免疫监测受损[92]。因此,全面评估不同背景、不同阶段肝癌的免疫微环境特征对治疗方式的选择及治疗方案的优化有着重要的意义。
4 结语
目前肝癌的临床治疗手段及疗效仍然有限。尽管传统的治疗方法可有效地解决局部病变,但肿瘤的彻底消灭最终依赖于机体免疫系统。新近关于肝癌免疫微环境的研究为理解治疗耐受机制,以及提出新的治疗方案提供了新的思路。免疫治疗在肝癌中的应用是一个新兴的研究领域,现已取代TKI 疗法成为晚期疾病的标准治疗。尽管单一免疫治疗存活率仍不理想,目前在肝癌临床一/二线研究进行的联合性系统治疗方案,以及局部治疗联合系统治疗的方案将有望改变目前肝癌治疗的现状。深入、全面地分析免疫微环境的组成和特点及其在治疗过程中的动态变化,将指导未来肝癌个性化组合治疗策略的制定。
