柔嫩艾美耳球虫EtMIC2蛋白重组枯草芽孢杆菌的构建与鉴定
2022-10-21刘嘉韵陈学秋阳毅敏潘灵韬赵明秀杜爱芳
刘嘉韵,陈学秋,阳毅敏,吴 飞,潘灵韬,赵明秀,王 钊,杜爱芳
(浙江大学 动物科学学院 浙江省动物预防医学重点实验室,浙江 杭州 310012)
鸡球虫病(coccidiosis)是艾美耳球虫寄生于鸡肠道所引起的一种原虫病,可导致家禽生长不良、生产性能下降,甚至死亡,对养禽业造成巨大的经济损失[1]。在世界公认的9种危害鸡的艾美耳球虫中,柔嫩艾美耳球虫(Eimeriatenella)最为常见,致病力最强,可导致雏鸡高病死率[2]。目前球虫病防控主要依靠预防性抗球虫药,但耐药性和药物残留问题日益突出,而活疫苗存在制作工艺繁琐、稳定性差且有散毒风险等问题[3]。因此,家禽养殖业亟需开发安全有效的新型抗球虫疫苗。
枯草芽孢杆菌作为肠道微生态平衡中的重要益生菌,可促进肠道有益菌生长,减少病原菌定植,维护肠道健康[4-5]。其在营养缺乏或其他胁迫条件下所形成的芽孢抗逆性极强且具免疫学特性[6]。目前,以芽孢为载体,通过芽孢表面展示技术研制新型口服重组蛋白疫苗是研究的热点。
微线体蛋白EtMIC2在球虫黏附入侵宿主过程中发挥着至关重要的作用[7],可作为阻断虫体入侵宿主细胞的候选抗原。已有研究表明,EtMIC2能作为抗原引发机体产生免疫应答,减轻鸡球虫感染后的盲肠损伤,减少卵囊排出量,具有良好的免疫保护效果[8-9]。
基于芽孢表面展示技术,构建表面展示鸡球虫抗原蛋白的重组枯草芽孢杆菌可为球虫病防控提供新的更加安全稳定有效的途径,因此本研究拟以CotB为锚定蛋白,通过同源双交叉重组实现柔嫩艾美耳球虫抗原EtMIC2在枯草芽孢杆菌芽孢表面的展示,以期为新型鸡球虫疫苗研发奠定基础。
1 材料与方法
1.1 细胞、菌株、质粒及卵囊TOP10感受态细胞、枯草芽孢杆菌WB800N菌株以及pDG364载体均为本实验室保存;柔嫩艾美耳球虫卵囊(豪顿株)由中国农业大学索勋教授惠赠,传代复壮后保存于本实验室。
1.2 主要试剂LA Taq酶体系、DNA Marker、各种限制性内切酶购自TaKaRa;DNA凝胶回收试剂盒、质粒提取试剂盒购自Axygen;细菌基因组DNA提取试剂盒购自天根生化科技有限公司;溶菌酶和氯霉素购自生工生物工程(上海)股份有限公司;营养肉汤培养基购自索莱宝公司;FLAG兔单抗购自Cell Signaling Technology;山羊抗兔IgG(H+L)-HRP、山羊抗兔IgG(H+L)-FITC和蛋白Marker购自弗德生物科技有限公司;2.5%戊二醛、缓冲液、乙醇购自国药集团化学试剂公司;饿酸购自SPI-CHEM公司。
1.3 引物设计根据GenBank数据库中的EtMIC2基因序列(登录号:AF111839.1)和枯草芽孢杆菌168基因组(登录号:CP053102.1)中CotB及其启动子区的基因序列,设计特异性扩增引物,其中EtMIC2基因去掉信号肽序列并在下游引入1×FLAG标签和EcoR Ⅰ酶切位点,在CotB启动子区上游引入BamH Ⅰ酶切位点,并根据同源臂两侧序列设计特异性鉴定引物amyE-F和amyE-R,引物由生工生物工程(上海)股份有限公司合成,序列信息见表1。
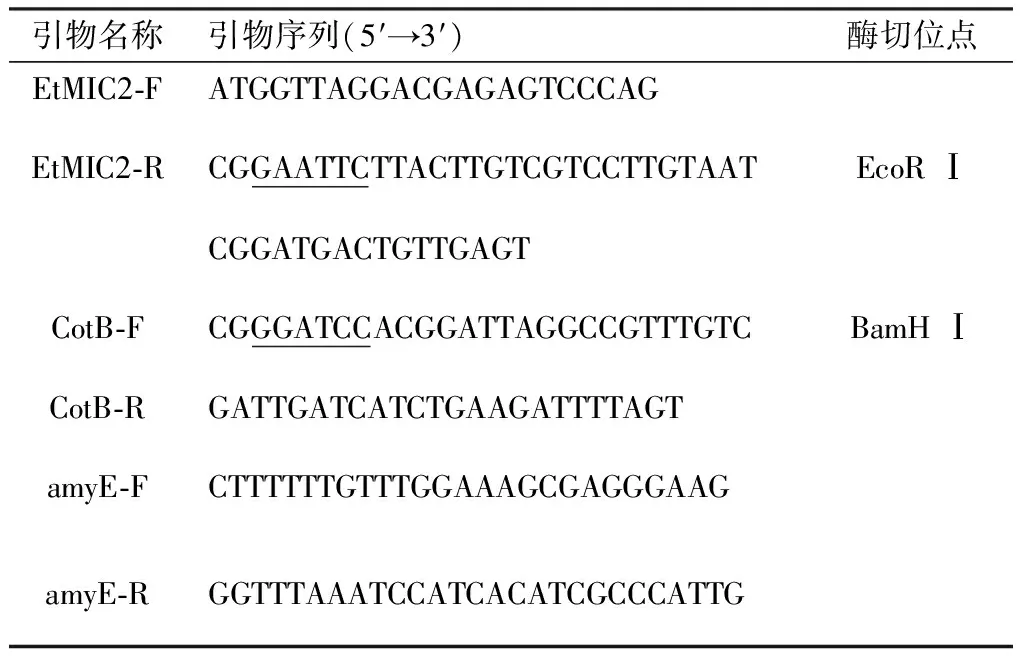
表1 引物序列
1.4 目的基因EtMIC2的扩增以柔嫩艾美耳球虫子孢子cDNA为模板,以EtMIC2-F和EtMIC2-R为引物,PCR扩增EtMIC2基因。反应条件:95℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,循环扩增30次;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定正确后,按照DNA凝胶回收试剂盒操作说明书回收纯化EtMIC2基因。
1.5 表达EtMIC2基因的整合型重组质粒的构建及鉴定提取枯草芽孢杆菌WB800N菌株基因组,以基因组为模板,利用引物CotB-F和CotB-R通过PCR扩增芽孢衣壳蛋白基因CotB片段,其中包括263 bp的启动子和825 bp的部分N端编码序列。将其与目的基因EtMIC2通过重叠PCR技术,得到融合基因片段CotB-EtMIC2,最后通过无缝克隆技术将其与载体pDG364进行连接、转化至E.coliTOP10感受态细胞。次日挑取阳性克隆进行PCR检测、质粒双酶切鉴定和基因测序验证,将鉴定正确的整合型重组质粒命名为pDG364-CotB-EtMIC2。
1.6 重组枯草芽孢杆菌rBSCotB-EtMIC2的构建及基因组PCR鉴定将提前制备好的枯草芽孢杆菌感受态细胞置于冰上,融化后加入经Kpn Ⅰ单酶切的线性化重组质粒pDG364-CotB-EtMIC2,充分混匀后冰浴10 min,再转入预冷的1 mm电转杯中,电转电压设为2 400 V,电转时间为4.6~5.0 ms,电击1次后,立即加入1 mL RM培养基,置于37℃、200 r/min条件下振荡培养3 h,随后涂布于含氯霉素抗性的LB平板,37℃条件下倒置培养过夜。挑选单克隆扩大培养后提取基因组为模板,同时以枯草芽孢杆菌WB800N基因组为阴性对照,用鉴定引物amyE-F和amyE-R扩增验证正确后送至测序,将鉴定正确的重组菌命名为rBSCotB-EtMIC2。
1.7 重组芽孢的制备与纯化将PCR鉴定正确的重组菌rBSCotB-EtMIC2单克隆于LB培养基中过夜培养,再以1∶100转接入DSM培养基,在37℃恒温振荡培养箱中200 r/min培养72 h。将菌体离心去上清,用无菌去离子水洗涤沉淀3次,并用去离子水重悬。加入终质量浓度为0.002 g/L的溶菌酶,37℃水浴2 h,再用1 mol/L无菌氯化钠和1 mol/L无菌氯化钾各洗涤1次,最后用无菌去离子水重悬,得到芽孢悬浮液。
1.8 重组芽孢Western blot鉴定将芽孢悬浮液以8 000 r/min,离心10 min,弃上清,用1 mL SDS-DTT溶液重悬,37℃水浴2 h后,以8 000 r/min,4℃离心10 min,用0.05 mol/L Tris-HCl洗涤3次,最后用裂解液(0.05 mol/L Tris-HCl,0.5 mol/L EDTA)悬浮,置于冰上超声破碎(功率300 W,工作2 s,间隔4 s)15 min,以8 000 r/min,4℃离心10 min,上清即为芽孢衣壳蛋白提取液。吸取上清制样,以FLAG兔单抗(工作浓度1∶2 000)为一抗,以HRP标记的山羊抗兔IgG抗体(工作浓度1∶5 000)为二抗,进行Western blot鉴定。
1.9 重组芽孢免疫荧光检测收集培养好的重组芽孢rBSCotB-EtMIC2和WB800N芽孢,固定于载玻片上,滴加含1%BSA的封闭液,37℃封闭1 h。以FLAG兔单抗(工作浓度1∶500)为一抗,4℃孵育过夜,用PBS洗3次后,以FITC标记的山羊抗兔IgG抗体(工作浓度1∶1 000)为二抗,37℃避光孵育1 h,用PBS洗3次后,利用免疫荧光显微镜观察芽孢表面的荧光情况。
1.10 扫描电镜分析收集芽孢置于1 mL 2.5%戊二醛中,4℃固定过夜后,弃去固定液,用0.1 mol/L PBS漂洗3次,再用1%饿酸固定1~2 h,PBS漂洗3次后,依次用梯度浓度30%,50%,70%,80%,90%,95%,100%的乙醇溶液进行脱水处理,在临界点干燥,镀膜后,扫描电子显微镜观察。
2 结果
2.1 目的基因EtMIC2与CotB的扩增从柔嫩艾美耳球虫和枯草芽孢杆菌基因组中分别扩增EtMIC2基因和芽孢衣壳蛋白编码基因CotB及其启动子区的基因序列,扩增产物经琼脂糖凝胶电泳分析可见在约993 和1 088 bp处有清晰条带(图1),与预期结果相符。
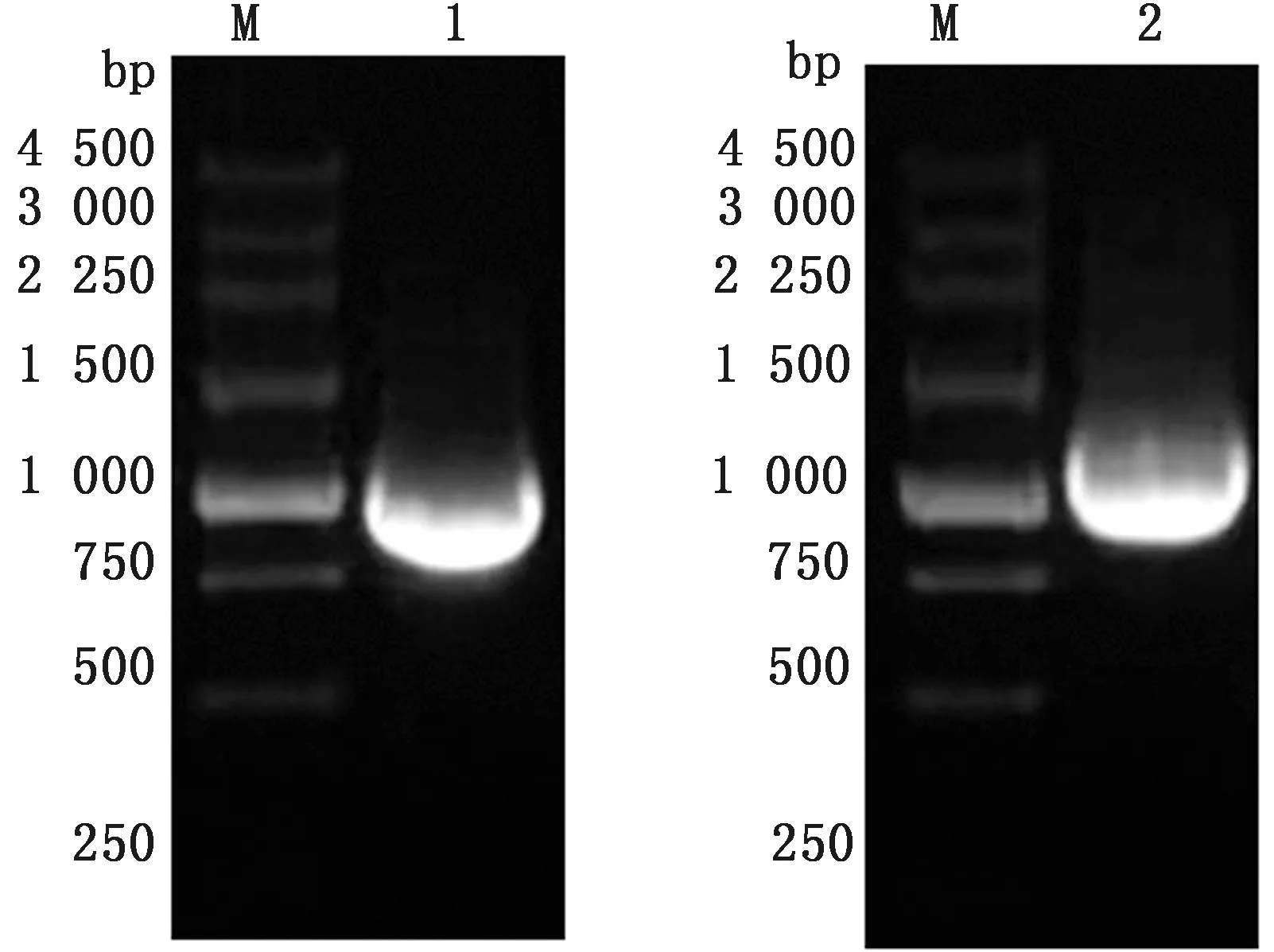
M.DL5000 DNA Marker;1.CotB基因片段;2.EtMIC2基因片段
2.2 整合型重组质粒pDG364-CotB-EtMIC2的鉴定用BamH Ⅰ和EcoR Ⅰ对重组质粒pDG364-CotB-EtMIC2进行双酶切,经琼脂糖凝胶电泳分析可观察到约6 268 bp的pDG364条带与2 081 bp的CotB-EtMIC2融合基因条带(图2),与理论值相符,序列测定结果显示无基因突变和移码,说明融合基因已成功克隆至表达载体中。
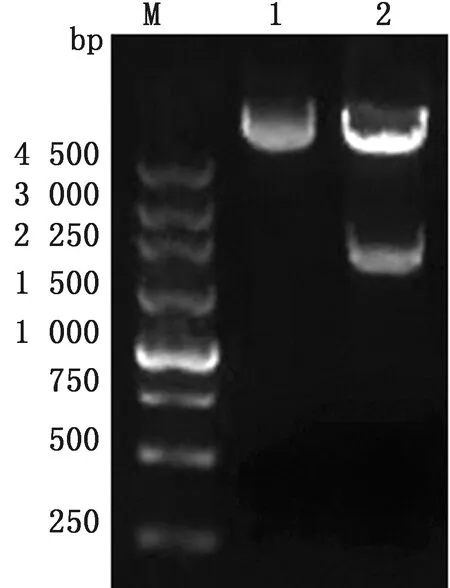
M.DL5000 DNA Marker;1.pDG364对照;2.pDG364-CotB-EtMIC2酶切产物
2.3 重组枯草芽孢杆菌基因组PCR验证以重组菌rBSCotB-EtMIC2基因组为模板,用特异性鉴定引物进行PCR验证,产物经过1%琼脂糖凝胶电泳鉴定,结果显示,WB800N阴性对照组出现了与理论值2 556 bp 大小相似的特异性扩增产物,而重组枯草芽孢杆菌由于CotB-EtMIC2融合基因以及氯霉素抗性基因的插入,得到约5 674 bp的特异性条带(图3),测序结果显示融合基因无突变且正确整合于amyE基因位点。

M.DL10000 DNA Marker;1.WB800N;2.重组菌rBSCotB-EtMIC2
2.4 Western blot 分析提取重组芽孢rBSCotB-EtMIC2芽孢蛋白,以WB800N芽孢蛋白为阴性对照,进行Western blot鉴定,结果显示重组芽孢rBSCotB-EtMIC2在约65 kDa处有特异性条带(图4),与目的大小相符,而WB800N无条带,表明重组芽孢成功表达CotB-EtMIC2融合蛋白。

M.蛋白Marker;1.重组芽孢rBSCotB-EtMIC2;2.WB800N芽孢
2.5 间接免疫荧光检测对纯化后的重组芽孢rBSCotB-EtMIC2进行免疫荧光分析,利用荧光显微镜观察CotB-EtMIC2蛋白表达情况,结果显示,与阴性对照WB800N相比,重组芽孢表面可检测到明显的特异性绿色荧光信号(图5),表明融合蛋白成功表达并可展示于芽孢表面。

BF.白光图;IF.荧光图
2.6 扫描电镜分析为确定CotB-EtMIC2蛋白的表达是否影响芽孢结构,用扫描电镜观察重组芽孢表面形态,结果显示,与WB800N芽孢相比,重组芽孢rBSCotB-EtMIC2外壳、褶皱、形态和大小均无明显表观形态学变化(图6)。

图6 重组芽孢rBSCotB-EtMIC2扫描电镜分析
3 讨论
EtMIC2蛋白作为球虫入侵过程中的关键蛋白,常被用为鸡球虫疫苗研究的免疫靶点。目前已有众多研究表明,利用EtMIC2抗原制备的疫苗能刺激机体免疫应答,对鸡球虫病感染起到良好的免疫保护效果。李蕴玉等[8]构建的重组IL-2-EtMIC2 DNA疫苗可显著提高机体的细胞与体液免疫水平及抗氧化能力,具有抗球虫的效果。DING等[9]构建的pcDNA-EtMIC2 DNA疫苗还能产生对堆型艾美耳球虫的交叉免疫力,有效减轻鸡肠道病变、减少盲肠卵囊数、提高相对体质量增率等。HUANG等[10]将EtMIC2蛋白锚定在植物乳杆菌NC8菌株的表面,免疫鸡群后结果显示,该重组菌株增加了CD4+和CD8+T淋巴细胞的百分比,IL-2细胞因子、IgG及SIgA抗体水平均显著上升。由此可见,EtMIC2是极具应用前景的候选抗原,可以作为鸡球虫疫苗研发的候选基因。
枯草芽孢杆菌表达系统因其在分泌和表达蛋白上的优势,已被广泛用作黏膜疫苗载体。余东游等[11]研究表明,表达3-1E抗原基因的重组枯草芽孢杆菌对肉鸡抗球虫病具有一定的保护效果。近年来,由于其芽孢独特的结构和生理特性,芽孢表面展示技术迅猛发展,以枯草杆菌芽孢载体为基础的呈递型疫苗已经成为研究的热点。ISTICATO等[12]首次利用芽孢外衣壳蛋白CotB作为锚定蛋白,将破伤风毒素的C片段(TTFC)成功地展示在芽孢表面。SUN等[13]以CotC为锚定蛋白在芽孢表面成功展示CsPmy华支睾吸虫副肌球蛋白,以此制备的疫苗可显著提高小鼠血清和肠黏液特异性IgG水平以及粪便和胆汁中的SIgA水平,产卵率明显降低,发挥了良好的免疫效果。PHAM等[13]研究发现,通过连续饲喂表面展示VP28蛋白的重组枯草杆菌芽孢可大大提升黑虎虾对白斑综合征病毒的抵抗力。表面锚定的优点在于异源蛋白能更好地与黏膜接触,有助于激发机体的免疫反应,本试验亦通过CotB将异源抗原表达在芽孢表面,以提高递呈效力,荧光检测结果充分证明了其良好的表面展示能力。此外,作为重要的益生菌,枯草芽孢杆菌还具有许多益生特性,可通过竞争性排斥病原菌定植,刺激宿主黏蛋白分泌[15],激活免疫反应等途径增强抗球虫感染的能力,抵御球虫入侵,防止球虫病继发感染。
综上所述,鉴于枯草芽孢杆菌表面展示系统具有以上优势,本研究将枯草芽孢杆菌锚定蛋白CotB与柔嫩艾美耳球虫EtMIC2抗原融合表达构建重组质粒,通过同源重组将外源基因整合到枯草芽孢杆菌基因组中,成功制备了表面展示EtMIC2抗原蛋白的重组芽孢。下一步将开展鸡体动物试验,研究其对球虫的攻毒保护效力,为研发高效、安全、热稳定性强的新型口服球虫黏膜疫苗打下良好的工作基础。
