超低剂量平扫CT 深度学习图像重建评价肺部病灶的可行性
2022-10-21赵珂珂蒋蓓蓓王凌云张亚平解学乾
赵珂珂,蒋蓓蓓,张 璐,王凌云,张亚平,解学乾
上海交通大学医学院附属第一人民医院放射科,上海 200080
实体肿瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)是目前临床常用的评价肿瘤疗效的标准,其基本方法是根据医学影像图像中病灶直径的变化来评价疗效。根据RECIST 标准,肺靶病灶长径和淋巴结靶病灶短径是判断肿瘤进展程度的主要指标[1]。CT 增强扫描图像质量高,而且应用范围广,是评价肺部肿瘤的首选检查方法。虽然胸部CT 检查在肿瘤诊断中有重要价值,但辐射风险仍有争议[2]。由于肿瘤疗效评价需要反复CT 扫描,每次低剂量或常规剂量胸部CT 检查,其有效吸收剂量为1.5~7 mSv[1,3-4]。PERISINAKIS 等[5]认为重复CT 检查可能增加肺癌的风险。对于潜在的辐射危害,减少辐射剂量可以降低其风险。
人工智能技术的不断发展促进了超低剂量CT 技术在大幅度降低辐射剂量的同时,保证了图像质量[6]。在一项前瞻性研究[7]中,我们首次利用深度学习图像重建(deep learning image reconstruction,DLIR) 技术将胸部CT 辐射剂量降低至0.07~0.14 mSv,较现有CT 检查降低91%~95%,同时保证了图像质量和肺结节检出率。SHIRI 等[8]利用卷积神经网络重建超低剂量CT 图像,在辐射剂量降低89% 的情况下能准确地诊断新型冠状病毒肺炎(corona virus disease 2019,COVID-19)。
目前临床上常用低剂量或常规剂量增强CT 来评价肺部肿瘤。虽然DLIR 和CT 技术的发展极大地降低了辐射剂量,但是目前尚没有研究利用超低剂量平扫CT 来评价肺部靶病灶。因此,本研究根据RECIST 标准,以低剂量胸部增强CT 为参考测量方法,探讨使用超低剂量胸部平扫CT 评价基于RECIST 的肺部靶病灶和直径≤1 cm 磨玻璃结节(ground glass nodule,GGN)的可行性。
1 对象与方法
1.1 研究对象
在图像存储与传输系统(picture archiving and communication system,PACS)中,对2020 年4 月—6 月符合纳入标准的病例进行回顾性检索。纳入标准:①年龄≥18 岁。②曾行胸部超低剂量CT 平扫和低剂量增强CT 检查。③有符合RECIST 标准的可测量靶病灶(非淋巴结靶病灶长径≥10 mm,淋巴结靶病灶短径≥15 mm)或直径≤1 cm 的GGN。排除标准:①呼吸或运动伪影造成图像质量不佳。②体质量指数(body mass index,BMI)≥30 kg/m2。根据世界卫生组织推荐的BMI 分类标准,BMI<18.5 kg/m2为偏瘦,BMI≥18.5 且<25.0 kg/m2为正常,BMI≥25.0 kg/m2为超重[9]。
1.2 CT扫描参数与图像重建
所有患者均采用256 排CT(Revolution CT,GE医疗)进行胸部超低剂量CT 平扫和低剂量增强CT扫描。患者取仰卧位,双臂上举,吸气后屏气进行扫描。超低剂量胸部CT平扫的扫描参数为:螺旋扫描,探测器准直宽度0.625 mm×128,螺距0.992,球管电压70 kV,重建图像矩阵512×512,图像显示视野350 mm。根据患者体型,每例患者的球管电流设置为20 mA 或40 mA,其吸收剂量分别为0.07 mSv 或0.14 mSv。低剂量增强CT扫描的球管电压为120 kV,球管电流根据噪声指数20 自动设置,其余扫描方案与超低剂量平扫相同。在增强扫描前,从肘前静脉以3.0~4.0 mL/s 的速度注射40~60 mL 造影剂碘普罗胺300(Iopamiro 300,Bracco)。
每例患者重建4 组CT 图像,包括3 组超低剂量CT 图像,分别为80%强度多模型自适应统计迭代重建(adaptive statistical iterative reconstruction-V with an 80% strength level,ASIR-V-80%)、中 等 强 度DLIR 重建(DLIR of moderate strength,DLIR-M)和高强度DLIR 重建(DLIR of high strength,DLIR-H),以及1 组ASIR-V-50%的增强CT 图像。增强CT 图像作为评价靶病灶大小测量的参考图像。所有图像均采用标准内核进行重建,重建图像的层厚和层距均为1.25 mm。
1.3 DLIR的基本原理
DLIR 引擎根据输入正弦图,从低剂量原始数据集生成临时输出图像。参考图像为滤波反投影重建(filtered back projection,FBP)的高质量标准剂量图像。通过深度学习方法,比较临时输出图像和参考图像的成像特征,发现两者在噪声纹理、低对比度空间分辨率、高对比度空间分辨率以及其他度量方面的相似性和差异性。然后,基于相似性和差异性,采用嵌入式反向传播技术对网络参数进行微调。通过迭代训练直到输出图像精确匹配参考图像为止。DLIR 引擎通过FBP重建的高质量标准剂量图像训练深度神经网络(deep neural network),学习如何从信号中区分噪声,并在不影响显示解剖和病理结构的情况下智能地抑制噪声[10]。DLIR 重建有低、中、高3 种强度,指使用深度学习算法介入图像处理的程度;在高等强度下,深度学习对生成图像的影响最大[11-12]。
1.4 图像处理与测量
根据RECIST 标准,病灶的测量评价可以由一位阅片人首先独立完成,然后由一位仲裁人判定是否可用[7]。为了模拟上述独立测量评估过程,在对所有图像随机排序后,由一位有3 年影像学经验的阅片人独立在ASIR-V-80%、DLIR-M、DLIR-H 和增强CT重建图像上测量靶病灶,并由一位有21 年影像学经验的仲裁人确认。靶病灶主要为肺内肿块、结节、空洞、转移灶和肿大的淋巴结。阅片人和仲裁人使用PACS 读片软件(TView,卫宁健康)读片,测量肺部靶病灶的长径和淋巴结靶病灶的短径。根据RECIST 标准,每例患者最多可以选择5 个靶病灶,每个器官最多2个靶病灶。
为了评价超低剂量CT 图像测量的观察者内部一致性(intra-observer agreement),同一位阅片人在第1 次评价1 个月后,在DLIR-M 和DLIR-H 重建图像中各随机抽取15 个肺部靶病灶、15 个淋巴结靶病灶和15个GGN,进行第2次测量。
另外,使用图像处理软件(MatLab 2021a,MathWorks)对肺实质组织和体外背景进行三维图像分割,评价三维感兴趣区的图像噪声,表示为CT 值的标准差。
1.5 统计学方法
使用MedCalc 20.0统计软件包进行数据分析。正态分布的定量资料采用表示。患者基本信息采用成组t检验或χ2检验进行比较。为了判断DLIR-M 和DLIR-H 重建图像测量的可重复性,采用组内相关系数(intraclass correlation coefficient,ICC)分析重复测量值。为了评价靶病灶在超低剂量CT 和增强CT上测量值的相关性,采用Pearson 相关系数分别分析ASIR-V-80%、DLIR-M 和DLIR-H 重建图像测量值与增强CT 测量值。为了评价超低剂量CT 和增强CT 对靶病灶测量值的差异性,采用Bland-Altman 方法对ASIR-V-80%、DLIR-M 和DLIR-H 重建图像测量值与增强CT测量值分别进行分析。为了分析超低剂量CT与增强CT 测量差异性的影响因素,以测量值差值为因变量,以BMI、年龄、性别、CT 剂量、靶病灶类型和病理结果为自变量,进行多元线性回归分析;其中BMI 和年龄是连续性数据,性别(男=1,女=0)、CT 剂量(0.07 mSv=0,0.14 mSv=1)、靶病灶类型(肺部靶病灶=0,淋巴结=1)、病理性质(良性+未知=0,恶性=1)是二分类数据。P<0.05 表示差异具有统计学意义。
2 结果
2.1 患者基本信息
如表1所示,共80例患者符合入组标准,平均年龄(62±11)岁,其中男性54 例(67.5%),女性26例(32.5%);平均BMI 为(22.72±3.34)kg/m2,其中7 例偏瘦,57 例正常,16 例超重。这80 例患者共发现80 个靶病灶和27 个直径≤1.0 cm 的GGN。靶病灶中包括肺部靶病灶54个(67.5%)和淋巴结靶病灶26 个(32.5%)。在所有的肺部靶病灶中,恶性肺部靶病灶共28 个(51.9%),包括转移瘤4 个、肺腺癌18 个、肺鳞癌2 个、肺腺鳞癌1 个、大细胞神经内分泌癌3个;良性和病理结果未知的肺部靶病灶共26个(48.1%),其中良性4 个、病理结果未知22 个。淋巴结靶病灶中肺门淋巴结9个、非肺门淋巴结17个;所有淋巴结包括16 个恶性、2 个良性和8 个病理结果未知。肺部靶病灶和淋巴结靶病灶在不同重建图像上的测量值差异的代表性病例分别如图1、2所示。

图1 可测量肺部靶病灶在不同重建图像上的测量值Fig 1 Measured values of lung target lesions in different image reconstruction kernels

表1 入组患者基本特征Tab 1 Basic characteristics of the included patients
2.2 图像质量评价
增强CT 图像的平均肺组织噪声为(46±4)Hu。在超低剂量CT 图像中,ASIR-V-80%、DLIR-M 和DLIR-H 重建图像的噪声分别为(53±4)Hu、(54±4)Hu 和(51±4)Hu。增强CT 图像的平均空气背景噪声为(22±4)Hu,ASIR-V-80%、DLIR-M 和DLIR-H重建图像的空气背景噪声分别为(29±4)Hu、(27±4)Hu 和(23±4)Hu。在超低剂量CT 重建图像中,DLIR-H的肺组织噪声和背景噪声最低。
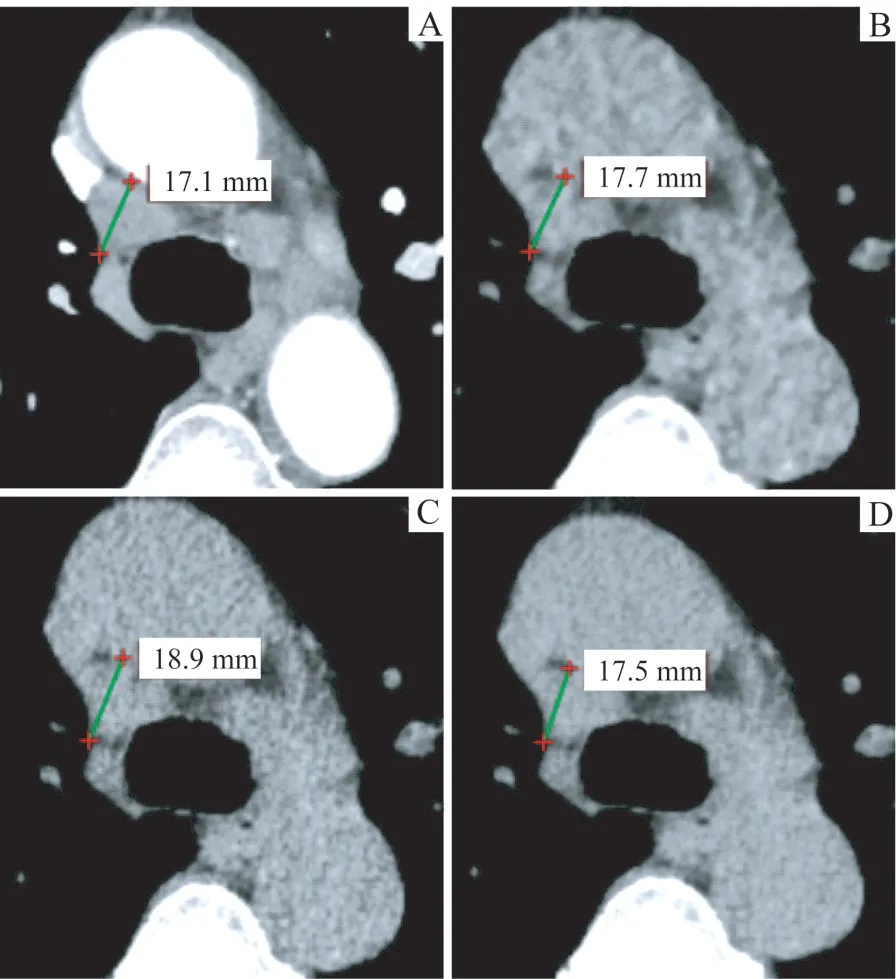
图2 可测量淋巴结靶病灶在不同重建图像上的测量值Fig 2 Measured values of lymph node target lesions in different image reconstruction kernels
2.3 超低剂量CT靶病灶测量的可重复性
DLIR-M 重建图像中肺内病灶测量的ICC为0.995(95%置信区间:0.985~0.998),淋巴结病灶的ICC为0.986(0.964~0.995),直径≤1 cm 的GGN 的ICC 为0.998(0.994~0.999)。DLIR-H 重建图像中肺内病灶测量的ICC 为0.992(0.957~0.998),淋巴结病灶的ICC 为0.979(0.941~0.992),直径≤1 cm 的GGN 的ICC 为0.994(0.983~0.998)。超低剂量CT 靶病灶测量具有很高的重复性。
2.4 超低剂量CT测量值与增强CT的相关性
如表2 所示,超低剂量CT 图像ASIR-V-80%、DLIR-M 和DLIR-H 重建的测量值与增强CT 的图像测量值呈现高度相关(均P=0.000)。
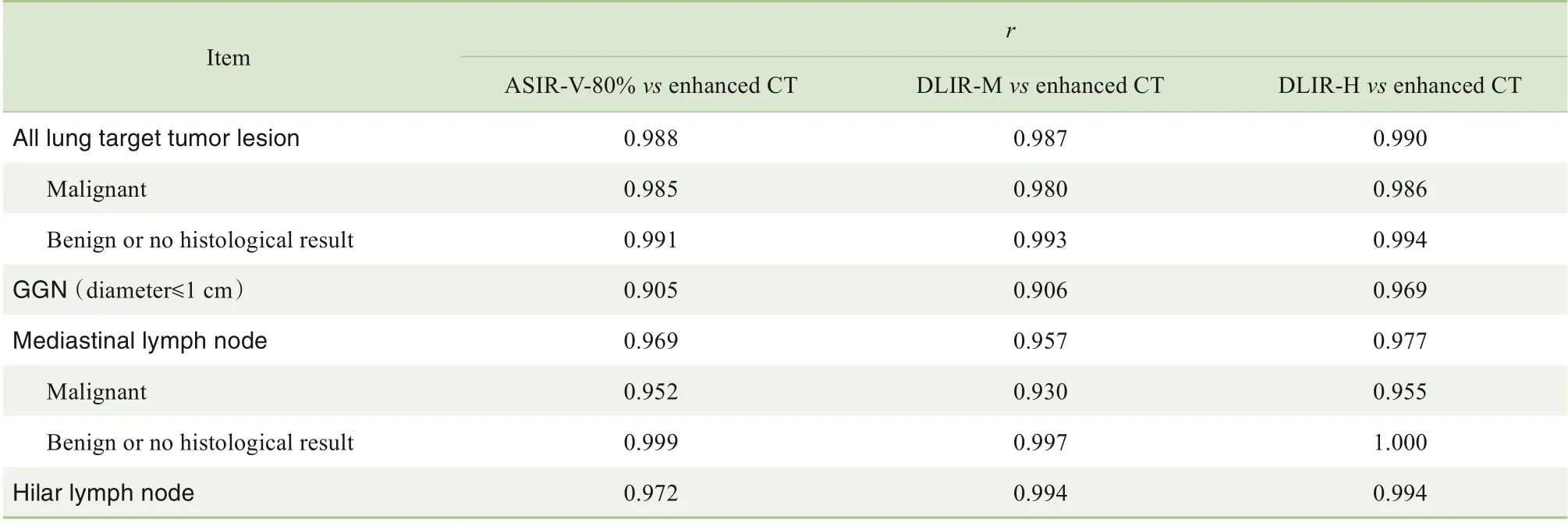
表2 超低剂量CT靶病灶测量值与增强CT测量值的Pearson相关系数Tab 2 Pearson's correlation coefficients of target lesions measured on ultra-low-dose CT and enhanced CT images
2.5 超低剂量CT 靶病灶测量值与增强CT 的差异性
Bland-Altman分析(表3)显示,DLIR-H图像的肺部靶病灶测量值与增强CT 的差异均在5%以内,ASIR-V-80%和DLIR-M 图像的测量值与增强CT 差异较大,结果均有统计学意义(均P<0.05)。在超低剂量CT 的3 种重建方式中,DLIR-H 图像的测量值与增强CT 的差异性最小。典型的肺部靶病灶和非肺门淋巴结Bland-Altman点图如图3所示。
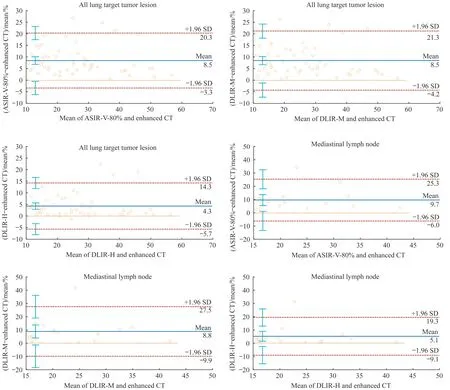
图3 超低剂量CT靶病灶测量值与增强CT测量值差异性的Bland-Altman点图Fig 3 Bland-Altman analysis of the variability of measured values of target lesions on ultra-low-dose CT and enhanced CT images
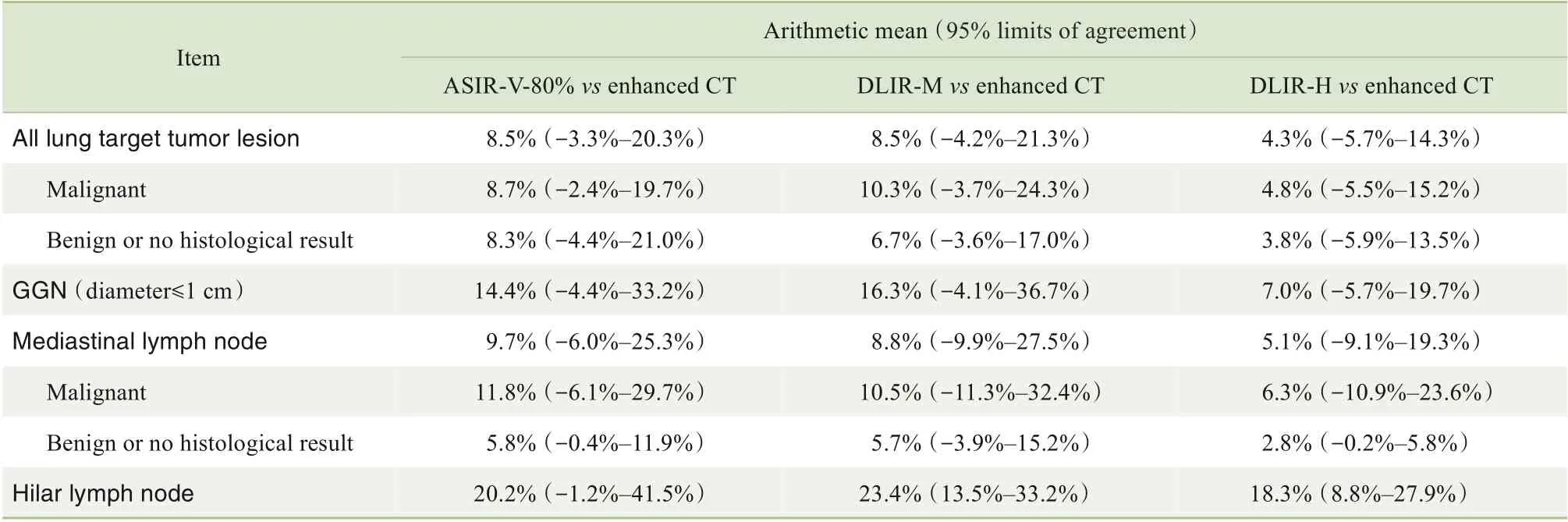
表3 超低剂量CT靶病灶测量值与增强CT测量值差异性的Bland-Altman分析Tab 3 Bland-Altman analysis of the variability of measured values of target lesions on ultra-low-dose CT and enhanced CT images
2.6 超低剂量CT 测量值与增强CT 测量值之差的影响因素
多元线性回归结果(表4)显示,在DLIR-M 和DLIR-H 图像中,测量值差值与病灶类型显著相关(P<0.05)。在排除了肺门淋巴结后,测量值差值与病灶类型无显著相关性(P>0.05)。3 种超低剂量重建图像与增强CT 测量值差值与BMI、年龄、性别、CT剂量、病灶病理性质均无显著相关性(P>0.05)。

表4 超低剂量CT靶病灶测量值与增强CT测量值差值影响因素的多元线性回归分析Tab 4 Multiple linear regression analysis of the influential factors on the differences between the measured values of ultra-low-dose CT and enhanced CT of target lesions
3 讨论
本研究发现,传统迭代重建(ASIR-V-80%)、DLIR-M 和DLIR-H 重建超低剂量CT 图像中的靶病灶测量值与增强CT 测量值都高度相关。深入的Bland-Altman 分析显示,在3 种重建方式中,DLIR-H 重建超低剂量CT 图像与增强CT 的差异最小,对于肺部靶病灶和淋巴结靶病灶,测量直径的差异仅分别为4.3%和5.1%。虽然DLIR算法具有良好的图像噪声和信噪比,但是病灶边缘上升距离和衰减偏度高,导致空间分辨率降低,图像失真增大,因此病灶直径测量值偏大[13]。
虽然迭代重建是目前低剂量CT 图像重建的常用方法,但我们的研究发现在超低剂量条件下,DLIRH 重建图像的靶病灶测量结果更接近增强CT 参考标准。这是因为在超低剂量条件下,DLIR 重建的整体图像质量显著优于ASIR[11]。JENSEN 等[14]研究了DLIR 算法在腹部CT 图像中显示肿瘤的价值,发现DLIR较标准ASIR-V重建图像能提高腹部肿瘤的图像质量。例如,DLIR-H 图像比ASIR-V-30%图像的噪声降低了47%,对比度-噪声比增加了92%~94%,从而提高了肿瘤诊断的可信度。BENZ 等[15]学者对低剂量冠状动脉CT 血管造影中DLIR 和ASIR-V 的图像噪声进行比较,发现DLIR-M 和DLIR-H 的图像质量评分(分别为3.4~3.8 和4.2~4.6) 均高于ASIR-V(1.8~2.2)。NODA 等[16]评价了DLIR 重建低剂量门静脉期全身CT 的图像质量和肿瘤检测能力,发现DLIR 在辐射剂量降低75%的条件下,与迭代重建标准剂量CT 的图像质量、病灶检出率和信噪比相似。JENSEN 等[17]评价了使用DLIR 重建低剂量CT 图像对肝脏转移和良性局灶性病变的检测能力,发现DLIR 能够有效检出大于0.5 cm 的肝脏病变。在本研究的超低剂量扫描条件下,DLIR可以有效测量肺部、淋巴结和GGN病灶,为实现超低剂量胸部CT靶病灶评价提供了技术基础。
本研究采用了多元线性分析,发现超低剂量CT测量靶病灶的数据差值与BMI、年龄、性别、CT 剂量、靶病灶类型和病灶病理类型无显著相关性,这意味着超低剂量CT 或将有希望适用更大范围的人群和更多类型的病灶。对于肺门淋巴结,超低剂量CT 的测量值显著高于增强CT,这可能是受肺门处其他软组织的影响导致淋巴结边缘显示不准确,需要继续优化现有DLIR算法。
本研究存在以下局限性。虽然RECIST 是评估肿瘤疗效的常用标准,但RECIST 标准仅测量一维直径,世界卫生组织指南中的二维测量标准和一些大型临床研究推荐的三维测量方法尚需进一步评估[1]。其次,出于伦理学上的考虑,我们并未对每个受试者重复做2 次CT 平扫,即超低剂量和常规剂量CT 平扫,用增强CT 作为参考标准提高了靶病灶和临近组织的图像对比度。本研究是回顾性的横断面研究,进行前瞻性队列研究将有助于探讨肿瘤复查过程中的评估价值[18]。最后,BMI≥30 kg/m2的肥胖患者未纳入本研究,需要进一步研究超低剂量CT 对肥胖患者肺部靶病灶的影响。
综上所述,本研究比较了基于DLIR 的胸部超低剂量平扫CT 与传统增强CT 对肺内靶病灶、淋巴结靶病灶和直径≤1 cm 的GGN 的测量评价,发现辐射剂量降低94%~97%的超低剂量CT 与传统增强CT 高度相关,同时差异较小。超低剂量平扫CT 既不需要对比剂,又能够大幅度降低辐射剂量,还保持了图像质量,有利于肿瘤评价和GGN 复查时的多次重复扫描。
利益冲突声明/Conflict of Interests
所有作者声明不存在利益冲突。
All authors disclose no relevant conflict of interests.
伦理批准和知情同意/Ethics Approval and Patient Consent
本研究涉及的所有试验均已通过上海交通大学医学院附属第一人民医院伦理委员会的审核批准(文件号2020KY237)。所有试验过程均遵照《赫尔辛基宣言》的条例进行。因为本研究是回顾性研究,伦理委员会已豁免本研究的知情同意书。
All experimental protocols in this study were reviewed and approved by the Institutional Review Board (IRB) of Shanghai General Hospital,Shanghai Jiao Tong University School of Medicine(Approval Letter No. 2020KY237),and all experimental protocols were carried out by followingthe Declaration of Helsinki.Because this study was retrospective,the IRB waived the requirement for patient informed consent.
作者贡献/Authors'Contributions
赵珂珂、蒋蓓蓓、解学乾参与试验设计;赵珂珂、蒋蓓蓓、解学乾参与论文写作和修改。赵珂珂、蒋蓓蓓、张璐、王凌云、张亚平参与数据收集。所有作者均阅读并同意最终稿件的提交。
The study was designed by ZHAO Keke,JIANG Beibei and XIE Xueqian. The manuscript was drafted and revised by ZHAO Keke,JIANG Beibei and XIE Xueqian. The raw data were collected by ZHAO Keke,JIANG Beibei,ZHANG Lu,WANG Lingyun,and ZHANG Yaping.All the authors have read the last version of paper and consented for submission..
·Received:2022-04-17
·Accepted:2022-07-25
·Published online:2022-08-28
参·考·文·献
[1] EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline(version 1.1)[J]. Eur J Cancer,2009,45(2):228-247.
[2] SHI L, TASHIRO S. Estimation of the effects of medical diagnostic radiation exposure based on DNA damage[J]. J Radiat Res, 2018,59(suppl_2):ii121-ii129.
[3] WOOD D E, KAZEROONI E A, BAUM S L, et al. Lung cancer screening, version 3.2018, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw,2018,16(4):412-441.
[4] MAZLOUMI M, VAN GOMPEL G, KERSEMANS V, et al. The presence of contrast agent increases organ radiation dose in contrastenhanced CT[J]. Eur Radiol,2021,31(10):7540-7549.
[5] PERISINAKIS K, SEIMENIS I, TZEDAKIS A, et al. Radiation burden and associated cancer risk for a typical population to be screened for lung cancer with low-dose CT: a phantom study[J]. Eur Radiol,2018,28(10):4370-4378.
[6] KIM Y, KIM Y K, LEE B E, et al. Ultra-low-dose CT of the thorax using iterative reconstruction: evaluation of image quality and radiation dose reduction[J]. AJR Am J Roentgenol, 2015, 204(6):1197-1202.
[7] JIANG B, LI N, SHI X, et al. Deep learning reconstruction shows better lung nodule detection for ultra-low-dose chest CT[J].Radiology,2022,303(1):202-212.
[8] SHIRI I, AKHAVANALLAF A, SANAAT A, et al. Ultra-low-dose chest CT imaging of COVID-19 patients using a deep residual neural network[J]. Eur Radiol,2021,31(3):1420-1431.
[9] CABALLERO B. Humans against obesity: who will win?[J]. Adv Nutr,2019,10(suppl_1):S4-S9.
[10] SUN J, LI H, WANG B, et al. Application of a deep learning image reconstruction (DLIR) algorithm in head CT imaging for children to improve image quality and lesion detection[J]. BMC Med Imaging,2021,21(1):108.
[11] KIM J H, YOON H J, LEE E, et al. Validation of deep-learning image reconstruction for low-dose chest computed tomography scan:emphasis on image quality and noise[J]. Korean J Radiol, 2021,22(1):131-138.
[12] PARAKH A, CAO J, PIERCE T T, et al. Sinogram-based deep learning image reconstruction technique in abdominal CT: image quality considerations[J]. Eur Radiol,2021,31(11):8342-8353.
[13] NAM J G, AHN C, CHOI H, et al. Image quality of ultralow-dose chest CT using deep learning techniques: potential superiority of vendor-agnostic post-processing over vendor-specific techniques[J].Eur Radiol,2021,31(7):5139-5147.
[14] JENSEN C T,LIU X,TAMM E P,et al. Image quality assessment of abdominal CT by use of new deep learning image reconstruction:initial experience[J]. AJR Am J Roentgenol,2020,215(1):50-57.
[15] BENZ D C, BENETOS G, RAMPIDIS G, et al. Validation of deeplearning image reconstruction for coronary computed tomography angiography:impact on noise,image quality and diagnostic accuracy[J].J Cardiovasc Comput Tomogr,2020,14(5):444-451.
[16] NODA Y, KAGA T, KAWAI N, et al. Low-dose whole-body CT using deep learning image reconstruction: image quality and lesion detection[J]. Br J Radiol,2021,94(1121):20201329.
[17] JENSEN C T, GUPTA S, SALEH M M, et al. Reduced-dose deep learning reconstruction for abdominal CT of liver metastases[J].Radiology,2022,303(1):90-98.
[18] 蒋蓓蓓,张亚平,张琳,等. 深度卷积神经网络对≤3 cm的亚实性肺腺癌CT 图像病理学分型预测的可视化研究[J]. 上海交通大学学报(医学版),2019,39(9):1045-1051.JIANG B B,ZHANG Y P,ZHANG L,et al. A visualization study of deep convolutional neural network to classify the pathological type of sub-soild pulmonary adenocarcinoma of ≤3 cm based on CT images[J]. J Shanghai Jiao Tong Univ(Med Sci),2019,39(9):1045-1051.
