猪德尔塔冠状病毒致病机理及防治研究进展
2022-10-20胡湘云潘鹏丞吴倍仪陈宝剑覃兆鲜谢炳坤
胡湘云,潘鹏丞,吴倍仪,陈宝剑,覃兆鲜,谢炳坤
(广西壮族自治区畜牧研究所,广西家畜遗传改良重点实验室,南宁 530001)
猪德尔塔冠状病毒(Porcine deltacoronavirus,PDCoV)可引起猪呕吐、水样腹泻、脱水甚至死亡,常与猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)等肠道冠状病毒存在混合感染[1]。自2014年首次在美国暴发以来,先后在全球多个国家都检测到PDCoV,目前已呈现全球性流行趋势,严重冲击了养猪业的有序发展[2]。相关报道显示,PDCoV还可跨物种感染鸡、牛[3-4]。2021年,研究人员在3名患有急性未分化发热性疾病的海地儿童血浆样品中检测到PDCoV,这是首次在人类中发现该病毒,其快速传播和潜在的跨物种传播特性,给动物和人类健康安全带来了巨大威胁[5]。由于PDCoV致病机制尚未探明,缺乏疫苗和特效药物,已成为当前养猪业疫病防控难点。笔者将从PDCoV的编码蛋白功能、致病机理、诊断方法、疫苗开发及抗病毒治疗所取得的进展进行梳理和阐述,以期加强对PDCoV的全面了解,为安全高效疫苗和防治药物的研发奠定理论基础。
1 PDCoV编码蛋白及功能
PDCoV是一种有囊膜的单股正链RNA病毒,基因组全长25 400 nt,PDCoV可编码4种结构蛋白:棘突蛋白(spike,S)、膜蛋白(membrane,M)、包膜蛋白(envelope,E)和核衣壳蛋白(nucleocapsid,N),15个非结构蛋白(nonstructural protein,nsp)和3个辅助蛋白(NS6、NS7和NS7a)。其中S、E和M蛋白是囊膜蛋白,N蛋白构成病毒核衣壳,非结构蛋白与病毒RNA合成有关,辅助蛋白虽不是病毒增殖的必需蛋白但其能发挥免疫调节功能,PDCoV编码蛋白的具体结构特征和功能见表1。
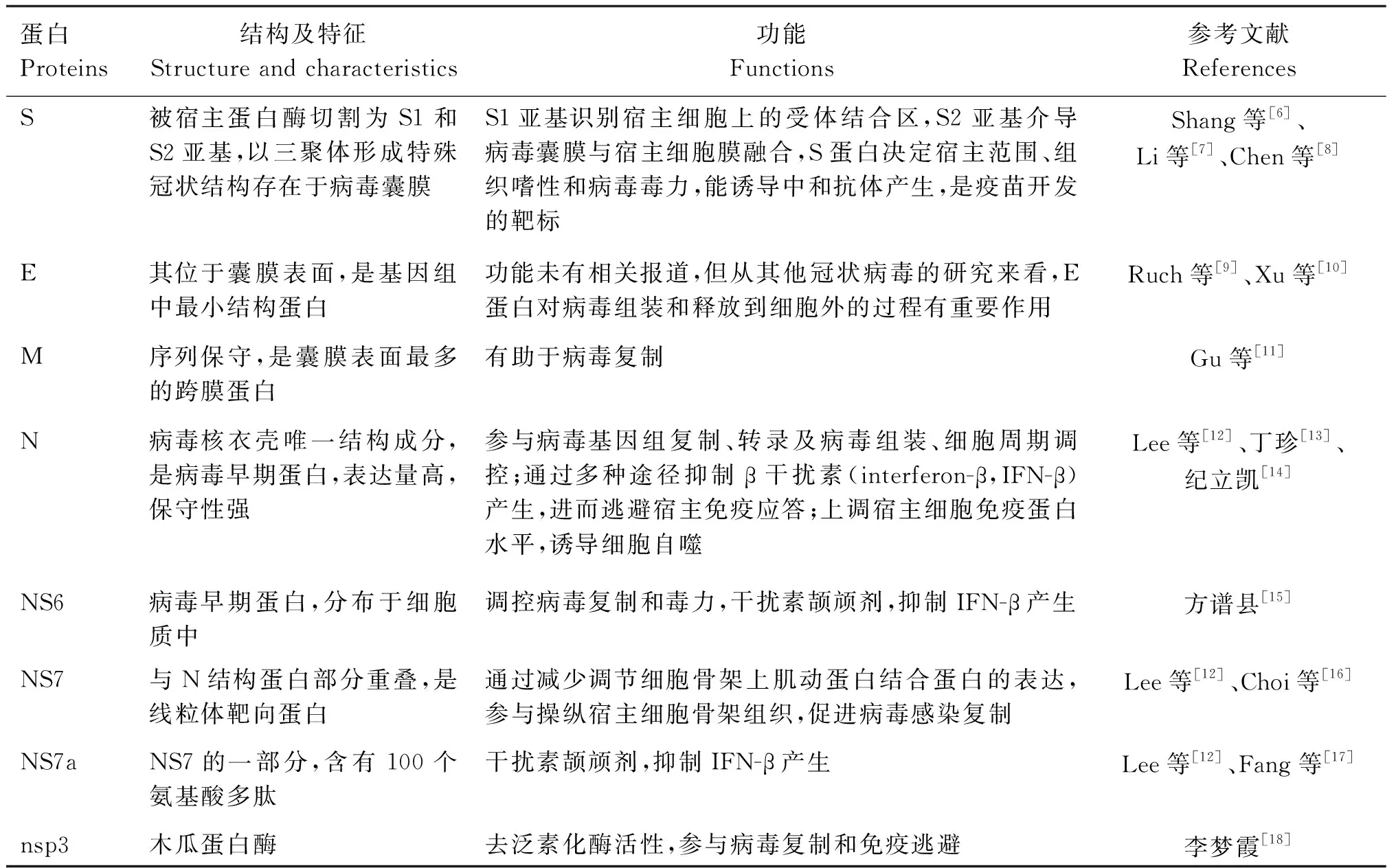
表1 PDCoV编码蛋白及功能Table 1 PDCoV encoding proteins and their functions

续表
2 PDCoV致病机理
PDCoV侵入宿主体内并引起发病是复杂的多种机制共同作用的过程,其通过与宿主细胞膜上受体结合侵入细胞,以颉颃IFN反应、诱导细胞凋亡、调控细胞自噬、抑制细胞焦亡等途径逃避宿主免疫应答以维持自身增殖,同时还有细胞分子和宿主蛋白共同参与致病过程。
2.1 侵入细胞的受体和途径
研究发现,猪氨基肽酶N (porcine aminopeptidase N,pAPN)是PDCoV侵入细胞的受体,PDCoV通过S1亚基C-端结构域(carboxy-terminal domain,CTD)与pAPN的种间保守结构域Ⅱ结合感染猪、鸡和人类等细胞,且该受体通过内吞途径促进PDCoV侵入细胞并完成复制[23-24]。然而,特异性抑制pAPN的表达不能完全阻断PDCoV感染猪上皮细胞(IPI-2I),说明PDCoV还可能使用其他受体侵入细胞[25]。随后,唾液酸(sialic acid,SA)被证实也是PDCoV的结合受体,SA参与PDCoV S1亚基的受体结合与病毒中和作用,且S1亚基的domain A(即NTD或S1A)与SA互作有关,PDCoV利用SA作为侵入细胞的受体的结合能力受胰蛋白酶影响[26-27]。研究发现,PDCoV还能通过巨胞饮作用(不需要特定受体)和网格蛋白(需低pH环境和动力蛋白)介导的内吞作用进入猪回肠上皮细胞,通过小窝介导的内吞途径进入猪睾丸细胞(ST)和猪肾细胞 (LLC-PK1)[28]。
2.2 逃避宿主免疫应答
宿主天然免疫系统是抵抗病毒感染的第一道防线,通过IFN途径、细胞凋亡、细胞自噬和细胞焦亡发挥抗病毒作用,诸多研究发现PDCoV已发展出多种免疫逃避机制来逃避宿主免疫应答。
2.2.1 颉颃IFN反应 IFN在宿主先天免疫应答中起着重要作用,其大量表达能帮助宿主颉颃病毒感染,PDCoV的多个结构蛋白、非结构蛋白和辅助蛋白均通过各种策略颉颃宿主IFN反应,抑制IFN表达,逃避宿主先天免疫应答,PDCoV颉颃IFN反应的作用机制见图1。
N蛋白结合视黄酸诱导基因Ⅰ(retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)阻碍后者识别双链RNA,还能破坏RIG-Ⅰ激活剂(Riplet)和双链RNA激活的蛋白激酶激活剂(double stranded RNA activated protein kinase-activating protein,PACT)结合RIG-Ⅰ来抑制RIG-Ⅰ K63连接的多泛素化,此外,它通过泛素-蛋白酶途径促进干扰素调节因子7(interferon regulatory factor 7,IRF7)降解,利用多种途径抑制IFN-Ⅰ的生成[13,14,29]。
nsp5蛋白通过切割核因子κB(nuclear factor kappa-B,NF-κB)必需调节剂——NEMO分子并降低其表达量,阻碍IFN生成;它还可通过裂解Janus激酶信号转导和转录激活剂(Janus tyrosine kinase-signal transducer and activator of transcription 1,JAK/STAT)信号通路中的关键蛋白转录激活因子2(signal transducer and activator of transcription 2,STAT2),抑制IFN下游信号分子的激活及抗病毒基因的转录,从而颉颃天然免疫应答[19]。nsp10则通过削弱2种转录因子干扰素调节因子3(IRF3)和NF-κB p65亚基的磷酸化和核转位,抑制IFN-β产生,nsp14和nsp16具有协同作用,能增强nsp10对IFN-β的抑制作用[21]。nsp15蛋白通过不依赖内切核糖核酸酶活性的机制破坏NF-κB活化来抑制IFN-β产生,但不颉颃IRF3的活化[22]。
NS6蛋白与RNA识别受体RIG-Ⅰ和黑色素瘤分化相关基因5(melanoma differentiation-associated gene 5,MDA5)互作降低受体对双链RNA的识别,颉颃IFN-β产生[15]。NS7a通过同时与IKKε的激酶结构域和支架二聚化结构域相互作用,与肿瘤坏死因子受体相关因子3(TNF receptor associated factors,TRAF3)和IRF3竞争结合IκB激酶(IκB kinase ε,IKKε),颉颃视黄酸诱导基因Ⅰ样受体(RIG-Ⅰ-like receptors,RLR)介导的IFN-β形成[17]。此外,研究还发现,PDCoV感染能减少过氧化物酶体(peroxisome)的数量进而抑制IFN-Ⅲ反应,这能规避宿主的抗病毒免疫,但不影响IRF1和线粒体抗病毒信号(mitochondrial antiviral signaling protein,MAVS)的表达水平[30]。
2.2.2 诱导细胞凋亡 细胞凋亡又称为程序性细胞死亡,病毒感染宿主后发挥凋亡作用可促进病毒从感染细胞中释放和传播,诱导细胞凋亡。研究发现,PDCoV感染细胞通过凋亡效应蛋白Bax募集或线粒体通透性转换孔打开来刺激线粒体外膜透化,导致线粒体中促凋亡分子细胞色素C(cytochrome C,Cyt c)释放到细胞质中,从而启动caspase依赖的线粒体通路(内源性细胞凋亡途径)[32]。此外,通过检测PDCoV感染的细胞中的caspase3、caspase8和caspase9的活性发现,其活性随病毒感染性增多而提高,证明PDCoV可同时激活内源性(线粒体途径)与外源性(死亡受体通路)细胞凋亡通路,诱导细胞凋亡[33]。
2.2.3 调控细胞自噬 细胞自噬是一种细胞内降解过程,可维持细胞的代谢平衡和体内稳态,当病毒感染宿主细胞后,一方面,宿主细胞利用细胞自噬将病毒送到溶酶体室进行降解和消除,另一方面,很多病毒进化出多种策略劫持自噬以进行自身复制;PDCoV N蛋白和nsp6蛋白均可显著上调自噬相关基因LC3-Ⅱ的表达来诱导细胞自噬,说明PDCoV感染细胞能引起细胞自噬;随后,使用自噬激活剂雷帕霉素诱导的LLC-PK1细胞和猪小肠上皮细胞的自噬均促进PDCoV N蛋白表达水平显著上升,使用氯喹抑制自噬后PDCoV N蛋白表达水平显著下调,这证明PDCoV诱导的细胞自噬能促进病毒自身复制[34-35]。
2.2.4 抑制细胞焦亡 细胞焦亡又称细胞炎性坏死,是宿主机体内重要的天然免疫反应,病毒感染后,炎性caspase-1被激活可切割消皮素D(gasdermin D,GSDMD),造成细胞穿孔引起细胞死亡,其能通过清除病毒感染的细胞从而减少细胞内病原体的存活和增殖;GSDMD是细胞凋亡的执行蛋白,其抗病毒活性是通过促进IFN-β的非经典释放和增强干扰素刺激基因(interferon-stimulated gene,ISG)反应来介导[36]。PDCoV感染宿主细胞早期,nsp5蛋白可在Q193-G194连接处切割GSDMD,其切割片段在焦亡诱导中失活不能诱导细胞焦亡,这证明PDCoV感染可抑制细胞焦亡进而促进PDCoV在宿主细胞初始阶段的复制[37]。
2.3 影响PDCoV复制的其他机制
PDCoV感染宿主细胞后引起大多数与免疫、炎症反应相关的细胞因子上调。钙离子(Ca2+)是细胞内广泛存在的第二信使,能调控细胞的增殖分化、自噬、凋亡等过程,研究发现,多种病毒可通过调控细胞内的钙通道或钙水平来促进自身感染与复制;PDCoV能调节钙流入以促进病毒复制,钙通道阻滞剂盐酸地尔硫卓能抑制PDCoV感染过程中的复制阶段,而L型钙离子通道电压门控通道亚基(CACNA1S)的敲除抑制了PDCoV复制[38]。
病毒不能独立在自然环境中生存,其需要依赖宿主的细胞进行增殖。信号传导转录激活因子1(STAT1)是能与PDCoV相互作用的宿主蛋白,并能在PDCoV感染中起负调控作用,使用CRISPR/Cas9构建STAT1缺失的LLC-PK1细胞系发现其能导致病毒产量显著增加,STAT1的缺失对病毒与细胞的附着影响不大,但却能导致病毒内化增加[39]。通过CRISPR/Cas9敲除系统对全基因组进行筛选发现,与内质网定位相关的多次跨膜蛋白TMEM41B参与了PDCoV复制,进一步利用小干扰RNA(small interfering RNA,siRNA)、过表达和敲除试验证明TMEM41B介导PDCoV复制复合体及双层囊泡的形成,参与PDCoV的复制阶段,进而影响PDCoV的增殖[40]。
目前为止,虽然人们对于PDCoV侵入宿主体内并引起发病的分子机制进行了初步研究,但因其致病机理复杂多样,PDCoV宿主体内的感染机制,与宿主蛋白相互作用及颉颃天然免疫反应方面还需更深入的研究和探讨,可借鉴其他冠状病毒致病机理的研究方法和进展,从而为阐明PDCoV致病机理提供新方向。
3 PDCoV诊断方法
因为PDCoV引起的临床症状和病理变化与PEDV等其他肠道冠状病毒具有很高相似性,还会出现混合感染的情况,需经过实验室诊断确诊。目前PDCoV的实验室诊断方法分为核酸检测和抗体检测,因PDCoVS、M和N基因具有保守性和抗原性,常被用作检测靶标。核酸检测方法主要有电子显微镜病毒颗粒检测、病毒分离鉴定、聚合酶链式反应(RT-PCR、实时荧光定量RT-PCR)、环介导等温扩增(LAMP)等;抗体检测方法主要有胶体金免疫层析技术、病毒中和试验(VN)、荧光微球免疫分析(FMIA)和酶联免疫吸附试验(ELISA)等。在临床实践中,各检测方法存在的自身优势和不足之处见表2,要合理利用诊断方法利于早期确诊以达到防控目的。
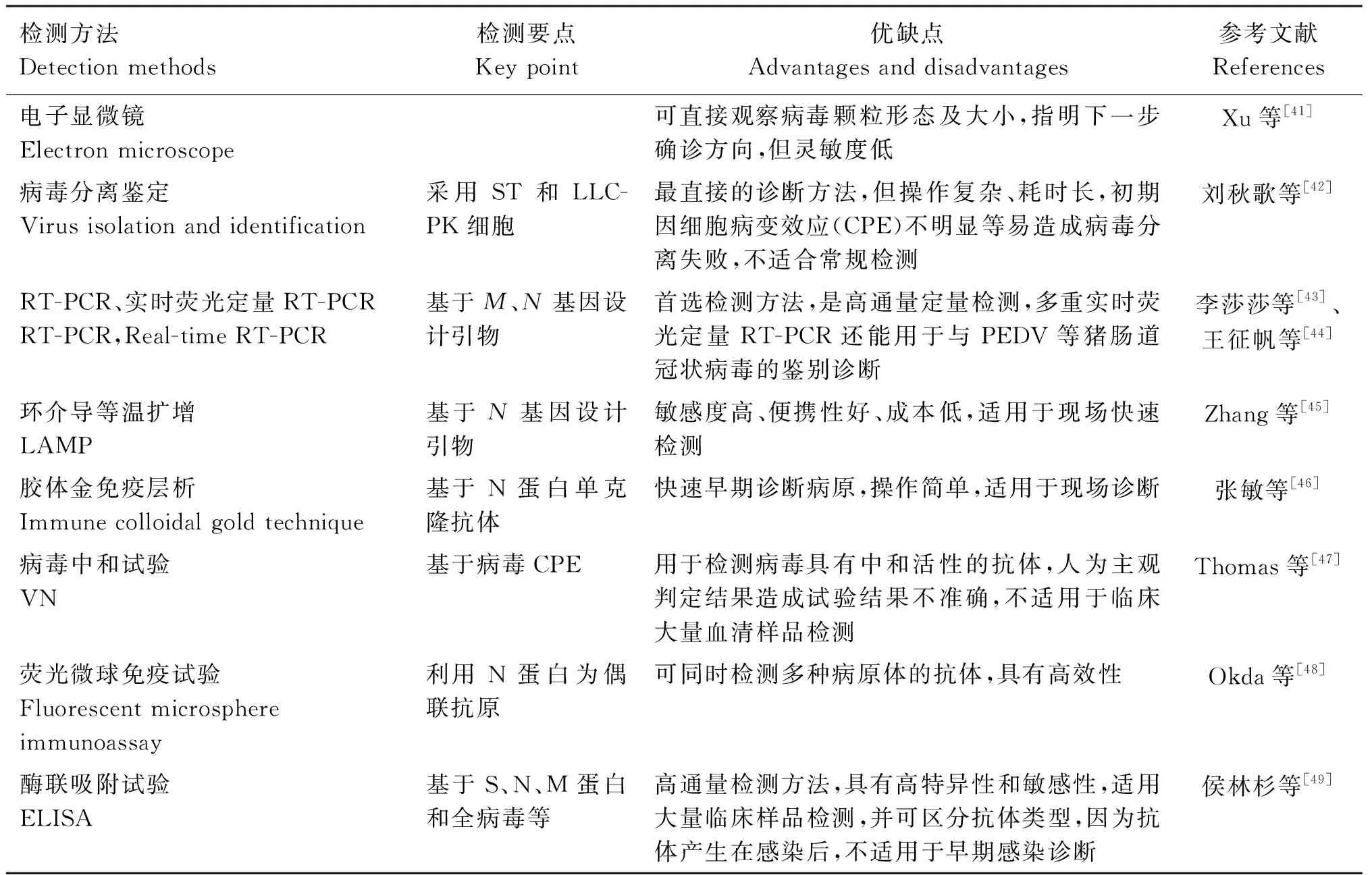
表2 PDCoV 常用的检测方法Table 2 Common detection methods of PDCoV
4 PDCoV疫苗开发及抗病毒治疗
4.1 疫苗开发研究进展
疫苗是控制病毒感染最有效的手段,目前尚无PDCoV商品化疫苗,研究人员正利用各类开发平台和技术开展对PDCoV疫苗的研究,已在灭活病毒疫苗、减毒活病毒疫苗、重组载体疫苗、病毒样颗粒疫苗、乳酸菌载体口服疫苗等研究上取得了一定的进展。
4.1.1 灭活病毒疫苗 灭活病毒疫苗是对病原微生物使用化学或物理方法去除其感染性而仍保持其免疫原性,用β-丙内酯灭活 PDCoV NH株第15代病毒制备PDCoV灭活疫苗,分别在妊娠母猪产前40和20 d用灭活疫苗进行免疫,随后在母乳及出生仔猪血清中发现IgG及中和抗体,新生仔猪采食初乳后在5日龄用105TCID50的PDCoV进行攻毒试验,结果证实PDCoV灭活疫苗为仔猪提供 87.1%的被动免疫保护率[50]。
4.1.2 减毒活疫苗 减毒活疫苗是一类将病原体经过人工处理后,使病毒失去致病性,但保留了原有的增殖能力和免疫原性的疫苗,病毒毒力相关基因的缺失是一种有效的病毒致弱手段;PDCoV NS6蛋白能决定病毒毒力,研究人员用绿色荧光蛋白(green fluorescent protein,GFP)基因替换PDCoV的全长感染性cDNA克隆的NS6基因,构建rPDCoV-ΔNS6-GFP,其在体外和体内病毒滴度均显著降低,且感染的仔猪没有临床症状或肠道病变,表明NS6的缺失导致病毒毒力减弱,NS6缺失突变毒株是候选减毒活疫苗毒株[15]。
4.1.3 重组载体疫苗 重组病毒载体疫苗是以病毒作为载体,将抗原基因重组到病毒基因组中,使用能表达抗原基因的重组病毒制成的疫苗,而猪伪狂犬病病毒(Pseudorabies virus,PRV)作为重组活疫苗载体已被应用于多种病毒疫苗的研发,通过CRISPR/Cas基因编辑和同源重组技术构建了表达PDCoV S蛋白的重组伪狂犬病病毒(rPRVXJ-delgE/gI/TK-S),将其免疫小鼠后能表现良好的安全性和免疫原性,能上调小鼠外周血中IFN-γ和白细胞介素4(IL-4)的表达水平,促进小鼠脾脏中特异性T淋巴细胞的增殖,诱导高水平抗体的产生,在加强免疫后第7天,小鼠体内检测到了PRV gB和PDCoV S特异性抗体,且在免疫后第28天中和抗体水平达到最大值,该重组毒株可100%保护小鼠免受毒株的攻击并降低小鼠体内的PDCoV载量,因此有望成为PDCoV的候选重组疫苗[51]。
4.1.4 病毒样颗粒疫苗 病毒样颗粒(virus-like particles,VLPs)是通过一种或多种病毒结构蛋白的体外或体内自组装合成的非遗传多聚体纳米颗粒,其在形态上保持了病毒抗原蛋白的天然构象,但不带有病毒遗传物质,因而没有感染性,只有激发宿主免疫反应的能力,VLPs可选取细胞、酵母、昆虫等表达系统,制备成本低,可大规模生产。Guo等[52]首先合成冠状病毒通用表位的噬菌体Qbeta外壳蛋白的嵌合VLP疫苗,之后用嵌合VLP疫苗对小鼠进行腹膜内免疫,收集其血清,通过ELISA检测发现VLP疫苗在小鼠体内诱导了针对PDCoV的特异性抗体反应,并且抗体具有中和活性,这证明VLP具有良好的免疫原性和安全性,可以作为疫苗开发的理想候选者。
4.1.5 乳酸菌载体口服疫苗 乳酸菌是一类能利用发酵的碳水化合物产生大量乳酸的细菌,具有较强的黏附定植肠道上皮的能力,诱发肠道黏膜免疫,作为疫苗递送载体具有潜在应用前景;PDCoV S1结构域中有多个产生中和抗体的重要表位,是受体识别、结合细胞的关键部位,郝嘉翼等[53]选用优化的PDCoVS1基因并将其克隆至乳杆菌NZ3900,获得高含量的重组质粒,之后电转入植物乳杆菌LP18中高效表达,为口服疫苗的研制奠定基础。
4.2 抗病毒治疗研究进展
目前尚无特效药物用于治疗PDCoV,一些广谱抗病毒药物、抗病毒分子蛋白和新型抗病毒技术在PDCoV抗病毒研究中显示了良好的应用前景,这给PDCoV抗病毒药物的研发提供新的思路。
4.2.1 广谱抗病毒药物 瑞德西韦(Remdesivir,RDV)是一种腺苷类似物的单磷酰胺酸盐前药,其通过在体内转化为三磷酸形式活化物(triphosphate form of remdesivir,RTP),与天然三磷酸腺苷竞争结合病毒的依赖RNA型RNA聚合酶(RNA-dependent RNA-polymerases,RdRp),之后插入RNA合成链,阻断病毒RNA的复制,并抑制RdRp酶活性,以发挥对RNA病毒的抗病毒活性,研究发现在含胰蛋白酶和无血清培养基的人肝癌细胞(Huh7)中,瑞德西韦以剂量依赖性方式减少PDCoV的复制,半最大效应浓度(concentration for 50% of maximal effect,EC50)为0.02 μmol/L[54]。因此未来可将瑞德西韦作为治疗PDCoV的潜在广谱抗病毒药物。
4.2.2 抗病毒分子蛋白 抗病毒药物设计的策略可从直接杀灭病毒、干扰病毒侵入宿主细胞、抑制病毒核酸复制、组装和释放等方面着手,笔者总结了多种抗病毒分子蛋白通过靶向病毒本身或宿主因子来发挥抗病毒作用的具体途径(表3),这些分子蛋白有望成为抗PDCoV治疗的新研究靶点,为PDCoV的抗病毒药物研发提供新依据和新方向。

表3 抗PDCoV蛋白及作用途径Table 3 Antiviral protein and its function pathway
4.2.3 抗病毒技术 RNA干扰(RNA interference,RNAi)是由双链RNA在细胞体内诱导靶向目的基因mRNA降解,从而使目的基因表达下降或沉默的现象,同时其还可作为一种新型技术手段用于抗病毒治疗,通过构建PDCoV的N基因的短发夹RNA(short hairpin RNA,shRNA)质粒,能在体外试验沉默基因的表达,抑制PDCoV的复制,对细胞抗PDCoV保护率达到92.7%,在仔猪体内试验发现其能显著保护肠组织抵御PDCoV感染所引起的特异性病变,提示采用RNAi治疗PDCoV的潜力和可行性[62]。
综上,虽然当前尚无PDCoV的商品化疫苗和特效治疗药物,但人类近年来应对其他冠状病毒的药物研发技术和经验对PDCoV疫苗和治疗药物的研发具有重要借鉴意义。
5 展 望
近年来,对PDCoV蛋白功能、致病机理、诊断方法、疫苗开发、抗病毒治疗等方面有了一定进展,但还有很多尚未解决的问题和难点,今后的研究重点可从以下几个方面展开:①继续研究PDCoV编码蛋白的功能,可参考其他肠道冠状病毒的蛋白功能研究PDCoV蛋白,有助于明确病毒的致病机理;②加强商品化疫苗的研发,疫苗接种是预防和控制传染病的有效手段,目前尚未有商品化的疫苗问世,全球各地PDCoV毒株核苷酸同源性高,因此针对某一毒株进行研发能给全球PDCoV防控做好疫苗储备;③发展快速即时高效的诊断技术,PDCoV凝集兔红细胞的能力有助于PDCoV诊断方法的研发[63]。此外,可借助可视化、微流控芯片技术、纳米材料生物传感器等新技术开发新的诊断方法。
随着几种冠状病毒跨越物种壁垒感染人类,新的冠状病毒不断出现,因此,需提高对冠状病毒的警惕,加强对PDCoV的流行情况、致病机制及病原生物学的前瞻性研究,同时及时建立PDCoV的监测预警机制让监管关口前移,从源头阻断疫病的传播路径,切实筑牢动物防疫生物安全屏障。
