铁死亡基因及相关长链非编码RNA在肝细胞癌发生与预后中的作用
2022-10-20姚元谦吕建林柳琳琳王光耀
姚元谦 吕建林 柳琳琳 王光耀
1.广西中医药大学研究生院,广西南宁 530001;2.广西中医药大学第一附属医院肝病科,广西南宁 530023
肝细胞癌目前仍是全球致死性恶性肿瘤的主要类型之一[1]。手术治疗是肝癌患者早期有效治疗手段,可惜大部分患者确诊时已是中晚期,尽管近年来开发了多种晚期肝癌的新疗法,但仍达不到临床所需疗效[2-3]。铁死亡主要由铁介导的氧化损伤、过度脂质氧化和细胞膜损伤驱动[4],诱导肿瘤细胞铁死亡在各种癌症治疗中具有重要作用[5]。长链非编码RNA(long non-coding RNA,lncRNA)起初被认为是基因组转录的“噪音”,而近年积累的证据表明,lncRNA 的异常表达与肿瘤的发展及预后密切相关[6]。本研究运用生物信息学,构建基于铁死亡相关lncRNA 的肝癌预后模型,希望能为打破肝癌治疗困境提供新视角。
1 资料与方法
1.1 一般资料
从TCGA 数据库下载肝细胞癌的转录组数据,共424 个样本。从FerrDb 数据库获取246 个与肝癌相关的铁死亡基因。
1.2 铁死亡基因功能富集分析
运用R 软件进行差异分析,并以|logFC|>1、FDR<0.05 为过滤条件,筛选出差异表达基因,进行基因集(Gene Set Enrichment Analysis,GSEA)、GO、KEGG 富集分析。
1.3 铁死亡相关lncRNA 筛选
参考Gencode 数据库的基因注释,提取转录组中的lncRNA。运用Pearson 相关性检验,以|cor|>0.4、P <0.001 为过滤条件,获取铁死亡相关lncRNA。
1.4 预后相关铁死亡lncRNA 筛选
通过差异分析,提取差异铁死亡lncRNA 的肿瘤组表达数据,进行单因素Cox 回归分析,以P <0.001为过滤条件,筛选与预后相关的铁死亡lncRNA。
1.5 构建肝癌预后模型
进行多因素Cox 回归分析,构建基于铁死亡相关lncRNA 的预后模型,该模型的计算公式:
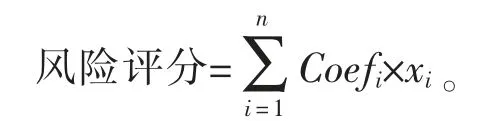
其中xi为每个lncRNA 的表达水平,Coefi为回归系数。根据风险评分将队列中的患者分为高、低风险组,并进行预后分析。
1.6 低风险组与高风险组的免疫差异
从TIMER2.0 数据库下载免疫细胞浸润数据,并通过文献检索获得47 个免疫检查点基因。以P <0.05 为过滤条件,筛选两组差异有统计学意义的免疫细胞、免疫检查点。
2 结果
2.1 铁死亡基因功能富集分析
筛选出84 个差异表达铁死亡基因,见图1A。GSEA 富集分析发现,涉及雷帕霉素靶蛋白复合物(mechanistic target of Rapamycin 1,mTORC1)基因集、核因子-κB(nuclear factor-κB,NF-κB)调控基因集等,见图1B。GO、KEGG 富集分析得到生物学进程631 条、细胞组分22 条、分子功能77 条、信号通路56 条,见图1C~D。
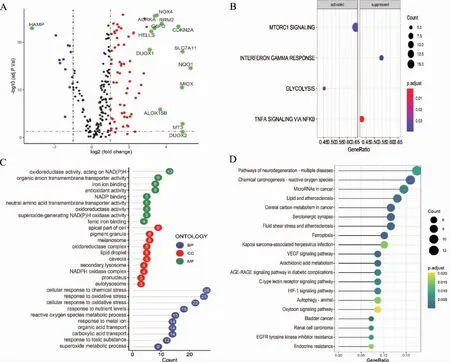
图1 铁死亡基因差异分析及富集分析
2.2 筛选预后相关的铁死亡lncRNA 并构建预后模型
共鉴定出5 296 个与铁死亡相关的lncRNA,筛选出差异lncRNA 共781 个,预后分析获得66 个与预后相关的lncRNA。回归分析纳入17 个lncRNA 参与模型构建,其模型相关系数详见表1。根据风险评分公式计算各患者的风险得分,并将队列中的肝癌患者分为高、低风险组。
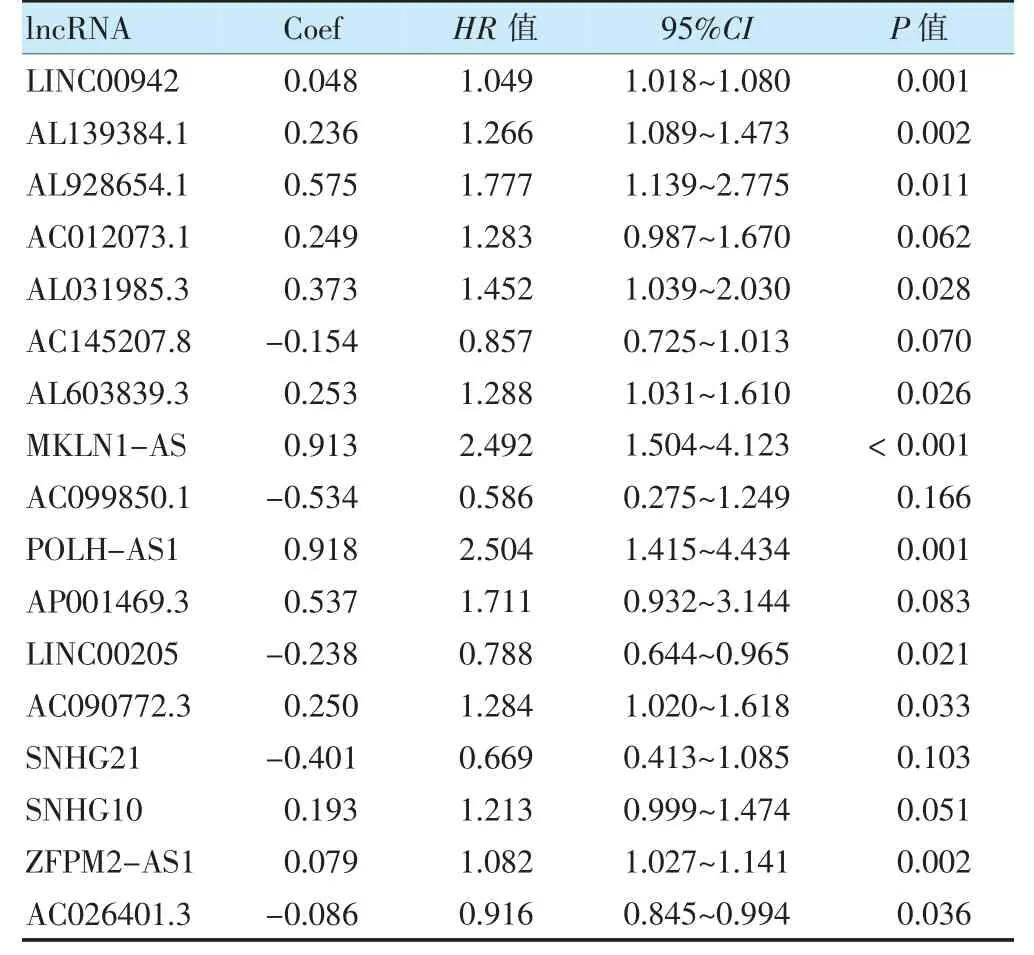
表1 构建预后模型多因素Cox 分析结果
2.3 预后分析及模型评估
Kaplan-Meier 生存曲线及预后风险散点图显示,低风险组预后优于高风险组(P <0.01),见图2A~B。受试者操作特征(receiver operating characteristic,ROC)曲线显示,该模型对生存期具有良好的预测能力,且优于其他临床性状的预测效果,见图2C~D。回归分析显示,该模型与总生存期显著相关,且具有独立预后价值,见图2E~F。
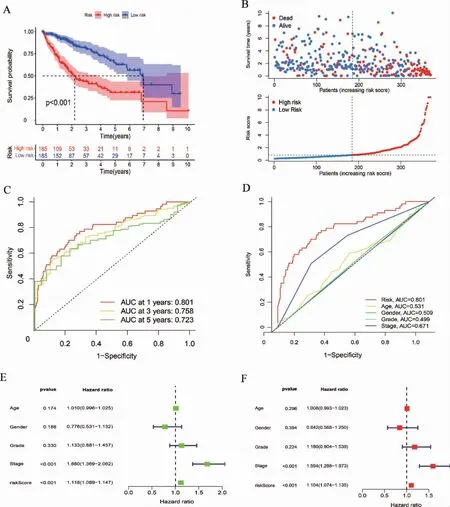
图2 两组预后分析及模型评估
2.4 预后相关lncRNA-mRNA 共表达分析
模型中lncRNA 基本在高风险患者中呈高表达状态,且大部分随着病程的进展而增高。lncRNAmRNA 共表达网络见图3A,图中红色节点为lncRNA、绿色节点为mRNA;表达热图见图3B。

图3 参与模型构建的lncRNA 表达分析
2.5 高风险组与低风险组免疫差异分析
免疫细胞浸润热图见图4A,图中展示了不同平台的分析结果。有17 个具有表达差异的免疫检查点,见图4B。根据以上免疫分析的结果,进一步分析14 个差异最显著的铁死亡基因(logFC>3)与免疫分子靶点间的相关性,见图5。
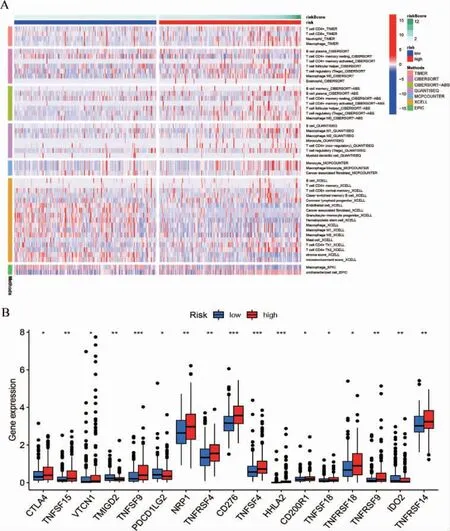
图4 免疫细胞浸润及免疫检查点的差异分析
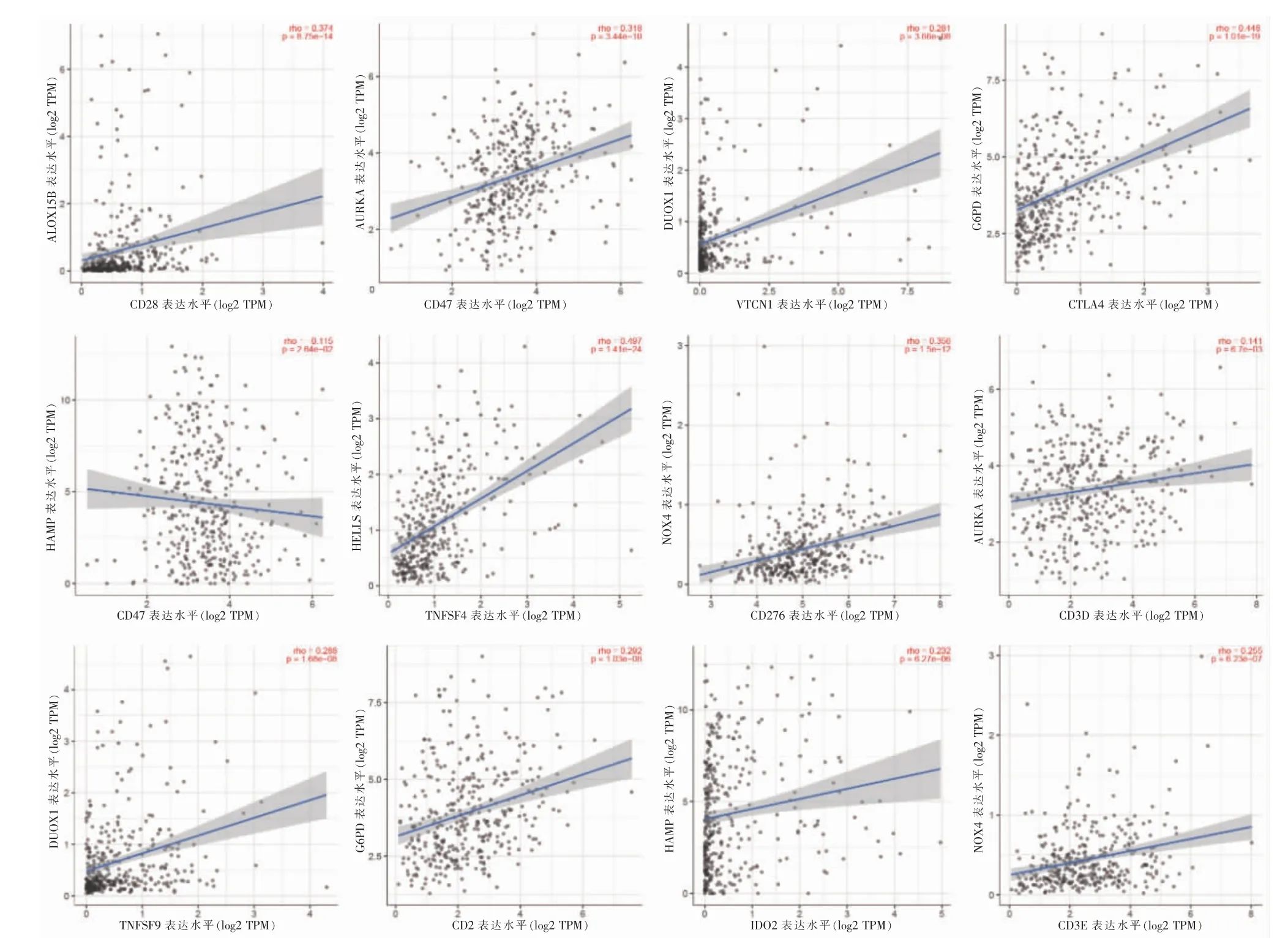
图5 铁死亡基因与免疫靶点相关性分析
3 讨论
铁死亡作为一种新发现的细胞死亡方式,在肿瘤研究中备受关注,而lncRNA 与铁死亡之间具有调控关系[7]。本研究利用生物信息学,分析铁死亡及相关lncRNA 在肝癌中的作用机制。
差异表达最显著的铁死亡基因中,部分已被证实参与铁代谢或肿瘤的调节。NQO1 在细胞内起到抗氧化作用[8],其在肝癌患者中高表达,且与患者生存时间呈负相关[9]。SLC7A11 在多种恶性肿瘤中过表达,能够抑制铁死亡、促进肿瘤发展[10-11]。AURKA 是细胞周期调节激酶,其能诱导肿瘤细胞铁死亡[12]。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)能维持细胞的抗氧化损伤作用,G6PD 过表达能促进肝癌细胞的增殖[13-14]。HAMP 是维持体内铁代谢稳态的关键基因,当HAMP 表达下调时可抑制细胞发生铁死亡[15]。富集分析发现,在肝癌中mTORC1 复合物处于激活状态,其能通过调节代谢过程为肿瘤细胞提供营养物质[16]。糖酵解途径也在肝癌中处于激活状态,是肿瘤细胞中表现活跃的代谢表征,糖酵解是肿瘤治疗的潜在靶点[17]。而γ 干扰素应答调控途径在肝癌中处于抑制状态,该因子缺陷小鼠能自发地发生肺上皮恶性肿瘤[18],但也有研究认为其能够使肿瘤细胞诱发强效的免疫逃逸机制[19]。孔雪等[20]发现,敲除AC012073.1 能够明显抑制乳腺癌细胞的侵袭能力,而过表达该基因则会促进癌细胞转移。LINC00205 能够作为内源竞争性RNA,促进肝癌细胞增殖[21],且该基因高表达的肝癌患者术后复发率较高[22]。
免疫治疗策略能提高肝癌患者的生存率[23]。肿瘤中的淋巴细胞在免疫逃逸中发挥着重要作用,包括调节性T 细胞、肿瘤相关的巨噬细胞等[24]。本研究结果显示,高、低风险组有17 个具有表达差异的免疫检查点。目前,以单克隆抗体为代表的一系列免疫检查点抑制剂在抗肿瘤中取得了较大成功[25]。
