液相色谱串联质谱法测定玉米中伏马毒素的不确定度评定
2022-10-20李子琨,史晓梅,何卓霖等
伏马毒素是镰刀菌在环境条件影响下产生的水溶性有毒次级代谢物,已发现的伏马毒素有30多种,包括FB1、FB2、FB3等,毒性最大的是FB1[1]。玉米在种植、收获、加工、运输和储存等过程易发生伏马毒素感染现象。范楷等[2]对长三角地区农产品进行分析,发现FB1、FB2、FB3的检出率为49.0%、35.7%、29.3%。伏马毒素污染的粮食进入食物链后,会对人的身体健康产生严重影响[3]。许多国家和组织制定了食品中多种伏马毒素的限量标准[4]。我国食品中伏马毒素的限量标准还未正式颁布,因而对伏马毒素的研究具有重要意义[5]。本研究实验检测方法基于同位素稀释的高效液相色谱-串联质谱法,能够快速提取伏马毒素,提取效率和灵敏度高。
检测方法的测量不确定度是对结果准确性的评估,受到各类实验室的广泛重视[6]。测量不确定度是指由于测量误差的存在,对被测量值不能确定的程度,其对于评判检测方法的科学性及准确性具有重要意义[7]。有研究基于液相色谱串联质谱法检测玉米粉中伏马毒素B1的不确定度评定,但检测方法缺少FB2和FB3,因此不确定度的评定不够完全。本实验依据标准规定的评估方法和程序,对同位素稀释高效液相色谱-串联质谱法测定玉米中FB1、FB2、FB3进行不确定度的评定,以提高检测结果的准确性,为实验室质量控制提供严谨的科学依据。
1 材料与方法
1.1 材料与仪器
实验用玉米样品购于当地农贸市场;甲醇、乙腈,色谱纯,sigma公司;甲酸,色谱纯,霍尼韦尔公司;甲酸98%,国药化学试剂公司;伏马毒素B1(50 μg·mL-1)、伏马毒素 B2(50 μg·mL-1)、伏马毒素B3(50 μg·mL-1)、13C伏马毒素混合标准液(U-[13C34]-FB1、U-[13C34]-FB2,均为 5 μg·mL-1)、13C 伏马毒素B3(U-[13C34]-FB3,10.02 μg·mL-1),Romer公司。
LC-30AD高效液相色谱仪,岛津公司;AB Sciex QTRAP 5500三重四极杆质谱仪,AB Sciex公司;Allegra 64R台式高速离心机,贝克曼公司;TTL-DCⅡ型氮吹仪,同泰联公司;Mili-Q超纯水机,Millipore公司;Dragon Lab QL902涡旋振荡器,Dragon Lab公司;SB-3200DTDN超声波清洗器,新芝生物科技公司。
1.2 实验方法
实验方法及仪器条件均为实验室自建,符合实验室检测要求。
1.2.1 标准溶液的配制
(1)外标标准溶液的配制。分别移取伏马毒素储备液 100 μL加 900 μL乙腈∶水(80∶ 20,V/V)稀释成5 μg·mL-1的标准中间工作液;分别移取40 μL伏马毒素标准中间工作液于5 mL容量瓶中,加入适量乙腈∶水(80∶20,V/V)溶液定容,配制成质量浓度均为40 μg·L-1的混合外标标准中间工作溶液,利用逐级稀释的方法,用流动相稀释得到一系列浓度为2 μg·L-1、4 μg·L-1、8 μg·L-1、20 μg·L-1、40 μg·L-1和80 μg·L-1的标准工作溶液。
(2)内标标准溶液的配制。分别移取40 μL(U-[13C34]-FB1、U-[13C34]-FB2)伏马毒素混合标准液和20 μL U-[13C34]-FB3溶液于5 mL容量瓶中,加入适量乙腈∶水(80∶20,V/V)溶液,配制成质量浓度为40 μg·L-1稳定同位素内标标准中间工作液。
1.2.2 样品前处理
准确称取2.00 g样品(精确至0.1 mg)于50 mL离心管中,加入50 μL的内标标准中间工作液涡旋1 min,再加入10 mL乙腈∶水∶甲酸(80∶18∶2,V∶V∶V)溶液,涡旋振荡1 min,超声提取20 min;在 4 ℃下 8 000 r·min-1离心 10 min;取 5 mL 上清液在40 ℃水浴下氮气吹干,加入500 μL甲醇∶水∶甲酸(30∶70∶0.1,V∶V∶V)溶液,涡旋振荡1 min,超声 5 min,12 000 r·min-1离心 10 min,取上层清液上机待测。
1.2.3 仪器条件
(1)液相条件。色谱柱:Shiseido-C18(100 mm×2.0 mm×3 μm);进样体积为 10 μL;流速 0.3 mL·min-1;流动相A:0.1%甲酸/水溶液,流动相B;甲醇溶液;梯度洗脱程序:0~1 min 30% B,1.0~6.5 min 30%→55% B,6.5~8.5 min 55% B,8.5~10.0 min 55%→80% B,10~12 min 80% B,12.0~12.1 min 80%→30% B,12.1~16.0 min 30% B。
(2)质谱条件。电喷雾离子源(ESI);离子源温度:550 ℃;离子喷雾电压:5 500 V(正模式);气帘气:35 psi;气体1:50 psi;气体2:55 psi;采用多反应监测(MRM)模式进行检测,质谱参数见表1。
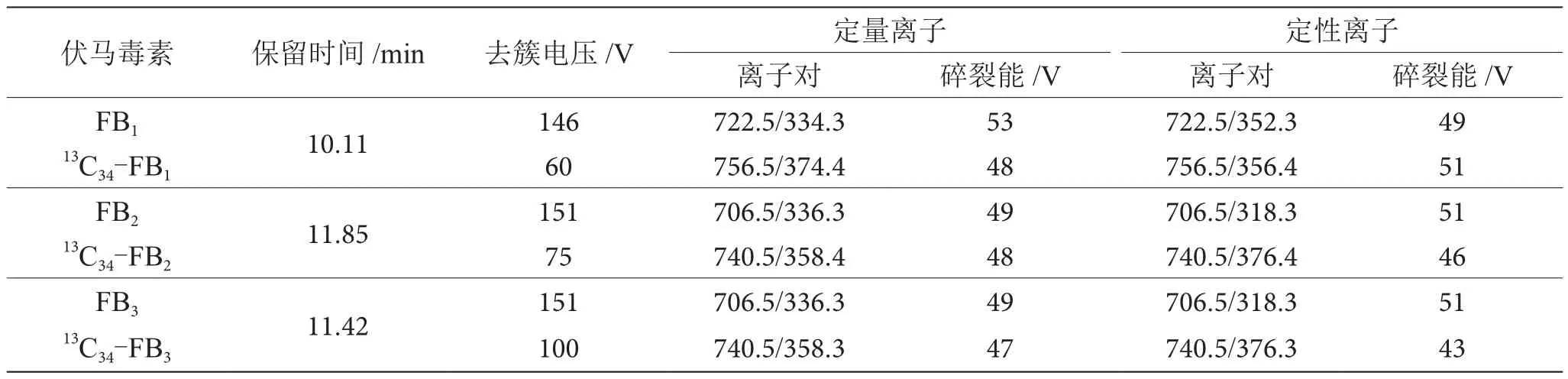
表1 质谱条件参数表
1.2.4 含量计算
伏马毒素含量计算公式为

式中:Xi为样品中伏马毒素的含量,μg·kg-1;Ci为从标准曲线所得测定液中伏马毒素的浓度,μg·L-1;V为试样的定容体积,mL;m为试样的称样量,g;D为稀释倍数,D=2;为回收率校正因子。
2 结果与分析
在实验过程中,测量不确定度的来源主要有标准溶液的配制、前处理实验过程、标准曲线的拟合、重复性实验和加标回收率实验。
2.1 标准溶液的配制引入的不确定度
2.1.1 标准储备液纯度引入的不确定度
伏马毒素标准储备液纯度引入的不确定度结果见表2。
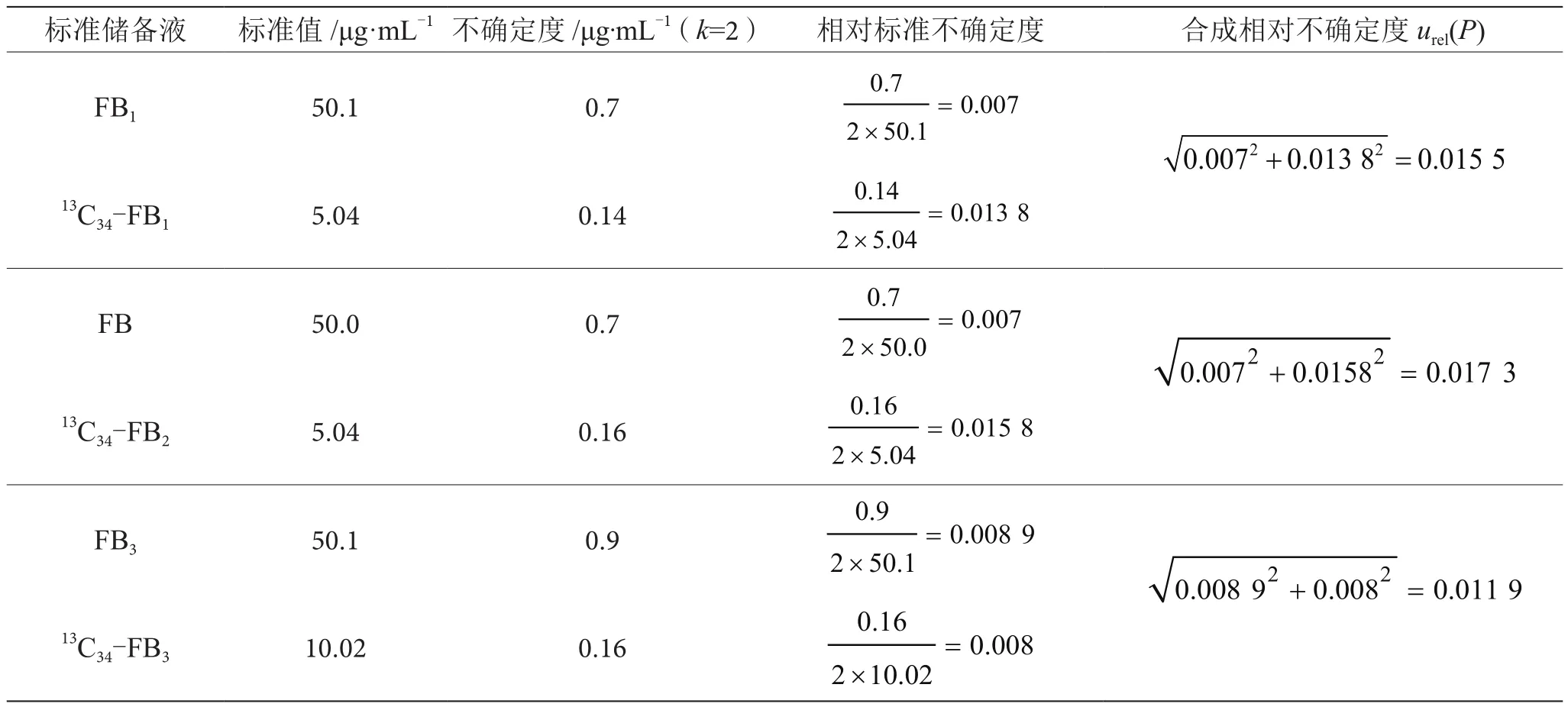
表2 标准储备液纯度引入的不确定度表
2.1.2 配制标准工作液引入的不确定度
将 50 μg·mL-1伏 马 毒 素 混 合 储 备 液 稀 释 到5 μg·mL-1。依据检定规程,配制过程中使用5 mL单标线容量瓶2次(矩形分布);5 mL移液枪3次,1 mL移液枪3次,100 μL移液枪6次(三角分布),引入的不确定度见表3。
由于同位素内标浓度不参与结果计算。因此,配制标准工作液引入的合成相对标准不确定度为
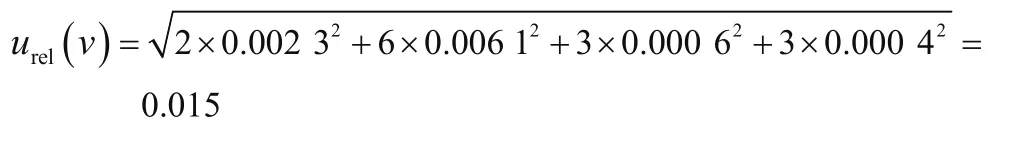
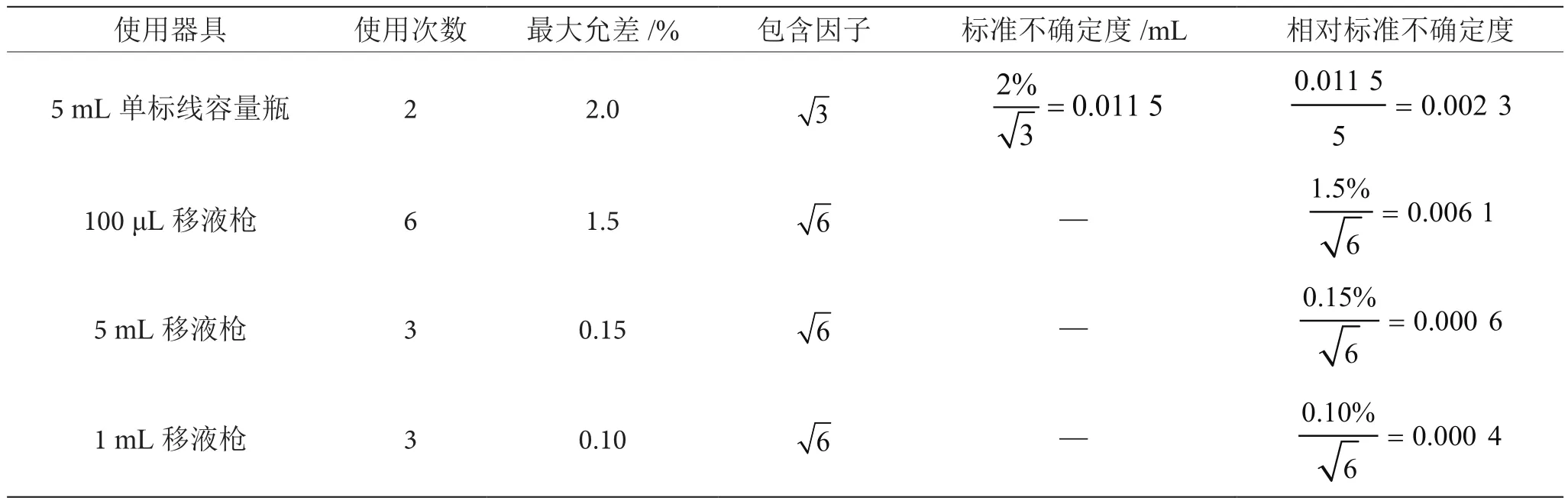
表3 使用器具引入的不确定度表
2.1.3 温度引入的不确定度
实验室温度为(20±5)℃。标准中间工作液用乙腈定容,室温20 ℃其膨胀系数为1.37×10-3/℃。依据矩形分布,相对标准不确定度为
2.2 前处理引入的不确定度
2.2.1 称量引入的不确定度
天平校准鉴定证书给定误差0.5 mg,准确称量2.00 g时,相对标准不确定度为
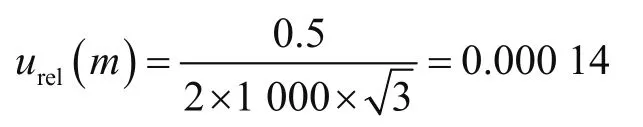
2.2.2 量取提取液引入的不确定度
样品提取时,使用10 mL移液枪准确量取乙腈∶水∶甲酸=80∶18∶2溶液,根据校准证书,20 ℃时允差为0.14%,标准不确定度(三角分布)为样品提取后,5 mL移液枪量取5 mL上清液氮吹,20 ℃时允差为0.15%,标准不确定度(三角分布)为则量取提取液时引入的相对标准不确定度为
2.3 标准曲线拟合引入的不确定度
配制浓度为 2 μg·L-1、4 μg·L-1、8 μg·L-1、20 μg·L-1、40 μg·L-1和 80 μg·L-1的标准溶液。以浓度为横坐标,峰面积比为纵坐标,标准曲线方程和线性相关系数r2由最小二乘法线性拟合得到,具体结果见表4。
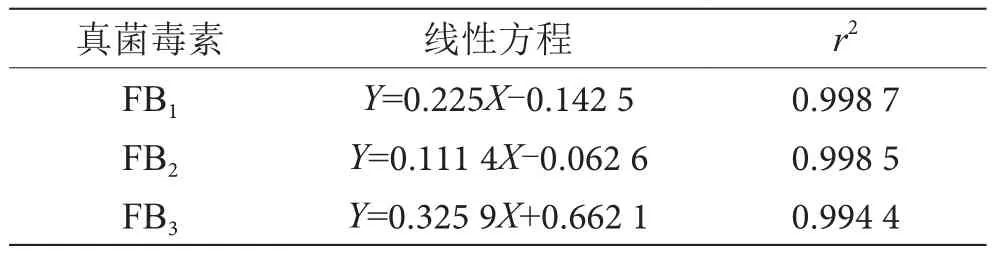
表4 拟合标准曲线表
拟合的标准曲线作为定量标准。仪器测量值与理论计算值的标准偏差为

标准溶液残差平方和为

标准曲线拟合产生的不确定度为
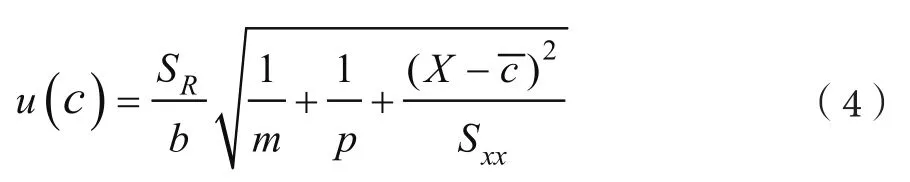
式中:SR为标准曲线Y与相应Yi的回归剩余标准差;p为样品溶液测定总次数,p=6;m为标准溶液的测定总次数,m=6;a为回归系数;X为样品中含伏马毒素含量,μg·L-1;c-为标准溶液中伏马毒素平均值,μg·L-1;ci为各标准溶液中伏马毒素量,μg·L-1;yi为标准溶液各点峰面积/内标峰面积;y为标准溶液各点峰面积/内标峰面积的回归值;b为回归系数。
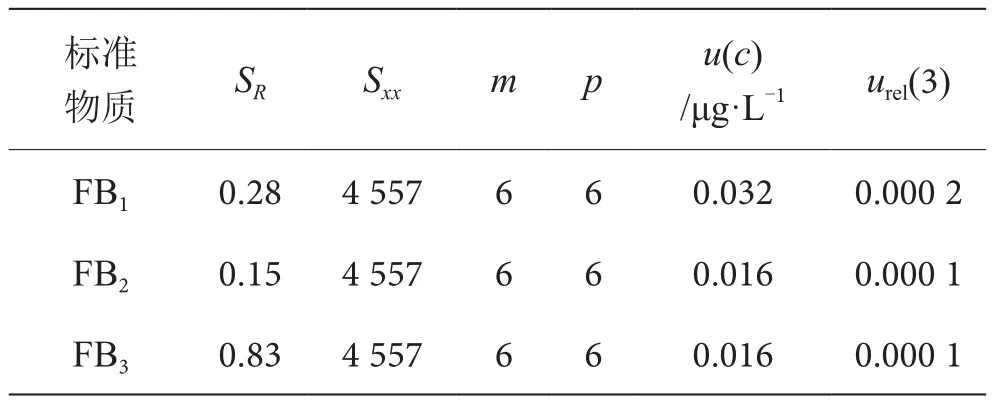
表5 标准曲线拟合引入的不确定度结果表
2.4 重复性实验引入的不确定度
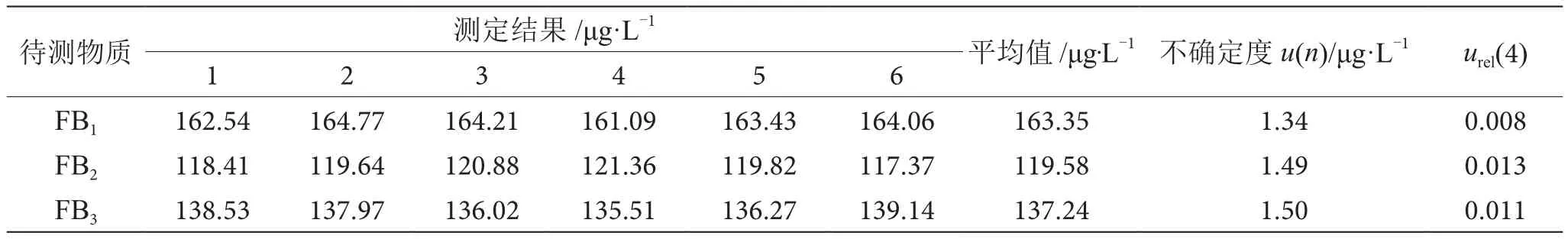
表6 样品重复测定检测及不确定度结果表
2.5 加标回收引入的不确定度
空白玉米样品加入4 g·L-1的标准溶液进行6次加标回收实验。加标回收引入的相对标准不确定度为对平均加标回收率进行显著性检验,确定平均加标回收率与期望值1是否存在显著性差异,并用t检验表示。自由度f=n-1=5,查t值临界值分布表,t值均大于双侧临界值t(0.05,5)=2.571,表示结果存在显著性差异,用回收率校正因子修正。伏马毒素的回收率和不确定度结果见表7。

表7 伏马毒素的回收率和不确定度结果表
2.6 合成标准不确定度与扩展不确定度
合成标准不确定度为

根据JJF 1059.1—2012,置信水平为95%时,包含因子k=2,扩展不确定度为U(X)=k×X×urel(X),3种伏马毒素的扩展不确定度及检测结果见表8。
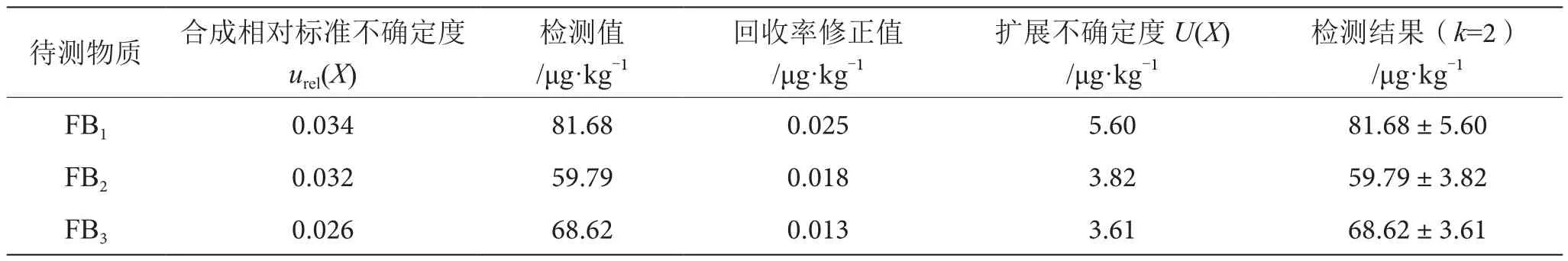
表8 伏马毒素的检测结果表
3 结论
本实验综合考虑各因素,发现在检测过程中,标准曲线拟合引入的相对不确定度最小,标准溶液的配制过程中引入的相对不确定度最大。因此在实验中,配制标准溶液时需遵守操作步骤,移液枪、液相色谱、质谱等设备进行定期维护检修,保持高灵敏度,定期检定校准,提高准确性。
