硬段含二硫键聚氨酯复合材料的生物骨黏合性
2022-10-19刘欣畅王新灵肖海军
肖 伟,刘欣畅,郑 震,王新灵,肖海军
(1. 上海交通大学化学化工学院, 上海 200240;2. 上海市奉贤区中心医院骨科, 上海 201400)
骨折是指由于外部创伤或自身病理导致骨组织内损伤的现象,常见于儿童和老人。每年约有数百万人因运动损伤、交通事故、跌倒以及癌症等引起的成骨不全、骨质疏松或骨质退化等疾病而遭受各种骨折[1]。骨钉等金属植入物是目前治疗骨折的主流方式,但仍存在一些临床问题,包括治疗费用高、需二次手术取出、应力屏蔽、小骨碎片难以固定等[2,3]。因此,医用骨黏合剂应运而生。理想骨胶黏剂应满足以下要求:血液等生化条件下具备一定的黏接强度;良好的生物相容性,允许骨髓干细胞的增殖、黏附和分化;易于制备、储存和使用等。目前市面上骨填充支架材料的产品很多,但还没有一种骨黏合剂能够满足所有的临床需要。
聚甲基丙烯酸甲酯(PMMA)骨水泥和磷酸钙(CPC)骨水泥是目前研究较多的两类骨黏合材料。PMMA骨水泥最早在牙科中使用,后来被广泛应用于关节假体固定中[4]。PMMA骨水泥具有生物惰性,难以体内降解,且材料的生物相容性较差,缺乏骨传导性,不利于骨折的恢复和愈合[5]。Zhu等[6]将矿化胶原(MC)加入PMMA骨水泥中,开发了一种生物活性复合骨水泥(MC-PMMA),改善了PMMA的生物相容性。CPC骨水泥主要成分为羟基磷灰石或透钙磷石,与天然骨骼的成分近似,因此具备良好的生物相容性,但CPC骨水泥属于无机材料,自身较脆,与骨骼之间仅为物理作用相互连接,相互作用力不强,在骨科手术中更适合用作填充材料[7]。
除了PMMA和CPC类骨水泥,其他材料也陆续被开发用作骨胶黏剂,如丙烯酸酯类[8]、聚醋酸乙烯酯类[9]、硫醇烯类[10]等。2010年美国有一种商品名为Kryptonite®(氪石骨水泥)的骨水泥被批准临床使用[11],其主要成分为蓖麻油改性,由多元醇、异氰酸酯和碳酸钙制备的聚氨酯(PU)复合材料。临床病例显示,这种复合黏合材料即使经过6年的使用,与骨表面依旧结合良好,邻近区域的非骨性组织无明显炎症或黏连[12]。在此基础上,本文以二硫键-谷胱甘肽的还原性降解为改性手段,合成了一种含二硫键的脂肪族二元醇(DSU),将其以硬段形式引入聚氨酯胶黏剂体系中,探究了DSU对改性聚氨酯胶黏剂(PU-DSU)的结构和性能的影响,获得了一种黏接性能强、生物相容性优秀的聚氨酯骨胶黏剂。
1 实验部分
1.1 原料和试剂
蓖麻油:分析纯,上海泰坦科技股份有限公司;催化剂TOYOCAT-TF(牌号):分析纯,日本东曹株式会社;二苯基甲烷二异氰酸酯(MDI)、单质硫:分析纯,上海阿拉丁试剂有限公司;Na2S·9H2O、6-溴-1-己醇:分析纯,北京伊诺凯科技有限公司;羟基磷灰石(HA):w=99%,南京埃普瑞纳米材料有限公司;大鼠骨髓间充质干细胞(BMSCs):赛业生物科技有限公司;胎牛血清:Corning公司;DMEM细胞培养基:Gibco公司;染色剂钙黄绿素AM(Calcein-AM): Sigma-Aldrich公司。多巴胺接枝改性蓖麻油多元醇(DACO):自制,羟值为260 mg KOH/g,接枝率为多巴胺与蓖麻油的物质的量之比,其数值等于1。所有多元醇在使用前均需在110 ℃真空烘箱中干燥2 h除水。
1.2 测试与表征
采用布鲁克公司AVANCE Ⅲ HD 500型核磁共振波谱仪对DSU进行1H-NMR表征;采用MTS公司Criterion 43型万能电子试验机对样品进行压缩性能测试;采用FEI公司Nova NanoSEM 450型场发射扫描电子显微镜对样品进行微观结构表征;采用Kruss公司DSA30型光学接触角测量仪对样品进行表面水接触角测试;将市场购买的新鲜猪肋骨抛光成10 mm×10 mm×40 mm,沿中线切断,采用聚氨酯胶黏剂黏接固定好后,黏接试样用磷酸盐(PBS)缓冲液浸湿的纱布包覆(或浸泡在新鲜兔血液中),分别模拟体内环境,在37 ℃固化24 h后,采用对接拉伸模式测定试样的黏接强度;将样品切成薄片置于0.1 mol/L、pH = 7.4的PBS溶液中,于37 ℃恒温震荡箱中震荡降解,测试样品的体外降解性能;将大鼠BMSCs细胞与支架共培养1、3、5 d后,经Cell Counting Kit-8试剂盒(CCK-8)处理,采用Tecan公司Infinite M1000 PRO型酶标仪检测细胞培养液在 450 nm波长下的光密度(OD)值;用Calcein-AM对细胞进行染色,采用徕卡公司TCS SP8 STED共聚焦显微镜观察样品的生物相容性。
1.3 实验步骤
1.3.1 DSU的合成[13]准确称取12 g Na2S·9H2O晶体溶于100 mL去离子水中,加入0.8 g硫,升温至40 ℃,搅拌至完全溶解后再加入剩余0.8 g硫,完全溶解后所得溶液即为过硫化钠溶液。称取18.11 g 6-溴-1-己醇溶于100 mL无水乙醇中,逐滴加入过硫化钠溶液中,50 ℃下搅拌过夜。待反应结束后,旋蒸除去乙醇,剩余液体用30 mL乙酸乙酯分2次萃取分液,经无水硫酸钠干燥、过滤除去固体杂质,再旋蒸除去乙酸乙酯,80 ℃真空干燥24 h,所得产物即为DSU。合成反应式见图1。

图1 DSU的合成Fig. 1 Synthesis of DSU
1.3.2 DACO的合成称取100 g蓖麻油、10 g Al2O3、15 g乙酸置于三颈瓶中,转速400 r/min下滴加70 gw=30%双氧水,60 ℃搅拌反应10 h,反应完全后,用w=3%碳酸钠溶液洗至中性,乙酸乙酯萃取,旋蒸得到环氧改性蓖麻油;称取50 g环氧改性蓖麻油溶于100 mL乙醇中,加入19 g盐酸多巴胺、100 mL DMF溶剂和3 g高氯酸锌,用三乙胺调节使体系pH = 8,N2氛围下80 ℃反应24 h,反应结束后,室温下用pH = 2的盐酸溶液洗至中性,乙酸乙酯萃取,无水硫酸钠干燥,过滤去除不溶杂质,旋蒸后得到产物DACO,密封保存。
1.3.3 MDI封端预聚体的合成取10 g干燥蓖麻油加入到N2氛围保护的三颈烧瓶中,加入15 g MDI于烧瓶中,加热至80 ℃反应3 h,冷却后得到―NCO封端的预聚体。采用甲苯-二正丁胺法测定聚氨酯预聚体中的剩余―NCO含量,低温密封备用。
1.3.4 PU-DSU的制备以PU-DSU-10(其中10表示m(DSU)∶m(DACO)=10%,其余类推)为例,具体制备方式如下:将3.0 g DACO、135 μL催化剂TOYOCAT-TF、15 μL发泡剂去离子水、0.3 g DSU及0.24 g HA加入烧杯中,在室温下以1 500 r/min搅拌5 min混合均匀。然后按―NCO与―OH官能团物质的量比为1∶1计量加入4.86 g MDI封端预聚体中,1 000 r/min下搅拌30 s,混合均匀后转移至模具中,37 ℃固化24 h。
2 结果与讨论
2.1 DSU的1H-NMR表征
DSU和6-溴-1-己醇的1H-NMR谱图如图2所示。3.41和1.85处的核磁峰对应着Br取代α和β位上的亚甲基基团;当Br被二硫键取代后,由于取代基电负性的降低,α和β位上亚甲基的化学位移会降低至2.68和1.67。1H-NMR (500 MHz, CDCl3)δ: 3.61~3.65 (t,J=7.0 Hz, 2 H), 2.66~2.71 (t,J=7.5 Hz, 2 H), 1.95 (m, 1 H),1.65~1.71 (m, 2 H), 1.55~1.60 (m, 2 H), 1.36~1.44 (m, 4 H)。
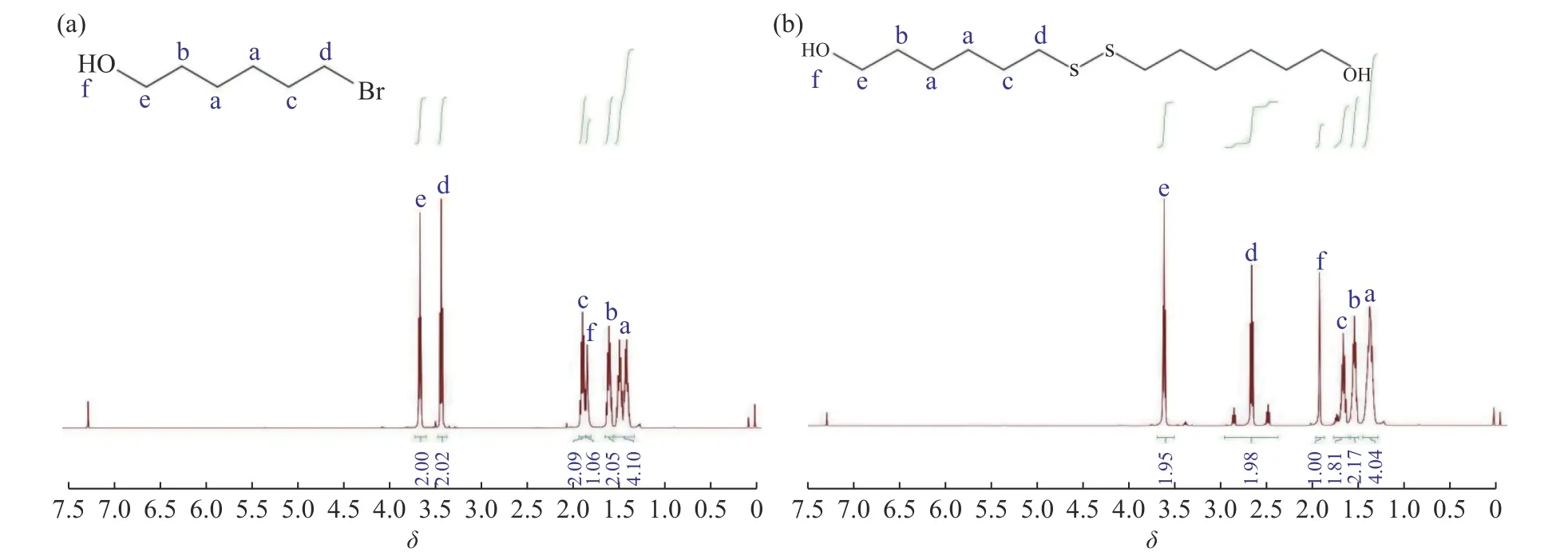
图2 6-溴-1-己醇(a)和DSU(b)的1H-NMR谱图Fig. 2 1H-NMR spectra of 6-bromo-1-hexanol (a) and DSU (b)
2.2 PU-DSU的力学性能
PU-DSU形变50%时的压缩性能如图3所示。当DSU的用量(m(DSU)∶m(DACO),下文同)在0~20%时,随着DSU用量的增加,材料的压缩性能呈增强趋势,压缩强度从5.9 MPa增大至8.5 MPa,压缩模量从29.7 MPa增大至59.2 MPa。当DSU用量为10%时,材料的压缩强度为7.0 MPa,压缩模量为41.3 MP。这是由于DSU为短链脂肪族二元醇,羟值和线性结构规整度高,DSU的添加使聚氨酯中硬段结晶度增加,内聚能增加,材料的抗压缩性能增强,压缩强度和压缩模量均得以提升。

图3 PU-DSU的(a)压缩强度和(b)压缩模量Fig. 3 (a) Compressive strength and (b) compressive modulus of PU-DSU
2.3 PU-DSU的微观结构
样品的SEM微观形貌如图4所示。PU与PU-DSU的微孔结构、表观密度和平均泡孔尺寸相差不大,表观密度维持为450~475 kg/m3,平均泡孔尺寸在150 μm左右。这种多孔结构有利于细胞生长和迁移,为骨组织的愈合提供了条件[14]。
2.4 PU-DSU的水接触角
由于DSU为短链脂肪族二醇,结构更规整,DSU的添加会促进氨基甲酸酯等极性基团聚集,造成聚氨酯的微相分离程度加深,所以蓖麻油长链疏水结构对材料表面的影响加深。PU-DSU的水接触角如图5所示。随着DSU用量的增加,PU-DSU静态水接触角呈增大趋势:当不添加DSU时,其接触角为64°;而当DSU的用量为15%时,水接触角增大至80°;当DSU用量为20%时,接触角仅增大至81°。随着DSU用量的增加,PU-DSU的疏水性增强,增幅具有先大后小的特点,说明此时PU-DSU的海-岛分离结构已趋于稳定。

图5 PU-DSU胶黏剂的水接触角Fig. 5 Water contact angle of PU-DSU
2.5 PU-DSU的黏接性能
PU-DSU的黏接强度测试结果如图6所示。在PBS缓冲液体系中,随着DSU用量的增加,胶黏剂的骨组织黏接能力呈现先上升后下降的趋势。当DSU用量为10%时,胶黏剂的骨黏接强度最高可达0.97 MPa;而当DSU用量增至20%时,黏接强度又回跌至0.57 MPa。这是因为与蓖麻油相比,DSU的羟值较高、结构更规整,少量添加会使胶黏剂中起黏接效果的硬段比例增加,黏接性能提升;但骨组织是由磷酸钙盐和蛋白质等组成的有机-无机杂化体系,表面呈亲水性,随着DSU用量的进一步增加,胶黏剂的疏水性增强,表面浸润性变差,黏接强度继而发生下降,故DSU的最佳用量为10%。在新鲜兔血液中的黏接实验同样证实了该结论,由于血液中血红蛋白等生化物质的影响,胶黏剂的黏接强度降低,当DSU的用量为10%时,最大黏接强度为0.49 MPa。据报道,市面上常见的CPC类和PMMA类商品化骨水泥,在水和血液中的最大黏接强度均不超过0.2 MPa[15]。本文所制备的PU-DSU胶黏剂在生物骨黏合方面优势明显。

图6 PU-DSU胶黏剂的骨黏接强度Fig. 6 Bone bonding strength of PU-DSU
2.6 PU-DSU的体外降解性能
PU-DSU-10在不同谷胱甘肽(GSH)质量浓度下的降解情况如图7所示。样品在pH=7.4的PBS缓冲液中水解速率较慢,14周后仅降解0.79%。随着GSH质量浓度的增大,样品的降解速率明显增大,14周后的质量损失率增大至1.24%,降解速率提升57%。

图7 PU-DSU-10在GSH溶液中的降解曲线Fig. 7 Degradation of PU-DSU-10 in GSH solutions
2.7 PU-DSU的生物相容性
PU-DSU-10的生物相容性测试结果见图8。图8 (a)为不同培养时长下BMSCs的细胞活性。在第3 d时,PU-DSU-10样品中的BMSCs细胞数量大幅增加,这可能是因为样品的多孔结构为BMSCs细胞提供了更多的黏附空间,有利于其增殖,但培养基中营养物质有限,一段时间后细胞数量达到均衡。图8 (b)和图8 (c)则显示了BMSCs细胞在样品表面的黏附情况,可以清晰观察到活细胞在样品表面的增殖和黏附,PU-DSU-10具有优良的细胞相容性。
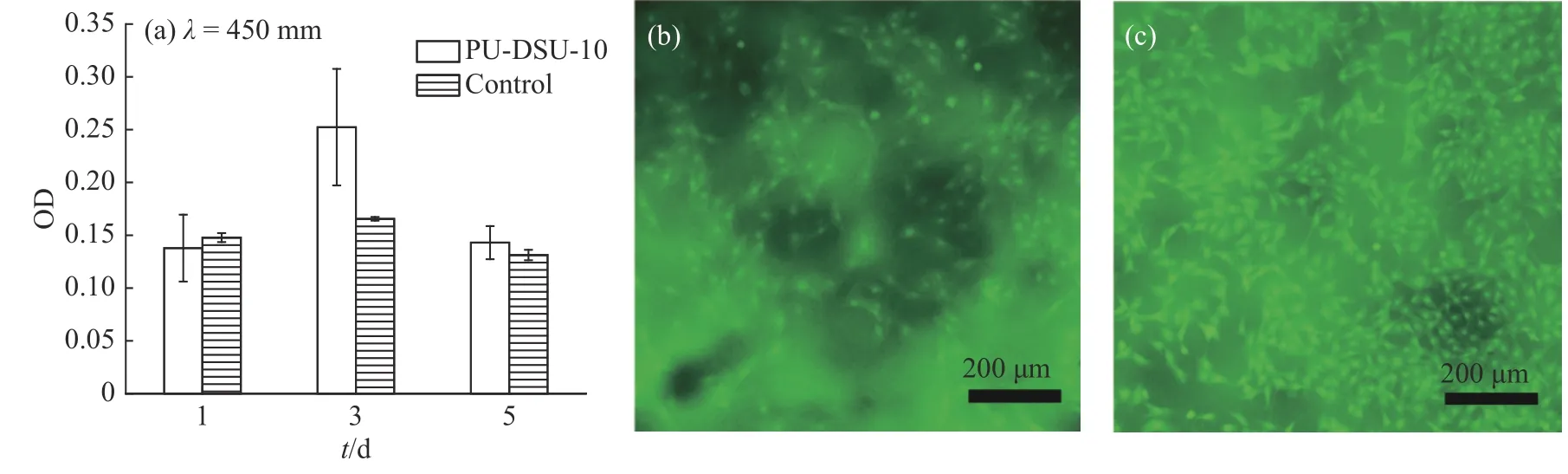
图8 PU-DSU-10的(a)细胞活性,培养(b) 3 d后和(c) 5 d后的细胞形态Fig. 8 (a) Cell activity, cell morphology after (b) 3 d and (c) 5 d culture of PU-DSU-10
3 结 论
(1)采用卤代烃的亲核取代反应,成功合成了一种含二硫键的脂肪族二元醇DSU并将其以硬段形式引入聚氨酯体系中。
(2)当DSU用量为10%时,PU-DSU胶黏剂的综合性能较佳,骨组织黏接强度为0.97 MPa,血液等生化条件下黏接强度为0.49 MPa,压缩强度为7.0 MPa,压缩模量为41.3 MPa,在GSH溶液中降解速率提升57%。
(3)PU-DSU骨胶黏剂具有良好的细胞相容性,其多孔结构有利于细胞的增殖和黏附。
