Zr-Fc MOF@MN复合微针的制备及其光热抗菌性能
2022-10-19袁颖慧尚亚廷郭江娜周莹杰
袁颖慧,尚亚廷,郭江娜,周莹杰,严 锋,
(1. 东华大学材料科学与工程学院, 纤维材料改性国家重点实验室, 上海201620;2. 苏州大学材料与化工学部, 江苏省新型功能高分子材料工程实验室, 江苏 苏州215123)
皮肤和软组织感染是临床上常见的复杂感染,影响范围广且发病率和死亡率高[1]。常规皮肤慢性感染多采用含抗生素药膏涂敷到患处表面治疗,但药物的利用率低且细菌易向皮下组织迁移,导致涂敷的药膏对皮肤深处的感染无效。微针(MN)可以以微创方式穿透皮肤角质层,将药物递送至皮下细菌感染部位,是一种皮下感染的有效治疗方式[2]。可溶解微针一般由水溶性聚合物如聚乙烯醇(PVA)、聚乙烯吡咯烷酮(PVP)和透明质酸(HA)等制备而成[3,4]。当微针插入皮肤组织接触到组织液后,聚合物快速溶解并释放出针内药物,其制作方式简单、成本低,与其他类型的微针相比具有更好的工业化前景。PVA和PVP是常见的水溶性高分子,被广泛应用于医药、生物等领域[5-7]或制备生物安全性水溶性微针。在微针内部可以封装多种抗菌活性物质[8](如氯霉素[9]、两性霉素B[10]、新型抗菌肽[11]、水杨酸[12]以及阳离子聚合物[13-17]等)用于细菌感染治疗。传统抗生素存在诱发细菌耐药性的风险,因此开发新型抗菌剂并进一步构建高效微针组合策略,以提高其在抗菌应用中的疗效仍是目前面临的重要挑战。
光热疗法(PTT)是一种利用光热剂在近红外光照射下将光能转化为热能产生局部热量,造成不可逆的细胞损伤局部治疗方式,具有远程可控性、低毒性和较少的副作用等优点[18]。PTT最初是癌症治疗的替代疗法,而近年来PTT作为一种广谱抗菌的物理杀菌方式,因具有治疗时间短、不产生耐药性等特点,在细菌感染治疗领域备受关注[19]。常见的光热剂有银纳米粒子[20]、金纳米粒子[21]、聚多巴胺[22]以及金属有机框架(MOF)[23]等。其中MOF作为一种新型光热剂,高摩尔消光系数以及独特的电子结构,使其光热转换效率与其他光热剂相比具有明显优势[24],因而更受青睐。传统的PTT疗法材料用于治疗皮下感染时多采用注射方式,将光热剂注射到细菌感染部位,给患者造成一定痛苦,因而需要构建新的低损伤或无痛策略将光热剂输送至感染部位。
本文将具有高光热转换效率的锆-二茂铁基MOF(Zr-Fc MOF)纳米片负载到可溶解微针基质(V(PVA)/V(PVP)=1/2)中制备具有光热抗菌性能的微针。首先利用氯化锆(ZrCl4)与1,1’-二茂铁甲酸(Fc(COOH)2)有机配体、乙酸(CH3COOH)调节剂的水热反应制备生成Zr-Fc MOF纳米片,并进一步将其负载到PVA/PVP微针中制备Zr-Fc MOF@MN,研究了Zr-Fc MOF及Zr-Fc MOF@MN在808 nm近红外光下的光热性能及抗菌性能。
1 实验部分
1.1 原料和试剂
Fc(COOH)2、N,N-二甲基甲酰胺(DMF)、CH3COOH:化学纯,上海泰坦科技股份有限公司;聚乙烯醇(PVA, 1799型)、聚乙烯吡咯烷酮(PVP, K30型,Mw=4.0×104):上海泰坦科技股份有限公司;ZrCl4:化学纯,上海迈瑞尔化学技术有限公司;曲拉通:x-100 型,上海源叶生物科技有限公司;聚二甲基硅氧烷(PDMS)微针模具:微针针列数量 15×15,微针贴片外围尺寸 15.2 mm×15.2 mm,台州微芯医药科技有限公司;LB培养基:杭州微生物试剂有限公司;金黄色葡萄球菌(S. aureusATCC 6538)、大肠杆菌(E. coli8099):由苏州大学提供。
1.2 Zr-Fc MOF的制备
将ZrCl4(1.5 mmol),Fc(COOH)2(1.5 mmol)和CH3COOH(75 mmol)溶于45 mL的DMF中,超声处理10 min后,置于100 mL的聚四氟乙烯容器中,在150 ℃下进行水热反应,12 h后离心(10 kr/min,15 min)去除上清液并收集得到粗产物。将粗产物依次用DMF和去离子水超声清洗、离心,重复3次,除掉未反应的物质。最终所得Zr-Fc MOF分散在水中,超声20 min并储存备用。表征前将Zr-Fc MOF分散液放入真空冷冻干燥机中干燥,得到Zr-Fc MOF纳米片粉末。
1.3 Zr-Fc MOF的结构表征与性能测试
1.3.1 Zr-Fc MOF的结构表征X射线衍射(XRD)仪:德国布鲁克公司D2 Phaser型,测试范围5°~40°;冷场发射扫描电子显微镜(SEM):日本日立公司SU8010型,喷金45 s,电压1 kV;纳米粒度与电位分析(DLS)仪:英国马尔文公司Nano ZS型,水为溶剂,样品质量浓度为1 mg/mL;傅里叶红外光谱(FT-IR)仪:美国赛默飞世尔科技公司Nicolet iS50型,KBr压片制样,波数范围4 000~500 cm-1,扫描次数32次。
1.3.2 Zr-Fc MOF的性能测试 光热性能:采用808 nm近红外激光器(中国上海熙隆光电科技有限公司FC-808-2000-MM型)照射Zr-Fc MOF的水分散液,通过红外线热像仪(美国菲力尔公司FLIR One型)记录温度随时间的变化。
抗菌性能:经Zr-Fc MOF处理后的菌液(S. aureus,105CFU/mL或E. coli,108CFU/mL)在37 ℃培养箱中共培养4 h,取10 μL菌液滴加到LB固体培养基上涂板,每组3个平行样。平板倒置放到37 ℃培养箱中12 h后,取出平板拍照并记录细菌菌落数,与Zr-Fc MOF共培养的细菌为试验组,未与Zr-Fc MOF共培养的细菌为阴性对照组,通过试验组和对照组的菌落数计算抗菌率(Ra),计算公式如下:

其中:Nnegative为阴性组的细菌菌落数,Nsample为试验组的细菌菌落数。
细菌微观形貌:在96孔板底部放入无菌聚对苯二甲酸乙二醇酯(PET)薄膜,然后加入等体积的Zr-Fc MOF溶液与菌液,在有/无近红外光照处理后,将孔板放置在37 ℃的培养箱4 h。培养结束后,取出PET薄膜并浸入w=2.5%的戊二醛溶液中固定2 h,然后用体积分数为10%、20%、30%、50%、70%、80%、90%和100%的乙醇溶液进行梯度脱水,通过SEM观察细菌形貌。
1.4 微针贴片的制备和性能测试
1.4.1 微针贴片的制备以PVA和PVP为微针基质,制备可溶性微针。首先称取不同质量的PVA,溶于10 mL去离子水中,浸泡12 h使PVA粒子溶胀,再置于98 ℃的油浴锅中搅拌12 h,使其充分溶解,最终获得PVA-X(X为聚合物溶液的质量分数,下文同)。称取不同质量的PVP溶于10 mL的去离子水中,获得PVP-X。将两者以不同比例混合,获得微针基质混合液。取适量滴入PDMS微针模具中,抽真空将针尖和组分内的空气抽出,重复进行抽放操作,使聚合物进入微针针尖,然后放入烘箱(60 ℃)干燥,将成型的微针贴片与模具剥离。将Zr-Fc MOF 加入聚合物混合基质中,其他步骤与前述相同,即可制得负载Zr-Fc MOF的微针(Zr-Fc MOF@MN),微针贴片的制备过程如图1所示。用光学显微镜观察微针形貌,并测量尺寸。
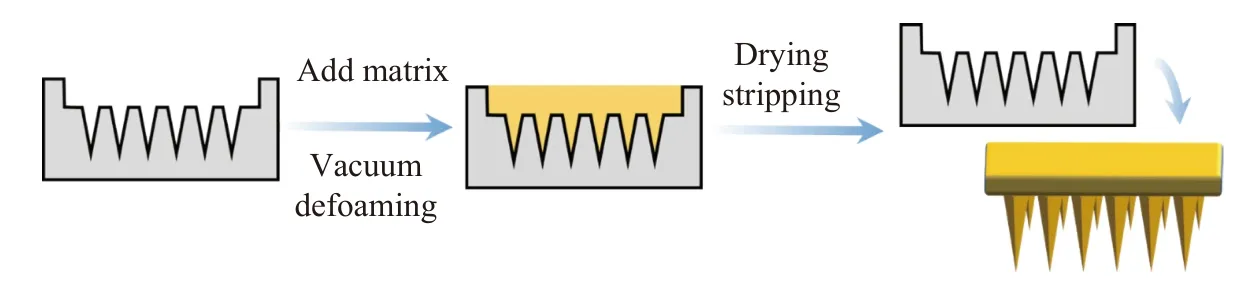
图1 微针贴片制备流程Fig. 1 Preparation process of microneedle patch
1.4.2 微针贴片的溶解性能制备负载罗丹明B(RhB)的微针(Zr-Fc MOF@RhB@MN)贴片,并裁剪成2块3 mm×3 mm样品,分别放置到1 mL的去离子水中,分别放置于室温环境和60 ℃烘箱中,1 h后观察微针贴片的形貌变化以及RhB的释放情况。
1.4.3 抗菌性能取10 μL菌 液(106CFU/mL)滴 在Zr-Fc MOF@MN上,用808 nm近 红 外 光 照 射10 min(2.6 W/cm2)后在37 ℃的培养箱中培养。4 h后加入900 μL LB液体培养基稀释菌液,并进行涂板,每组3个平行样,培养24 h后记录菌落数。Zr-Fc MOF(250 μg/mL)的抗菌性能测试步骤同上。其中对照组为100 μL的磷酸盐(PBS)缓冲液与100 μL菌液共培养。为验证温度的影响,设置对照组,即100 μL的PBS缓冲液与100 μL菌液混合放置在57.4 ℃的水浴锅内10 min,再放入37 ℃的培养箱中共培养,培养时间均为4 h。抗菌率计算公式与“1.3.2”部分相同。
1.4.4 溶血测试取4 mL新鲜血液,1 500 r/min离心15 min后收集底部红细胞,用PBS缓冲液洗涤至上清液澄清,最后获得的红细胞用PBS缓冲液配制成体积分数2%的溶液。将制备的Zr-Fc MOF(250 μg/mL)、Zr-Fc MOF@MN、φ=2%的曲拉通以及PBS缓冲溶液,各取100 μL与100 μL的红细胞混合,其中Zr-Fc MOF和Zr-Fc MOF@MN设置808 nm近红外激光照射10 min(2.6 W/cm2)光照组和无光照组,φ=2%的曲拉通与PBS缓冲溶液分别为阳性对照组和阴性对照组,随后在37 ℃的烘箱中共孵育3 h。孵育结束后,离心(1 500 r/min,15 min),吸取100 μL上清液至96孔板,测试576 nm处的光密度(OD)值。溶血率(RH)计算公式如下:
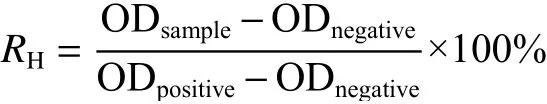
其中:ODnegative,ODpositive分别为阴性组和阳性组的光密度值,ODsample为试验组的光密度值。
2 结果与讨论
2.1 Zr-Fc MOF的结构表征
水热法合成Zr-Fc MOF纳米片是一种自下而上的合成方法[25,26],通过控制MOF晶体生长方向,Zr6作为金属次级构筑单元(SBU),Fc(COOH)2作为有机配体,合成二维纳米片,其制备示意图如图2所示。
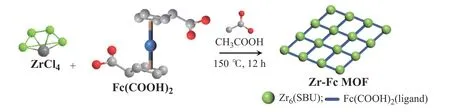
图2 Zr-Fc MOF的制备示意图Fig. 2 Schematic diagram of Zr-Fc MOF preparation
图3 (a)为Zr-Fc MOF的XRD图谱,其XRD衍射峰与之前的报道一致,二维晶体结构的晶胞参数与文献[26,27]相同。在Zr-Fc MOF的FT-IR图谱(图3 (b))中可观察到Fc(COOH)2的特征峰,其中1 697 cm-1处为C=O的伸缩振动吸收峰,1 494 cm-1处为茂环上C=C的伸缩振动吸收峰,784 cm-1处为茂环上C-H的弯曲振动吸收峰[28],这些特征峰表明了二茂铁结构的存在。Zr-Fc MOF纳米片的尺寸测试结果如图3 (c)所示,Zr-Fc MOF平均尺寸为673.3 nm。Zr-Fc MOF为矩形片层结构,同时SEM观察到存在边缘蜷曲片层(图3 (d))。上述测试结果证明成功合成了Zr-Fc MOF纳米片。
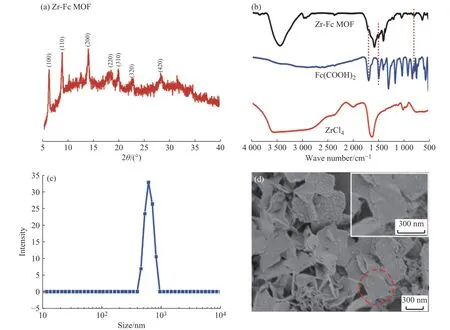
图3 Zr-Fc MOF的(a)XRD谱图、(b)FT-IR谱图、(c)粒径分布图和(d)SFM微观形貌照片Fig. 3 (a) XRD pattern, (b) FT-IR spectra, (c) size distribution and (d) SEM microtopography of Zr-Fc MOF
2.2 Zr-Fc MOF 的光热性能
Zr-Fc MOF具有高光热转换效率[25],Zr-Fc MOF的光热性能测试结果如图4所示。随着Zr-Fc MOF质量浓度的增加和光照时间的延长,Zr-Fc MOF分散液的温度不断升高,在光照10 min左右达到平衡值。当光功率密度为2.6 W/cm2时(图4 (a)),300、400、500 μg/mL的Zr-Fc MOF分散体系在光照10 min后温度可分别达到42.0、57.4、52.5 ℃,分别提高约22.0、37.4、32.5 ℃。在相同条件下,水的温度略有上升,经过20 min的照射,温度只增加了6.7 ℃。光功率密度对体系的光热性也具有一定影响,当光功率密度为0.65 W/cm2时(图4 (b)),500 μg/mL的Zr-Fc MOF分散液的最高温度仅为31.2 ℃,明显低于2.6 W/cm2光照下的温度。此外,由热成像图(图4 (c))分析也观察到了类似的温度变化。上述结果表明Zr-Fc MOF具有良好的光热性能。
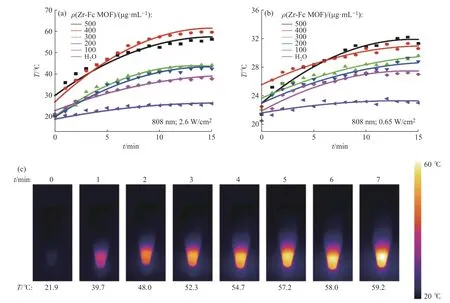
图4 (a,b)Zr-Fc MOF在近红外光照射下的温度随时间变化曲线;(c)近红外光(808 nm,2.6 W/cm2)照射下Zr-Fc MOF分散液(ρ=500 μg/mL)的热红外图像Fig. 4 (a,b)Time-temperature change curves of Zr-Fc MOF suspensions NIR irradiation; (c) Thermographic images of Zr-Fc MOF (ρ=500 μg/mL) during the NIR irradiation (808 nm, 2.6 W/cm2)
2.3 Zr-Fc MOF的抗菌性能
Zr-Fc MOF的光热抗菌性能如图5所示。将不同质量浓度Zr-Fc MOF与细菌菌液混合,经近红外光照射(10 min)或无光照条件下处理后孵育进行细菌涂板(图5(a,b)),结果显示光照组随着Zr-Fc MOF质量浓度的增加,菌落数目急剧下降。这是由于Zr-Fc MOF质量浓度提高,体系温度升高使细菌细胞膜通透性增加,外膜脂质分子紊乱,细胞膜结构受损,进而导致细菌死亡。光照时间对抗菌效果的影响如图5(c,d)所示,当ρ(Zr-Fc MOF)= 250 μg/mL时,近红外光照10 min,抗菌率可达100%。而当ρ(Zr-Fc MOF)= 125 μg/mL时,细菌菌落数没有随着光照时间的延长而明显减少,因为在该质量浓度下,体系温度最高约为40 ℃,不足以有效杀死细菌。
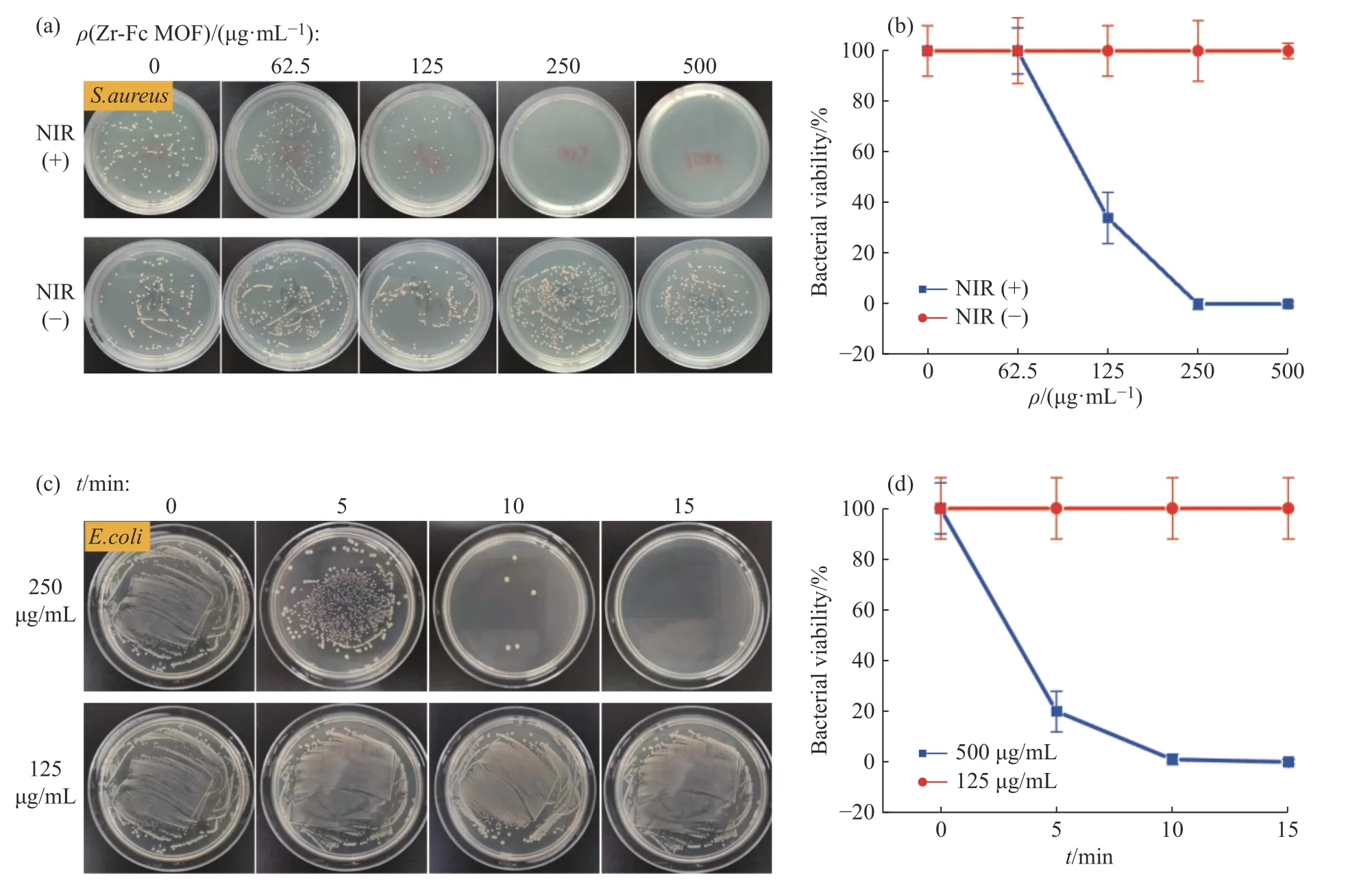
图5 Zr-Fc MOF的抗菌性能Fig. 5 Antibacterial properties of Zr-Fc MOF
Zr-Fc MOF与大肠杆菌和金黄色葡萄球菌作用后细菌形貌的变化如图6所示。阴性对照组(图6(a,a1))中的细菌形貌完整,表面光滑。在无近红外光照射的试验组中(图6(b,b1)),Zr-Fc MOF纳米片与细菌相互黏连,但细菌形貌完整,没有出现细胞凹陷,表明单独的Zr-Fc MOF与细菌作用不能杀灭细菌。近红外照射10 min后,大肠杆菌(图6(c))中间发生凹陷,细菌细胞破裂;金黄色葡萄球菌(图6(c1))边缘发生凹陷,整个细胞干瘪,细菌内溶质流出,结构受损,细菌死亡。

图6 (a~c)大肠杆菌、(a1~c1)金黄色葡萄球菌与Zr-Fc MOF(250 μg/mL)培养后的微观形貌Fig. 6 Bacterial morphology of (a—c) E. coli and (a1—c1) S. aureus after cocultured with Zr-Fc MOF (250 μg/mL)
2.4 微针的制备及表征
当微针配比为V(PVP-5%)∶V(PVA-5%)=1∶1时,所制备微针针体较软,针背充满气泡,整个微针力学性能差(图7(a));进一步调整微针基质配比为V(PVP-30%)∶V(PVA-15%)=2∶1可得到微针针尖形貌完整,针背基体透明,力学性能好的微针(图7(b))。下文采用该基质配比进一步制备负载Zr-Fc MOF的微针。

图7 不同比例和质量分数的PVA和PVP所制备的微针宏观形貌Fig. 7 Macromorphology of microneedles prepared by different proportions and mass fractions of PVA and PVP
制备Zr-Fc MOF@MN的过程如图8所示。从图中可见微针针尖形貌完整、坚固,呈四棱锥形,针尖底边长度约为330 μm,针高约为770 μm,针间间距约为665 μm,Zr-Fc MOF在微针基质中分布较为均匀,且该微针具有一定机械强度。

图8 Zr-Fc MOF@MN的(a)整体视图、(b)侧视图和(c)俯视图Fig. 8 (a) Overall view, (b) side view and (c) vertical view of Zr-Fc MOF@MN
2.5 微针的溶解过程
Zr-Fc MOF@RhB@MN 释放负载药物的性能如图9所示。图9(a,b)分别为刚加入1 mL去离子水时和放置1 h后的微针贴片溶解释放示意图。如图9(b)所示,当温度为25 ℃时,微针形貌仅出现些微溶解,而当温度达到60 ℃时,微针针尖消失,且负载的RhB释放。试验结果表明,可溶性微针具有良好的溶解性和药物释放性能。

图9 Zr-Fc MOF@RhB@MN贴片放置在去离子水中的浸泡1 h(a)前(b)后的微针溶解和RhB释放示意图Fig. 9 Schematic diagram of the dissolution and RhB release of Zr-Fc MOF@RhB@MN patch soak 1 h (a) before and (b) after dipped in deionized water
2.6 Zr-Fc MOF@MN的抗菌性能
Zr-Fc MOF及Zr-Fc MOF@MN的 抗菌性 能 如图10所 示。在2.6 W/cm2的 近 红外光 下 照 射10 min后,Zr-Fc MOF及Zr-Fc MOF@MN温度升高,有效杀死大肠杆菌和金黄色葡萄球菌,抗菌率可达100%。结果表明Zr-Fc MOF负载到微针贴片内仍能发挥优异的光热抗菌作用。
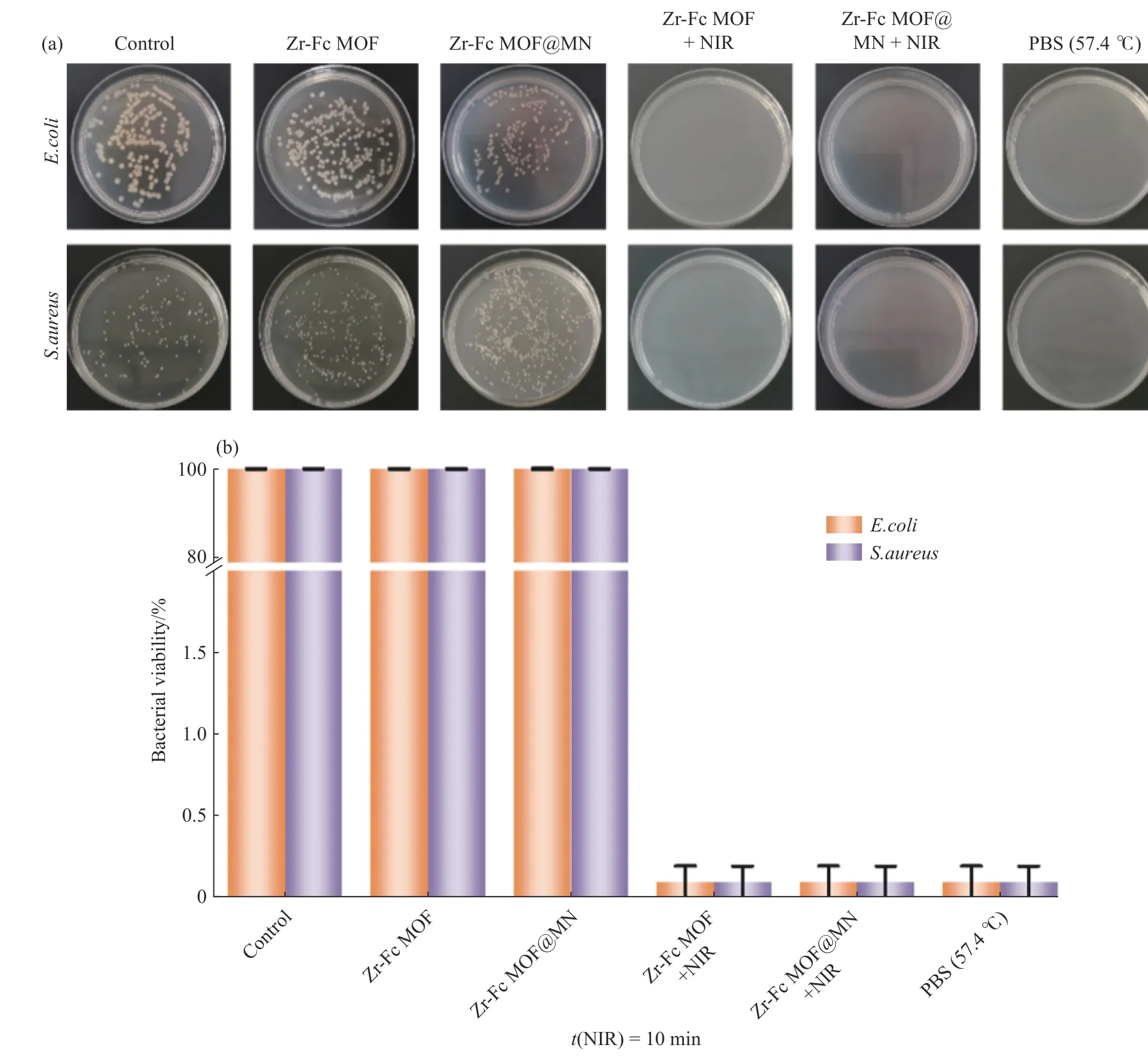
图10 细菌与Zr-Fc MOF和Zr-Fc MOF@MN的(a)细菌菌落图像和(b)细菌存活率Fig. 10 (a) Bacterial colony assay and (b) bacterial viability of bacteria cocultured with Zr-Fc MOF and Zr-Fc MOF@MN
2.7 溶血测试
Zr-Fc MOF及Zr-Fc MOF@MN的生物相容性如图11所示。由图可见,各样品的溶血率均小于1%,符合生物医用材料的溶血标准(小于5%),即表明Zr-Fc MOF及Zr-Fc MOF@MN具有较低的溶血性。

图11 Zr-Fc MOF和Zr-Fc MOF@MN的溶血率Fig. 11 Hemolysis ratios of Zr-Fc MOF and Zr-Fc MOF@MN
3 结 论
(1)Zr-Fc MOF纳米片具有良好的光热性能,其温度随着光照时间及近红外光功率的增加而上升。
(2)在250 μg/mL的质量浓度下,近红外光照10 min后,Zr-Fc MOF即可实现抗菌率100%的抗菌效果。
(3)Zr-Fc MOF@MN微针贴片在2.6 W/cm2的近红外光照10 min条件下抗菌率达100%,抗菌性优异。
