肿瘤坏死因子α诱导蛋白3相互作用蛋白1调控核因子κB信号通路在IDH野生型胶质瘤中的作用机制
2022-10-19彭一鹏周晓飞王剑藏春光张悦盼辛雪朱春丽付朋
彭一鹏 周晓飞 王剑 藏春光 张悦盼 辛雪 朱春丽 付朋
武汉市红十字会医院1神经外科,2神经内科(武汉 430015);3华中科技大学附属协和医院神经外科(武汉 430022)
神经胶质瘤是中枢神经系统中最常见的原发性致命肿瘤[1]。根据世界卫生组织对中枢神经系统肿瘤的最新分类,神经胶质瘤可分为IDH 野生型和IDH 突变型[2]。与IDH 突变型胶质瘤相比,IDH野生型胶质瘤(IDH-wildtype glioblastoma,GBM)的临床结局较差[3]。研究[4]表明,IDH 突变型和IDH 野生型神经胶质瘤的分子特征、表观遗传特征和RNA 谱也不同。因此,有必要研究IDH 野生型胶质瘤恶性进展的机制。肿瘤坏死因子α 诱导蛋白3 相互作用蛋白1(TNFα-induced prote in 3-interacting protein1,TNIP1)是一种细胞蛋白,它在癌症、自身免疫和慢性炎症中起着重要作用[5]。TNIP1诱导的核因子κB(Nuclear factor kappa B,NF-κB)活性在免疫疾病和炎症反应中起关键作用[6]。据报道,TNIP1 的遗传多态性与神经胶质瘤预后的风险升高相关;高水平的TNIP1 与胶质瘤细胞增殖和胶质瘤患者的不良预后呈正相关[7]。然而,TNIP1是否在IDH 野生型胶质瘤中发挥作用仍有待阐明。本研究系统地分析了TNIP1 在中国胶质瘤基因组图谱(Chinese Glioma Genome Atlas,CGGA)和癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据集中胶质瘤患者的表达及其预后价值,观察到TNIP1 表达与IDH 野生型胶质瘤的恶性程度之间的关系。然后进一步探讨了TNIP1 在IDH 野生型胶质瘤细胞的恶性表型中的作用及相关机制,旨在确定神经胶质瘤病理诊断和靶向治疗的新靶点。
1 材料与方法
1.1 材料
1.1.1 数据库 转录数据和临床信息从CGGA 官方网站(http://www.cgga.org.cn/)和TCGA 数据库(https://tcga-data.nci.nih.gov/tcga/tcgaDownload.jsp)下载。
1.1.2 细胞培养 人星形胶质细胞(HA;美国Scien Cell 公司)接种在星形胶质细胞培养基(美国Scien Cell 公司)中。人神经胶质瘤细胞系H4、LN229 和U87 获自中国科学院生物化学与细胞生物学研究所,并接种在含有10%胎牛血清(FBS;美国Gibco公司)和1%青霉素-链霉素(Gibco)的DMEM(Gibco)中。源自GBM 患者的细胞系N33 接种在含有10%FBS 和1%青霉素-链霉素的DMEM/F12(Gibco)中。H4、LN229、U87 和N33 均为野生型细胞系[3]。
1.1.3 动物来源 5 周龄雌性BALB/c 无胸腺裸鼠由北京维通利华实验动物技术有限公司提供[合格证编号:SCXK(京)2016-0006],置于温控室内、12 h/12 h 的光/暗循环环境下饲养。本研究经伦理委员会审查批准。
1.2 方法
1.2.1 细胞分组 将N33 细胞接种于6 孔板上,分为3 组:对照组、si-NC 组和si-TNIP1 组。48 h 后收集细胞和培养基进行进一步实验。si-NC 组和si-TNIP1 组分别将细胞转染scramble siRNA(si-NC)、TNIP1 siRNA(si-TNIP1),对照组加入空白培养基。转染后48 h 收集细胞进行后续分析。
1.2.2 GBM 细胞系中的基因调控 上海吉凯基因医学科技股份有限公司生产了含有特定基因载体或特异性小干扰RNA(siRNA)序列的慢病毒:scramble siRNA(si-NC)、TNIP1 siRNA(si-TNIP1)和TNF 受体相关因子6(TNF receptor associated factor 6,TRAF6)siRNA(si-TRAF6)。使用Lipofectamine 3000(美国Invitrogen 公司)将这些基因的含有特定基因载体或特异性siRNA 转染到GBM 细胞中。转染后48 h 通过蛋白质印迹测量转染效果。
1.2.3 细胞增殖分析 将1.5 × 103个细胞接种在96 孔培养皿中并培养6 d。在检测时间点弃去上清液,加入含有10% Cell Counting Kit-8 溶液(CCK-8,日本Dojindo Laboratories 公司)的培养基,然后在37 ℃下孵育1 h。通过Varioskan Flash(美国Thermo Fisher Scientific 公司)测量每个孔中450 nm 处的吸光度。
1.2.4 Transwell 迁移试验 采用Transwell 室(美国Corning 公司)评估细胞迁移。将在无血清DMEM 中的GBM 细胞(1 × 105)添加到上室,下室加入含10% FBS 的DMEM。在37 ℃下孵育6 h 后,去除Transwell 膜上表面的细胞,将膜用10%中性缓冲福尔马林溶液固定,并用0.01%结晶紫溶液(上海Beyotime 公司)染色,计数。
1.2.5 细胞划痕试验 N33细胞以3×105/孔接种于6 孔板,并在含有10% FBS 的DMEM/F12 中培养。培养24 h 后,将细胞用200 μL 塑料移液管尖端划伤并在不含FBS 的DMEM/F12 中培养48 h。使用显微镜评估细胞迁移率。
1.2.6 蛋白质印迹和免疫沉淀(IP)分析 使用放射免疫沉淀测定缓冲液(美国CST 公司)提取总蛋白质,并使用BCA 蛋白质测定试剂盒(美国Thermo Fisher Scientific 公司)进行定量。蛋白质用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯(PVDF)膜(美国Merck Millipore 公司)。将膜在5% 脱脂牛奶中封闭1 h,与靶向GAPDH(1∶2 000,美国CST 公司),TNIP1(美国Abcam 公司,1∶2 000 稀释)、TRAF6(Abcam,1∶2 000稀释)和Phospho-NF-κB p65(pp65,CST,1∶500 稀释)的一抗在4 ℃下孵育过夜,然后与HRP 偶联的二抗(1∶5 000,Abcam)在室温下孵育1 h。使用化学发光HRP 底物(美国Merck Millipore 公司)和带有Image LabTM软件的ChemiDocTMXRS+(美国Bio-Rad 公司)检测免疫反应条带。
对于IP 测定,将U87 细胞接种在6 孔板中孵育48 h。然后收集细胞,并用抗Myc、抗Flag 或抗HA 抗体(均购自美国Abcam 公司)免疫沉淀细胞裂解物。IP 复合物通过SDS-PAGE(6% ~10%)电泳分离,并用抗Myc、抗Flag 或抗HA 抗体进行免疫探测。对于泛素化测定,模拟载体、Flag-TRAF6和Myc-TNIP1 质粒(均购自美国Addgene 公司)分别转染到HA 标记Ub 的U87 细胞中。细胞裂解物用抗-Myc 或抗-Flag 抗体免疫沉淀,并用抗-Myc、抗-Flag 或抗-HA 抗体探测。
1.2.7 RNA 提取和定量PCR(qPCR)分析 使用TRIzol 试剂(美国Invitrogen 公司)分离总RNA,并使用nanodrop 2000 进行定量。总共1 000 ng RNA被逆转录为cDNA,并使用SYBRTMSelect Master Mix(美国Thermo 公司)在7500 快速实时荧光定量PCR系统(美国Applied Biosystems 公司)上进行实时定量分析。本研究中基因的引物序列见表1。

表1 基因的寡核苷酸引物序列Tab.1 Gene oligonucleotide primer sequences
1.2.8 原位异种移植模型 18只小鼠随机分为3组,每组6 只,分别为:U87 NC 组,U87 oe-TNIP1 组和U87 si-TNIP1 组。在立体定向仪引导下,分别将空载体、oe-TNIP1 过表达或si-TNIP1 敲低载体转染的U87 细胞(5 × 105)接种到三组裸鼠的右额叶结节中。接种位置是前囟门外侧2 mm 和后2 mm。在第10、20 和30 天通过BLI 方法监测肿瘤生长情况。小鼠腹膜内注射d-荧光素(美国Promega 公司)并用体内成像系统IVIS-Spectrum 小动物活体成像系统(美国PerkinElmer 公司)测量肿瘤体积。在肿瘤细胞接种后35 d 处死裸鼠,然后收获大脑并制备成福尔马林固定石蜡包埋样品,以进行免疫组织化学分析。在生存分析中,61 只小鼠分为3 组:U87 NC 组(n= 31),U87 oe-TNIP1 组(n= 21)和U87 si-TNIP1 组(n= 9)。按上述方法立体定向移植转染的U87 细胞后,连续对小鼠进行55 d 的生存考察,记录各组小鼠的死亡情况。
1.2.9 免疫组织化学(IHC)分析 将组织切片脱蜡并在Tris 抗原修复缓冲液中煮沸。然后,将切片与针对Ki67(CST,1:200 稀释),TNIP1(Abcam,1∶200 稀释),TRAF6(Abcam,1∶200 稀释)和NFκB p65(CST,1∶200 稀释)的一抗一起孵育。使用显微镜捕获免疫组织化学图像。
1.3 统计学方法 使用R v3.4.1(https://www.rproject.org/)、SPSS 22.0 进行统计分析。计量资料均表示为均值±标准差,两组均值比较使用t检验,多组之间的比较采用单因素方差分析,然后进行Tukey 或Dunnett多重比较检验。Kaplan-Meier 方法用于比较不同组患者的总体生存时间。P<0.05为差异有统计学意义。
2 结果
2.1 TNIP1 表达与IDH 野生型胶质瘤的关系 与GEPIA 网站(http://gepia.cancer-pku.cn/)中的非肿瘤脑组织相比,GBM 中TNIP1 的表达显著增加(P<0.05,图1A)。在CGGA 数据集中,与非肿瘤脑组织相比,IDH 野生型GBM 病例中TNIP1 的表达显著增加(P<0.05,图1B)。TNIP1 mRNA 表达随着CGGA(图1C)和TCGA(图1D)数据集中IDH 野生型神经胶质瘤组织学分级的增加而增加(P<0.05)。胶质母细胞瘤细胞系(LN229 和U87 细胞)和胶质母细胞瘤患者来源的N33 细胞中的TNIP1 蛋白表达水平均高于间变性星形细胞瘤H4 细胞(图1E)。此外,在CGGA(图1F)和TCGA(图1G)数据集中,具有较高TNIP1 表达患者的OS 比具有低TNIP1 表达的患者差(P<0.05)。然而,TNIP1 表达不能在CGGA 和TCGA 数据集中对IDH 突变神经胶质瘤患者的生存进行分层(图1H-K)。
2.2 TNIP1 表达的变化影响IDH-野生型胶质瘤细胞的增殖和迁移 首先成功用特定的siRNA 敲低了N33 细胞中的TNIP1 表达(图2A)。TNIP1 敲低显著减弱了N33 细胞的迁移(P<0.05,图2B)、增殖(P<0.05,图2C)和抑制细胞的迁移率(P<0.05,图2D)。
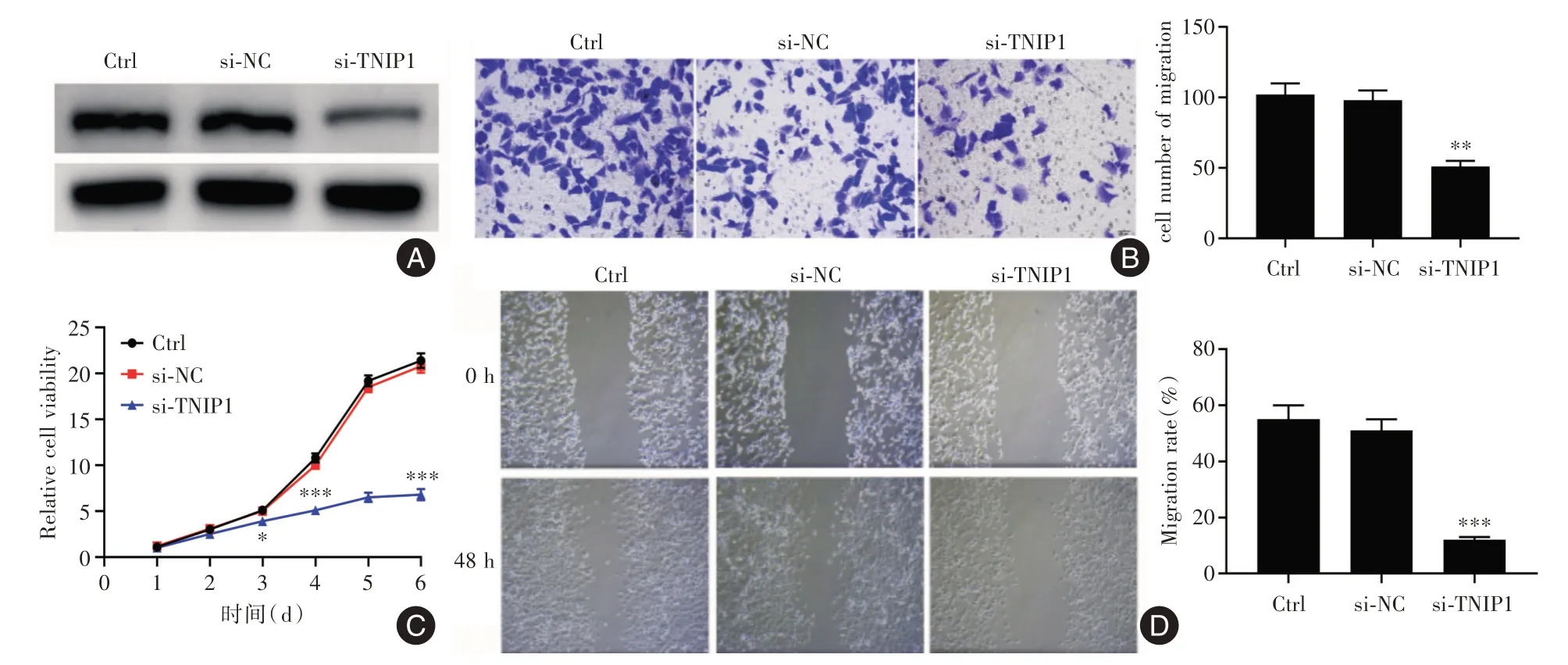
图2 TNIP1 可以促进胶质瘤细胞的恶性表型Fig.2 TNIP1 can promote the malignant phenotype of glioma cells
2.3 TNIP1 诱导TRAF6 蛋白的去泛素化以激活NF-κB Myc-TNIP1与Flag-TRAF6相互作用(图3A,泳道4)。在不存在Myc-TNIP1 的情况下可以看到TRAF6 的泛素化(图3B,泳道2),而在存在Myc-TNIP1 的情况下以剂量依赖性方式观察到TRAF6的显著去泛素化(图3B,泳道3-5)。
在CGGA 和TCGA 数据集中,TNIP1 表达与TRAF6 表达显著正相关(图3C-D)。TNIP1 敲低还可以显著调LN299 和N33 细胞中TRAF6 的表达(P<0.05,图3E-F)。
在U87 细胞中,观察到磷酸化的NF-κB(pp65)随着TRAF6 敲低而减少(图3G)。此外,磷酸化的NF-κB(pp65)在TNIP1 敲低的U87 细胞中减少,但在TNIP1 过表达的U87 细胞中增加(图3H)。
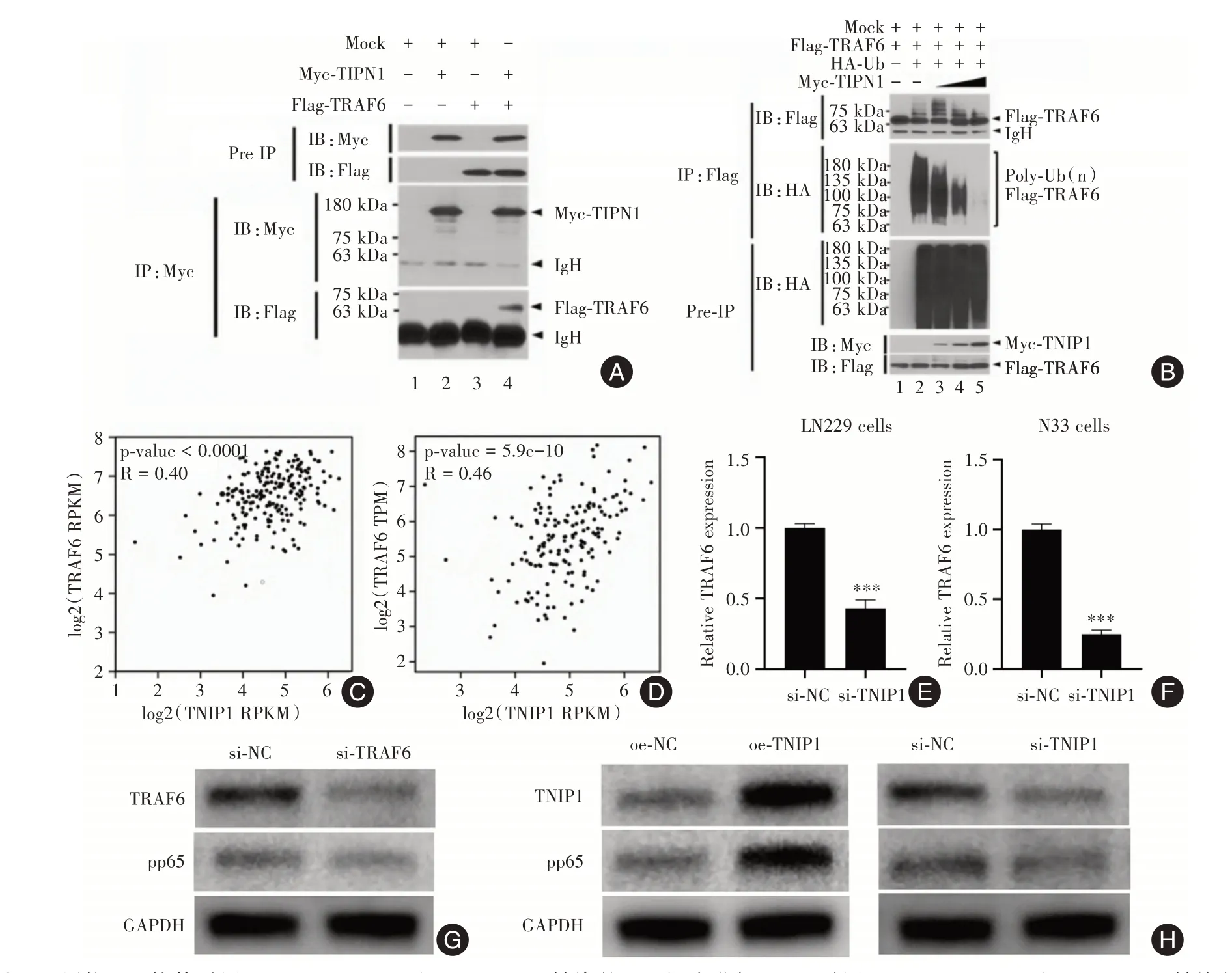
图3 TNIP1 诱导TRAF6 蛋白的去泛素化以激活NF-κBFig.3 TNIP1 induces deubiquitination of TRAF6 protein to activate NF-κB
2.4 TNIP1促进体内肿瘤生长、存活率低和NF-κB激活 与空载体的异种移植物相比,oe-TNIP1 的异种移植物显示出加速的肿瘤进展,而si-TNIP1 的异种移植物显示出减慢的肿瘤进展(图4A、B)。oe-TNIP1 异种移植物的小鼠的存活结果较差,而si-TNIP1 的异种移植物小鼠则表现出更长的生存期(P<0.05,图4C)。此外,Ki-67 阳性细胞以及TNIP1、TRAF6、NF-κB(p65)水平在oe-TNIP1 的异种移植物中增加,而在si-TNIP1 的异种移植物中减少(图4D)。
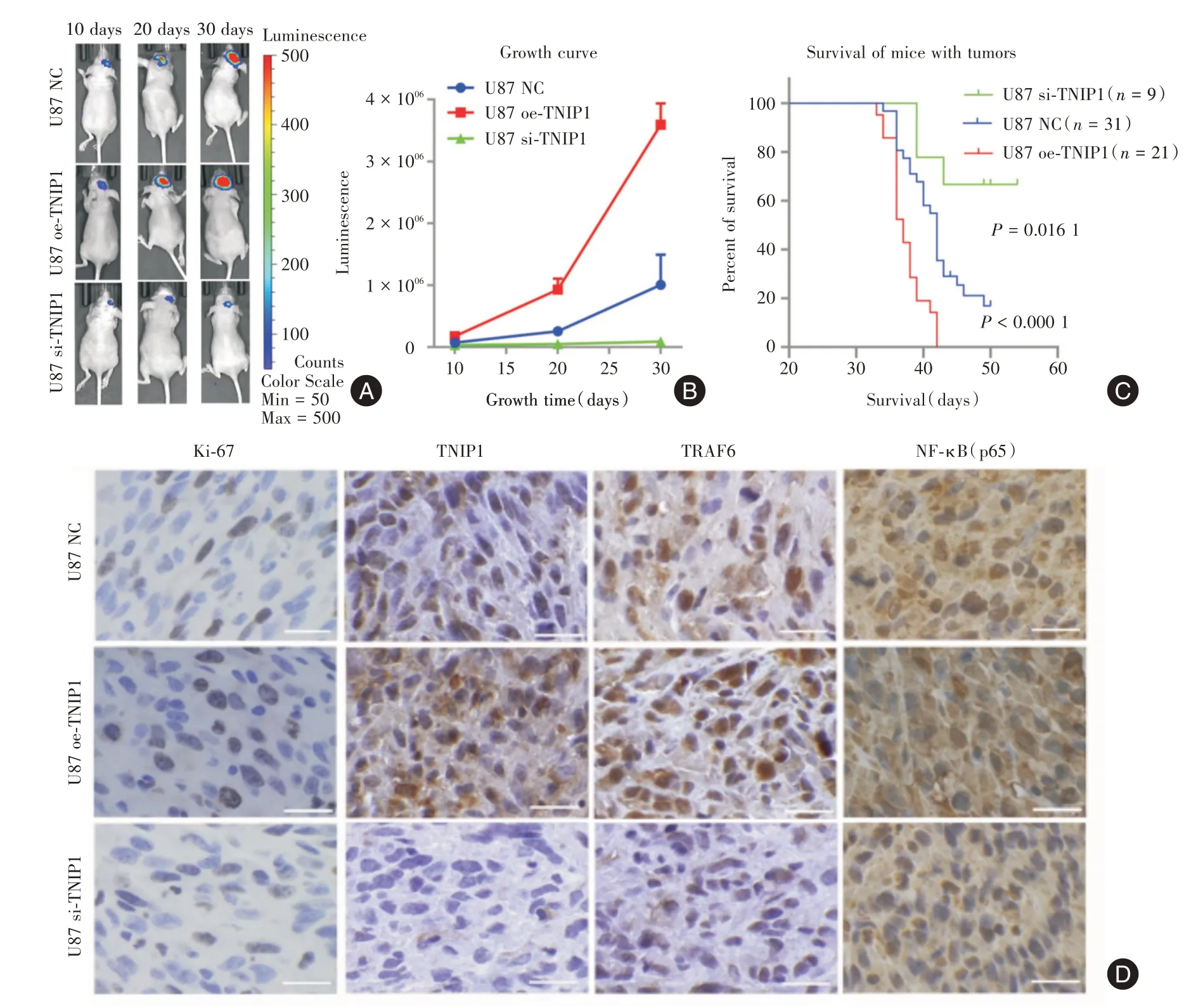
图4 TNIP1 在原位异种移植模型中促进肿瘤生长并导致更差的预后Fig.4 TNIP1 promotes tumor growth and leads to worse prognosis in an orthotopic xenograft model
3 讨论
研究[8-9]表明,TNIP1 通过多种机制在维持癌细胞的治疗抗性方面发挥着关键作用。然而,TNIP1 在胶质瘤恶性进展中的作用在很大程度上仍然难以捉摸。本研究中,TNIP1 表达随着IDH 野生型神经胶质瘤恶性程度的增加而增加,而不是IDH 突变型神经胶质瘤。较高的TNIP1 表达也与IDH 野生型神经胶质瘤患者较差的存活率相关。此外,本研究证明TNIP1 可以在IDH 野生型神经胶质瘤细胞系中增强细胞增殖和迁移。总之,这些发现表明TNIP1 可能在IDH 突变型和IDH 野生型胶质瘤中发挥不同的作用,并且TNIP1 可以促进IDH 野生型胶质瘤的恶性进展。
近几年研究[10-12]表明,泛素化和去泛素化通过调节癌症代谢在癌症发展中发挥着关键作用。CAI 等[13]报道,TNIP1 需要泛素结合来限制细胞凋亡。因此,TNIP1 的去泛素化与泛素化蛋白质的细胞功能密切相关[14-15]。本研究发现TNIP1 诱导TRAF6 蛋白的去泛素化以激活NF-κB,并随后在体外和体内促进IDH 野生型胶质瘤进展。相关研究显示,TRAF6 能同时诱导TAK1 结合蛋白2 和TGF-β 激活激酶1 的K63 连接泛素化以激活NFκB,从而促进癌症进展[16]。据报道,TRAF6 表达在预后较差的神经胶质瘤中增加,升高的TRAF6 促进神经胶质瘤细胞增殖和迁移[7]。此外,本研究发现TNIP1 表达与TRAF6 表达显著正相关,并且TNIP1 可以通过调节TRAF6 来调节NF-κB。这些结果表明,TNIP1 通过调节TRAF6 蛋白的去泛素化来促进胶质瘤的进展。
NF-κB 是参与促进胶质瘤恶性进展的核心因子[17-18]。在胶质瘤细胞的间充质分化过程中,NF-κB可以被内在和外在信号激活[19]。激活的NF-κB 上调CD44、波形蛋白和N-钙粘蛋白的表达,并介导STAT3、CEBPB 和TAZ 的激活[20]。此外,NF-κB 可以通过改变分泌细胞因子的类型和ECM 蛋白和酶的表达来调节肿瘤微环境,以促进神经胶质瘤的侵袭、血管生成和治疗抵抗[21]。研究[22]表明在用替莫唑胺治疗神经胶质瘤期间,TRAF6 的上调需要激活NF-κB。本研究证明了抑制TRAF6可以抑制NF-κB活化。据报道NF-κB 和TRAF6 都与神经胶质瘤对替莫唑胺的抗性有关[23-25],推测NF-κB 和TRAF6 之间存在的调节网络与TNIP1 上行调制有关。然而,详细的调控机制仍有待在未来的研究中阐明。
总之,本研究结果表明TNIP1 表达随着IDH 野生型神经胶质瘤恶性程度的增加而增加。TNIP1还可以在体外和体内模型中促进胶质瘤的恶性进展。从机制上讲,TNIP1 可以诱导TRAF6 蛋白的去泛素化以激活NF-κB。这些发现将有助于神经胶质瘤患者的病理诊断和TNIP1 靶向治疗。然而,NF-κB 和TRAF6 之间存在的调节网络与TNIP1 调制之间的关联仍有待进一步研究。
