多囊卵巢综合征表观遗传学、代谢组学、肠道菌群新机制前沿展望
2022-10-19李荔周嘉禾李末娟钟明琳张小伟许秋仪梁莲云
李荔 周嘉禾 李末娟 钟明琳 张小伟 许秋仪 梁莲云
1广东省妇幼保健院妇女儿童健康研究所(广州 511442);2广州医科大学(广州 510182);3华南理工大学附属第六医院(佛山市南海区人民医院)妇产科(广东佛山 528200);4东莞市妇幼保健院妇产科(广东东莞 523125)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄女性最常见的生殖内分泌疾病,也是无排卵性不孕的最常见原因。PCOS 患病率约5% ~15%,我国是全球PCOS 患病率增长最快的国家之一,2017年中国PCOS 发病率比2007年增长3.68%[1]。PCOS 不仅影响生育,导致不孕、流产及妊娠期高血压、糖尿病,早产等不良妊娠结局,还常伴随高脂血症、腹型肥胖、糖代谢异常、心血管疾病等多种代谢相关疾病[2-3]。2015年一项回顾性队列研究纳入2 566 例PCOS 住院女性及25 660 例年龄匹配的非PCOS 女性,发现PCOS 患者不孕及不良妊娠结局发生风险显著高于非PCOS 人群[4]。2017年一项meta 分析纳入PCOS 孕妇13 378 例,非PCOS 孕妇49 395 例,发现PCOS 患者常伴有妊娠糖尿病及高血压、剖宫产、早产及巨大儿等各种妊娠并发症[5]。此外,多项研究发现,较非PCOS人群,PCOS 患者罹患糖尿病、高血压、非酒精性脂肪肝、心血管疾病等代谢疾病发生率显著升高[6-7]。
PCOS 是影响妇女生殖健康及生活质量的常见疾病,由于其发病机制尚未明确,病因复杂,与遗传及后天环境均有关系,是生殖内分泌领域最为复杂的研究热点之一;同时由于疾病的高度异质性,缺乏预后标志物,早期诊断困难,导致20%患者延迟诊断或误诊,患者不孕不育、反复流产,远期并发症升高。近年来表观遗传学、代谢组学、肠道微生物等生物技术的进展,为PCOS 患者的诊疗带来了新的曙光。本文就PCOS 的遗传学机制、代谢组学、肠道菌群的研究进展进行前沿述评,从新的视角再认识PCOS 致病机制,以期深入理解疾病发病机制,为临床治疗提供新方向。
1 PCOS 的表观遗传学机制及治疗新方向
PCOS 是一种复杂的多基因功能障碍,遗传和表观遗传调控在PCOS 表型形成中发挥重要的作用。遗传因素被认为是PCOS 发病的主要原因,中国及欧洲人群的多个全基因组关联分析证实PCOS遗传位点涉及雄激素合成、促性腺激素、卵巢局部功能、代谢等[8-10]。PCOS的发病常具有家族聚集性,且认为与常染色体有关,在一级亲属中发病率更高。多项家族性和双胞胎研究证实了遗传因素在PCOS 的发病中有着举足轻重的作用,其遗传率高达70%[11-12]。PCOS 患者的女儿罹患该病几率升高5 倍[12],但胎儿期宫内高雄激素、高抗苗勒管激素(AMH)环境也是导致子代罹患PCOS 的重要原因,这已经在人类及大鼠模型上被证实[13-16]。
环境改变可能是PCOS 的诱因之一,但是先前的研究极少关注PCOS 的表观遗传学变化。直至2018年,表观遗传与PCOS 的发生发展的研究才逐渐开始受到关注[17-19]。2021年2月,法国里尔大学医学院的MIMOUNI 团队在《Cell Metabolism》发表的一项创新性研究[20],证明PCOS 神经内分泌和代谢功能障碍在PAMH 小鼠(概括了PCOS 高雄激素、高AMH、排卵障碍、不孕、代谢异常等生理特征的模型小鼠)中传播至少三代。该项研究阐明了PCOS 可能的表观遗传学机制:环境因素(宫内高雄激素、高AMH)通过诱导表观遗传变化(如DNA 甲基化)发挥其作用,这些修饰会导致PCOS 子代疾病易感性增加,造成子代神经内分泌及代谢障碍。同时,研究人员用甲基供体S-腺苷甲硫氨酸处理PCOS 小鼠模型后,发现DNA 甲基化程度升高可以缓解PCOS 小鼠的转录组学、神经内分泌和代谢缺陷。表明用甲基化药物治疗PAMH F3 雌性后代可以挽救PCOS 的神经内分泌和代谢改变,从而提出了PCOS 表观遗传治疗的新方向(图1)。
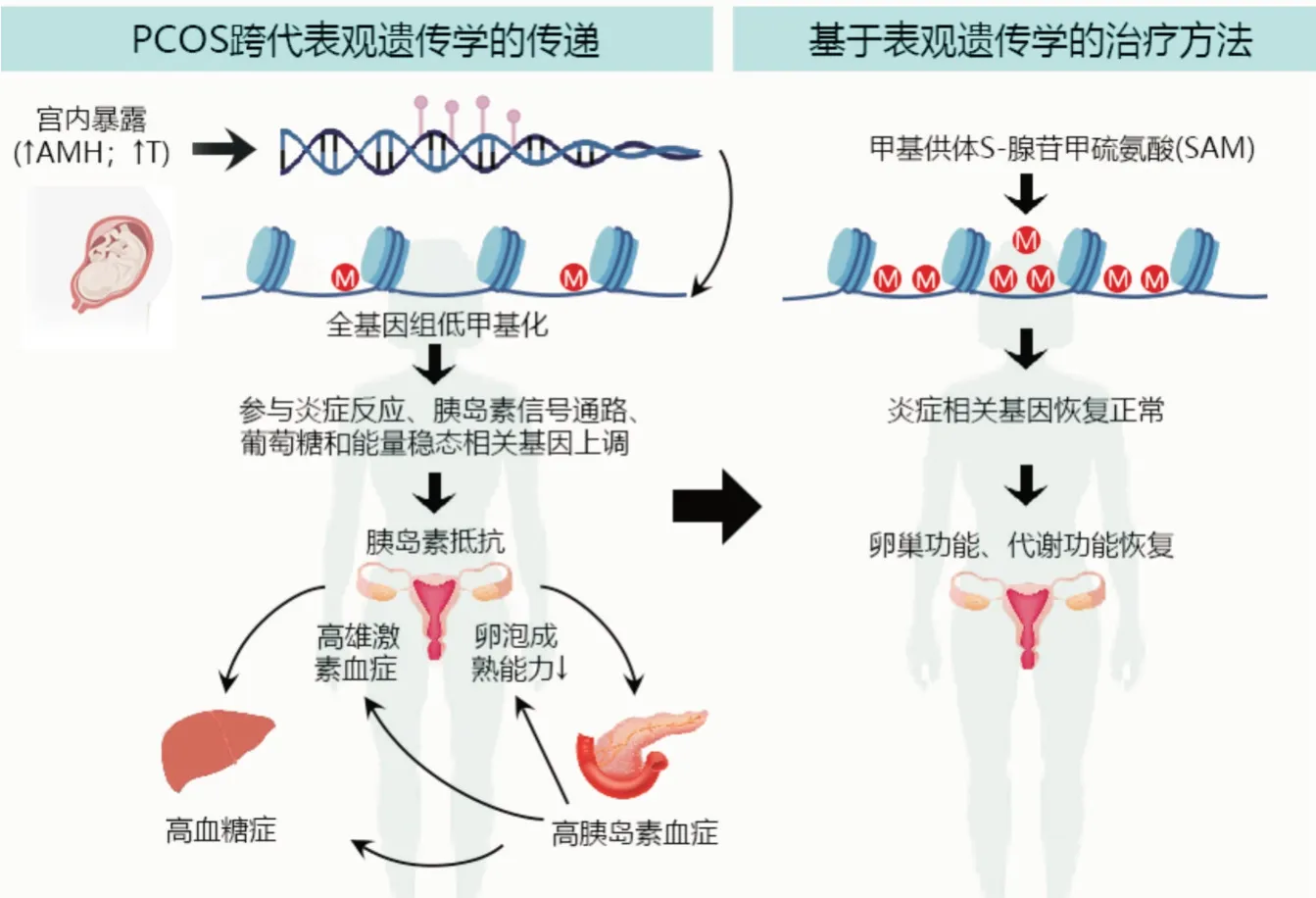
图1 PCOS 表观遗传学机制及其治疗新方向Fig.1 New directions in mechanism and treatment of epigenetics in PCOS
该团队研究人员首先建立宫内高AMH 小鼠模型(PAMH),并验证了PCOS的强遗传性。与对照组相比,PAMH 小鼠后代表现出更多的PCOS 症状,交配后产仔的数量也减少;出生后6 个月,PAMH动物模型的代谢发生了改变,包括体质量和脂肪量更高,PAMH F1 后代的葡萄糖耐量和胰岛素敏感性较低等,呈现出跨代遗传的现象。随后,研究人员对第三代PCOS 样小鼠及对照组小鼠的卵巢组织进行甲基化DNA 免疫共沉淀测序(MeDIP-seq),分析结果发现:DNA 低甲基化可以调节与PCOS关键基因的表达。研究者进一步证实了甲基供体S-腺苷甲硫氨酸(SAM)的治疗潜力,SAM 是一种重要的天然存在的生物分子,广泛存在于所有活细胞中,并作为所有转甲基化反应的主要甲基供体,用于促进低甲基化组织的甲基化。研究人员用SAM 处理PCOS 小鼠模型后,发现DNA 甲基化程度升高可以缓解PCOS 小鼠的转录组学、神经内分泌和代谢缺陷。最后,研究人员通过临床样本分析,发现PCOS 患者的血液样本中同样存在差异甲基化,从PAMH 小鼠全基因组甲基化谱筛选出的六个基因中,可以鉴定出五个甲基化基因,分别为:ROBO-1、CDKN1A、HDC、IGFBPL1 和IRS4,均定位于这些基因的启动子区域。该研究发现了DNA 甲基化水平降低是PCOS 重要的表观跨代异常特征,首次提出SAM 可逆转PCOS 的神经内分泌及代谢障碍,为PCOS 的治疗提供了新的基于表观遗传的PCOS 治疗策略。2021年,ABBOTT等[21]同期在《Cell Metabolism》撰文,评价“该项研究是基于PCOS 表观遗传领域方面的全新的、具有深刻洞察力的研究”,为PCOS 的治疗指出了新的方向。
同时,该研究仍然存在局限性,例如:尚未进行PCOS 动物模型的低甲基化组织的全基因组DNA 甲基化分析、RNA 测序、转录后组蛋白修饰的研究;尚未证实SAM 是否能逆转PAMH 小鼠模型的生殖障碍;尚未进行哺乳类动物实验(如猕猴)等等。未来可在此基础上,进一步进行全基因组DNA 甲基化分析、组蛋白乙酰化等研究,并与PCOS 患者的临床表型关联分析,同时,还需要进一步分析对PCOS 促进甲基化的治疗对患者的远期继发副反应。
近年来,大量研究表明,非编码RNA(non-coding RNA,ncRNAs)参与了PCOS 的发生发展。非PCOS 人 群中 比 较,PCOS 患 者ncRNA 的表达在血清、颗粒细胞、滤泡液等组织中均存在显著差异,有可能成为诊断性生物标志物和治疗靶点。其中,miRNA、LncRNA、siRNA 是三种常见的ncRNA。研究表明,在颗粒细胞、卵泡液中,PCOS 组的miR-93、miR-21 表达显著性增高[22],差异表达的miRNAs 参与多种信号通路,包括氨基酸代谢、激素调节、细胞分化等[23]。作为ncRNA 家族的重要一员,lncRNA 在细胞增殖、分化、凋亡和肿瘤发生中发挥重要作用。研究显示,PCOS 患者外周血白细胞中lncRNA H19 的表达水平明显增高。一项动物实验中显示,PCOS 大鼠模型子宫组织的lncRNA CD36-005 明显上调,表明lncRNA 的表达水平可能是PCOS 发生的一个重要诱因[24-25]。而关于siRNA的研究,更多的关注点在于它和miRNA 结合来发挥基因沉默的功能,已有研究证实了siRNA 介导的基因沉默和PCOS 存在密切的关系,可导致卵泡生长减速,进而造成不孕[26]。
2 PCOS 代谢组学机制研究
PCOS 不仅影响生殖、导致不孕,还与机体代谢密切联系,严重影响患者的生命质量、生育及远期健康。2007-2011年间北京大学第三医院牵头的“十二五”国家科技支撑计划,通过对来自中国10 个省市的15 924 例19~45 岁的育龄妇女,进行大规模的分层随机抽样调查,明确我国育龄女性PCOS 患者有更高的代谢综合征的发病情况[27]。PCOS 女性不仅存在严重的内分泌激素紊乱,还合并多种代谢功能异常,包括胰岛素抵抗、高胰岛素血症、过度肥胖等,导致患者最终发展为2 型糖尿病、非酒精性脂肪肝、高脂血症、高血压、心脑血管疾病等,并成为患者的主要死因[28-29]。由于机体代谢物的变化是对疾病、环境以及遗传变异等压力因素影响的最终应答,利用代谢组学技术进行PCOS 病因学研究,是对于PCOS 这类遗传和环境因素共同发挥作用的重要研究方法,质谱技术的发展如:液相色谱-串联质谱(liquid chromatographytandem mass spectrometric,LC-MS),气相色谱-串联质谱(gas chromatography-tandem mass spectrometric,GC-MS),也为代谢产物的分析提供了有利的工具。这些前沿技术手段可发现新的、无创的代谢诊断标记物,并从代谢角度进一步认识PCOS 的发病机制。
PCOS 包括许多代谢途径的异常,包括类固醇激素、氨基酸、碳水化合物、脂质、嘌呤和柠檬酸循环的代谢紊乱[30]。其中,PCOS 患者循环氧化应激(OS)的循环生物标志物升高是独立于超重的另一异常要素,氧化应激被认为是PCOS 发病的因素之一,且与其临床症状的发生及进展有密切关系。循环中异常增高的OS 产物还会导致该类患者发生心脑血管疾病、肝病、肿瘤的风险上升,甚至影响子代的健康[31]。氧化应激通过释放TNF-α 等炎症因子,促进胰岛素抵抗的产生,同时,氧化应激和高胰岛素血症又增加了TNF-α 和白细胞介素合成,下调翻译后修饰和PI3k/AKT 通路,导致内皮功能障碍,从而诱发PCOS 远期心血管疾病[32]。2021年首都医科大学附属北京妇产医院研究发现,在DHEA 诱导的PCOS 大鼠模型血清中过氧化物增加,抗氧化能力下降,特别是卵巢组织中超氧化物歧化酶(SOD)蛋白表达量下降。由此,研究从氧化应激角度出发,发现Tempol 可能通过抑制小肠组织的氧化应激,恢复肠道微生态平衡,调节肠道菌群和宿主代谢物间相互作用,从而发挥PCOS 治疗作用[33]。同时,通过对PCOS 患者不同组织样本如血清、尿液、卵泡液的代谢组学技术也检测出许多与氧化应激相关的差异指标。卵泡液是卵母细胞赖以生存的微环境,其代谢物组成氨基酸、脂肪酸、有机酸等间接反映卵母细胞代谢水平,对卵母细胞的成熟发挥着重要作用[34]。在一项对PCOS患者卵泡液的研究发现:7β-羟基胆固醇是一种脂质代谢物,与PCOS 诊断高度相关,可能是PCOS 的潜在生物标志物,可以诱导氧化应激并干扰脂肪酸的代谢,通过激发卵泡液中7β-羟基胆固醇氧化应激干扰PCOS 中卵母细胞的生长[35]。有研究对PCOS 患者的血清进行代谢组学分析,发现PCOS患者的甘油磷脂代谢、脂肪酸降解/生物合成、醚脂质代谢等脂质代谢紊乱,并鉴定出多种代谢产物,如3-(4-羟基苯基)丙酸,以及多种二肽代谢物异亮氨酸-丙氨酸、异亮氨酸-缬氨酸、甘氨酸-缬氨酸为PCOS 诊断的潜在生物标志物[36]。2021年的一项研究采用一种非侵入性方法,对PCOS 患者的尿液进行代谢组学技术分析,研究显示3-苯基丙酸和丙酮酸可作为检测PCOS 伴高胰岛素血症的代谢产物[37]。然而相反的是,丙酮酸既是糖酵解的终末产物,又是三羧酸循环(tricarboxylic acid cycle,TCA)的起始底物,还具备清除细胞内活化氧自由基(reactive oxygen species,ROS)H2O2和OH-的作用[38]。
此外,多项研究显示PCOS 患者卵巢组织的、内脏脂肪和外周血T 淋巴细胞中氧化应激相关蛋白升高[39-40]。氧化应激可能是诱导PCOS 的重要因素之一,利用抗氧化剂降低氧化应激、维持机体氧化还原稳态可能是PCOS 治疗的新手段。PCOS不同组织样本的代谢组学研究提供了丰富的PCOS代谢产物谱,但目前研究仍存在局限性,例如不同人群、不同年龄、月经周期不同阶段,PCOS 患者代谢产物存在差异,需要进行大样本、多中心研究,深入挖潜代谢产物与PCOS 病理生理机制。
3 PCOS 与肠道微生态失衡
许多PCOS 患者可能都会面临肥胖的问题,这与PCOS 患者肠道微生态失衡有关。肠道微生物被称为独立的“微生物器官”,它依靠肠道生活,帮助宿主完成多种生理生化功能,与宿主形成相互依赖且相互制约的微生态系统,被称为人体的“第二基因组”。肠道菌群的紊乱通过影响炎症水平以及调控能量代谢水平影响疾病的发生发展,并可以分泌、产生多种代谢产物作用于远端器官。2019年乔杰等[41]通过宏基因组学的方法,发现PCOS 患者肠道菌群特点为普通拟杆菌丰度显著升高。肠道代谢产物胆汁酸甘氨脱氧胆酸(GDCA)与牛磺去氧胆酸(TUDCA)的水平降低,并与普通拟杆菌的丰度呈负相关。将PCOS 患者的肠道菌群移植给模型小鼠或喂养普通拟杆菌后,小鼠呈现出PCOS 的表型,同时出现肠道代谢产物GDCA与TUDCA 水平降低,且伴有肠道免疫因子IL-22的水平下降。进一步研究发现:补充IL-22 或者胆汁酸可改善PCOS 样表型,其机制在于胆汁酸—IL-22 轴可促进白色脂肪组织棕色化、抑制卵巢局部的炎症反应及提高能量代谢进而改善PCOS 样表型。2021年YANG 等[42]发现PCOS 患者及来曲唑诱导的PCOS 小鼠模型中拟杆菌显著富集,通过抗生素清除菌群可以改善PCOS 表型及胰岛素抵抗,并增加回肠法尼酯X 受体(FXR)水平和血清成纤维生长因子15(FGF15)的水平。PCOS 粪便移植小鼠在10 周时出现胰岛素抵抗,但未出现类似PCOS 的表型。同时,用鹅去氧胆酸(FXR 的激活剂)治疗PCOS 小鼠可改善其葡萄糖代谢。该研究认为:拟杆菌属是PCOS 的关键微生物标志物,PCOS 的生物失调与胰岛素抵抗有关,而FXR 的激活可能对PCOS 产生有益的影响。
PCOS 相关临床表现与肠道菌群也存在相关性。动物实验发现肠道菌群可以影响血液中睾酮含量,通过移植“有益”菌群后,类似PCOS 表型得到改善[41-43]。非酒精性脂肪肝、代谢综合征在PCOS 患者中发病率较高。近年来肠道菌群被认为是诱发代谢性疾病的重要因素。研究发现:肥胖型PCOS 女孩的肠道菌群多样性减少,血清睾酮水平升高,这表明肠道菌群的变化可能是多囊卵巢综合征的早期表现[44]。研究者认为目前尚不清楚血清睾酮水平与肠道菌群之间是何种关系。近年研究表明肥胖与肠道菌群密切相关。基于此,或可以通过改变肠道菌群来预防和控制肥胖,改善代谢,提高患者生育能力[43]。WU 等[45]中发现肠缺氧诱导因子2α(HIF-2α)的异常活化,在食源性肥胖和相关脂肪肝病的发生发展中有重要作用,通过进一步研究,将肠HIF-2α 基因敲除后,肠道内的乳酸水平降低,肠道细菌失去平衡,进而通过改变胆汁酸谱来促进白色脂肪组织生热,改善宿主代谢。该研究揭示了宿主肠HIF-2α 与肠道菌群互作调节肥胖的新机制。在糖尿病和肥胖小鼠饮食模型中,乳双歧杆菌B420 菌株被证明有助于改善胰岛素抵抗,同时可降低脂肪含量[46-47]。已有临床研究发现使用乳酸双歧杆菌可改善PCOS 患者性激素水平[48]。未来益生菌或许会成为干预PCOS 肥胖的重要手段。
传统的相关性研究中多从宏观的角度研究肠道菌群与疾病的关系。近年的一些关于肠道菌群的研究中,通过鉴定出差异菌株,在特定菌株的层面进行精细化研究,这一类研究方法值得关注[41-42,49]。
4 展望
多囊卵巢综合征是与遗传、神经内分泌、代谢、环境、生活习惯等因素均有关系的疾病,是一种慢性疾病,发病机制仍不明确。随着下一代测序技术及表观遗传修饰、代谢组学相关研究的不断发展,对PCOS 的病理机制的理解越来越深入,表观遗传学、代谢组学、肠道微生态与PCOS 的相关性也逐渐被揭示,这些为PCOS 的研究提供了新的思路及治疗策略。基于表观遗传修饰的小分子调节剂、基于代谢组学的抗氧化剂、基于肠道菌群的菌株移植都将作为PCOS 药物研发的新靶标,不断开发并应用于临床实践,这也是PCOS 未来值得去关注与探索的方向。
