miR-320通过抑制TLR4/NF-κB信号通路减轻大鼠烧伤后肠道黏膜损伤
2022-10-19温海玲杨景哲孟祥熙张祥云
温海玲 杨景哲 孟祥熙 张祥云
1承德医学院附属医院南院区烧伤整形科(河北承德 067000);2河北省军区承德离职干部休养所(河北承德 067000)
烧伤后肠道损伤引起的生理屏障损伤是导致患者死亡的重要因素之一[1]。严重烧伤,肠道微血管通透性增加,肠细胞坏死、细胞凋亡和肠黏膜屏障功能受损,导致肠道细菌和毒素移位,诱发全身炎症反应综合征和多器官功能障碍综合征[2]。最近的研究表明,肠道炎症是烧伤后肠道屏障破坏的主要原因[3]。然而,肠道微生态是一个与宿主共生的复杂生态网络。肠道微生态功能障碍介导的肠道屏障破坏的具体机制涉及多种因素。Toll 样受体4(Toll-like receptor 4,TLR4)是哺乳动物模式识别受体家族的成员,被认为是将细胞外抗原识别信息传递给细胞并引发炎症反应的关键跨膜蛋白[4]。研究表明[5],TLR4 在烧伤期间的炎症启动和器官损伤中起着至关重要的作用。通过髓系分化初级反应基因88(myeloid differentiation primary response gene 88,MyD88)依赖性通路,TLR4 可以介导核因子(NF)-κB的活化,进而诱导包括肿瘤坏死因子(TNF)-α 和白细胞介素(IL)-6 在内的炎性细胞因子的表达和释放,导致炎症正反馈的恶性循环[5]。但是TLR4 只能通过与其特异性配体结合才能介导下游信号转导[6]。MicroRNA(miRNA)是短的非编码RNA 序列,在各种生理和病理过程中发挥关键作用[7]。烧伤、疾病和其他一些因素可能会改变miRNA 的表达,从而对肠道稳态产生负面影响[8]。有证据表明miR-320 参与了多种病理过程,包括调节各种细胞和器官的炎症过程,并且与细胞增殖、凋亡有关[9]。此外,最新证据表明,上调miR-320 表达减少烧伤后氧化应激和肠细胞凋亡[10]。表明miR-320 可能在烧伤诱导的肠道损伤中具有保护作用,但是具体作用机制仍有待进一步研究。因此,本研究通过建立大鼠烧伤模型,探讨miR-320 的肠道保护机制是否与TLR4/NF-κB 信号通路有关。
1 材料与方法
1.1 实验动物 健康成年雄性Sprague-Dawley 大鼠(240 ~260 g)购自北京华阜康生物科技股份有限公司(许可证号SCXK(京)2019-0008)。大鼠被关在笼子里,在特定的无病原体条件下,允许随意获取食物和水,并保持12 h 的暗/光周期(室温20~24 ℃,相对湿度40%~70%)。这些动物是分开饲养的,随机在笼子里饲养4 ~6 只动物。本研究经承德医学院附属医院伦理委员会批准同意。
1.2 烧伤模型建立和分组处理 在烧伤模型建立前24 h,将80 g/L 硫化钠应用于大鼠脱毛背表面。实验前12 h 禁食物和水。通过腹腔注射戊巴比妥钠(30 mg/kg)麻醉动物。将大鼠放置在预制模板的矩形开口,露出裸露皮肤,同时保护剩余皮肤,根据Walker-Mason 烧伤模型[11],将大鼠裸露的皮肤沉浸在沸水中(100 ℃水浴,背部15 s)造成20%TBSAⅢ°烫伤(下文简称烧伤),烧伤后大鼠立即干燥。假手术组采用温水(37 ℃水浴,背部15 s)行背部浸泡。SD 大鼠随机分为4组(n=12):假手术(Sham)组、假手术+miR-320 组、烧伤(Scald)组和烧伤+miR-320组。烧伤组和烧伤+miR-320 组建立烧伤模型,并且烧伤+miR-320 组在烧伤模型建立前1 周通过尾静脉注射腺相关病毒(AAV)-miR-320(山东维真生物科技有限公司),连续3 d,每天注射5 μL。此外,假手术+miR-320 组在相同时间注射AAV-miR-320。各组于烧伤后24 h 随机处死6 只动物。麻醉动物后,沿着腹部中线切开腹壁,暴露并分离腹主动脉,并进行腹主动脉穿刺。抽取10 mL 动脉血,将动物处死。切除回肠末端组织,用生理盐水冲洗并分成两部分。其中一部分在液氮中快速冷冻,然后转移到冰箱中-80 ℃保存。另一部分储存在4%多聚甲醛中。各组其余6只小鼠用于体内FITC-葡聚糖测定。
1.3 组织学分析 回肠末端组织在4%多聚甲醛中浸泡一夜,转移到pH 7.4 的磷酸盐缓冲盐水(PBS)中,并以4 μm 的厚度切片。随后,使用苏木精和伊红(H&E)对切片进行染色,并使用光学显微镜进行观察。
1.4 酶联免疫吸附试验(ELISA) 将获取血样在4 ℃下以3 000×g离心15 min。收集从样品中分离的血清,并使用ELISA试剂盒(上海酶联生物科技有限公司)检测大鼠血清中TNF-α、IL-6 和DAO的浓度。
1.5 体内FITC-葡聚糖测定 参照文献方法[12]测定FITC-葡聚糖,用于评估肠道通透性。大鼠禁食3 h,然后以40 mg/100 g 的剂量灌胃FITC-葡聚糖溶液。4 h 后,通过腹主动脉穿刺采集血样,并在4 ℃下以3 000 ×g离心10 min 分离血清。使用荧光酶标仪测量FD-40 的血清吸光度,激发波长为488 nm,发射波长为525 nm。
1.6 RNA 提取和RT-qPCR 分析 使用总RNA 提取试剂盒(北京Solarbio 公司)从肠组织中提取总RNA。然后使用iScript cDNA 合成试剂盒(美国Bio-Rad 公司)对RNA 样本进行反转录,并在CFX96实时系统(Bio-Rad)上使用SYBR Green Supermix(Bio-Rad)进行定量逆转录聚合酶链反应(RTqPCR)扩增。miR-320 的定量使用针对miRNA 设计的Bulge-loop miRNA RT-qPCR 引物(广州RiboBio公司)进行。U6 用于使miR-320 水平正常化。所使用的引物序列如下:miR-320 正向:5′-AAAAGCTGGGTTGAGAGGG-3′,反向:5′-TGCGTGTCGTGGAGTC-3′;U6 正向:5′-GAAGCGCGGCCACGAG-3′,反向:5′-AGTGCAGGGTCCGAGGTATT-3′。
1.7 细胞培养和处理 人结肠上皮细胞株NCM460购自武汉普诺赛生命科技有限公司。细胞接种在含有10%胎牛血清(FBS)(美国Invitrogen 公司)、100 U/mL 青霉素和100 mg/mL 链霉素的RPMI 1640培养基中。当细胞达到70% ~80%汇合时,将细胞分为:对照组(Con)、Con+miR-320 组、LPS 组和LPS+miR-320 组。miR-320 模拟物(miR-320)和对照模拟物(miR-NC)均购自广州Ribo-Bio 公司。使用Lipofectamine 3000(美国Invitrogen 公司)将miRNC 转染至Con 组和Con+miR-320 组细胞,将miR-320 转染至LPS 组和LPS+miR-320 组细胞。48 h后收获转染细胞,LPS 组和LPS+miR-320 组加入50 μg/mL LPS(美国Sigma 公司)处理24 h。Con 组和Con+miR-320 组使用载体处理24 h。
1.8 蛋白质印迹分析 使用RIPA 裂解缓冲液(上海Beyotime 公司)在冰上从回肠组织或细胞中分离总蛋白。收集上清液,并在4 ℃下以12 000 r/min离心10 min后,使用BCA分析试剂盒(上海Beyotime公司)检测蛋白质浓度。蛋白质通过10% SDSPAGE分离,然后转移到PVDF膜上。在室温下用5%脱脂奶粉封闭1 h 后,将膜用PBS 洗涤两次,随后与针对ZO-1(1∶500;美国Invitrogen 公司),Claudin 1(1∶500;英国Abcam 公司),TLR4、MyD88、NF-κB p-p65、NF-κB p65(1∶800;美国CST 公司)和GAPDH(1∶10 000;Abcam)在4 ℃孵育过夜。将膜用Tris 缓冲液-吐温缓冲液洗涤3 次,然后与辣根过氧化物酶标记的二抗(1∶5 000;Abcam)在室温下孵育1 h。使用增强型化学发光试剂(美国PerkinElmer 公司)显示信号。使用Image J 软件计算条带强度,并将其归一化为GAPDH 的条带强度。
1.9 荧光素酶报告基因检测 TLR4 的pGL3 荧光素酶报告质粒由上海Genomeditech 公司设计。使用Lipofectamine 3000 试剂将报告质粒或载体对照和miR-320 模拟物或miR-NC 共转染到NCM460细胞中。48 h 后,使用双荧光素酶测定系统(美国Promega 公司)检测荧光素酶活性。
1.10 统计学方法 数据表示为均数±标准差,并使用SPSS 21.0 进行数据分析。通过方差分析(ANOVA)或t检验评估差异的显著性。P<0.05 为差异有统计学意义。
2 结果
2.1 烧伤诱导的肠屏障功能障碍期间miR-320 表达降低 假手术组肠黏膜绒毛在烧伤后24 h 致密、高耸、完整,无炎性细胞浸润(图1A)。与假手术组相比,烧伤组肠黏膜绒毛水肿、变短、变宽,肠黏膜明显受损,有大量炎性细胞浸润,并且烧伤组大鼠血清中DAO 和FITC 葡聚糖表达显著增加(P<0.05)(图1B-C),表明烧伤大鼠肠道通透性增加。此外,烧伤组大鼠肠道组织中miR-320 的表达较假手术组显著降低(P<0.05,图1D)。
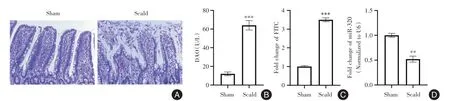
图1 烧伤诱导的肠屏障功能障碍期间miR-320 表达降低Fig.1 Decreased miR-320 expression during burn-induced intestinal barrier dysfunction
2.2 miR-320 上调减弱炎症反应并改善烧伤大鼠的肠道屏障功能 大鼠通过尾静脉连续三天注射miR-320 模拟物,诱导肠组织中miR-320 表达显著增加(P<0.05,图2A)。ELISA 测量显示上调miR-320 显著 降 低了TNF-α 和IL-6的血清浓度(P<0.05,图2B、C)。此外,烧伤诱导的血清DAO和FITC-葡聚糖以及萎缩性肠黏膜的增加被miR-320 模拟物部分改善(P<0.05,图2D、F)。通过用miR-320 模拟物处理,肠道组织中Occludin 和ZO-1的水平也升高(P<0.05,图2G)。
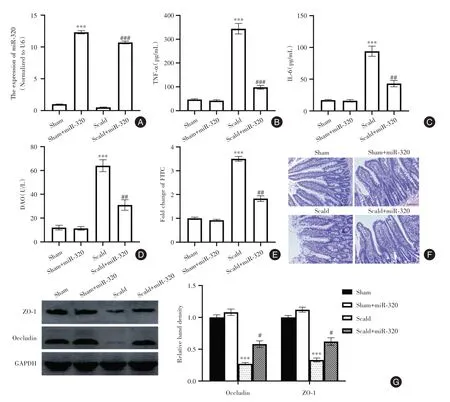
图2 miR-320 上调减弱炎症反应并改善烧伤大鼠的肠道屏障功能Fig.2 Up-regulation of miR-320 attenuates inflammatory response and improves intestinal barrier function in burned rats
2.3 miR-320介导的保护作用涉及TLR4/NF-κB信号通路 与假手术组相比,烧伤组中TLR4、MyD88蛋白的表达和p-NF-κB(p-p65)磷酸化均显著升高(P<0.05)。与烧伤组相比,烧伤+miR-320 组中TLR4、MyD88 蛋白的表达和p-NF-κB(p-p65)磷酸化均显著降低(P<0.05,图3)。

图3 miR-320 抑制烧伤大鼠肠道中TLR4/NF-κB 信号通路Fig.3 miR-320 inhibits the TLR4/NF-κB signaling pathway in the gut of burn rats
2.4 miR-320 体外抑制肠上皮细胞TLR4/NF-κB通路的活性 研究使用TargetScan 证实了TLR4 是miR-320 的潜在靶基因(图4A)。细胞荧光素酶活性测定结果表明,在pGL3-TLR4 3′UTR-WT 载体存在的情况下,用miR-320 模拟物转染的细胞中荧光素酶活性降低(P<0.05,图4B)。此外,LPS 处理的NCM460 细胞中miR-320 表达显著降低(P<0.05),TLR4、MyD88 蛋白的表达和p-NF-κB(p-p65)磷酸化均显著升高(P<0.05,图4C、D)。miR-320上调逆转了LPS 诱导的TLR4/NF-κB 通路激活(P<0.05),并且减少了NCM460 细胞培养基中TNF-α 和IL-6的浓度(P<0.05,图4E、F)。
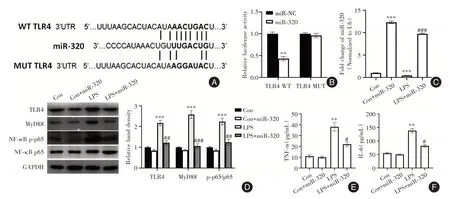
图4 miR-320 体外抑制肠上皮细胞TLR4/NF-κB 通路的活性Fig.4 miR-320 inhibits the activity of TLR4/NF-κB pathway in intestinal epithelial cells in vitro
3 讨论
烧伤会改变肠道结构、功能并破坏肠黏膜屏障,从而导致肠道细菌移位和严重的烧伤感染[1]。因此,保护肠道结构的完整性,促进烧伤后肠黏膜的恢复,具有重要的临床意义。本研究中,HE 染色观察到烧伤模型大鼠肠绒毛紊乱,肠细胞变性坏死,表明烧伤大鼠肠黏膜受损。先前研究表明,miR-320 与肠道免疫密切相关,在肠道损伤中起着核心作用[13]。本研究改变了肠道miR-320的表达并建立了烧伤大鼠模型,结果发现上调miR-320 会降低肠道炎症水平并减轻肠道屏障的破坏,其保护机制与抑制TLR4/MyD88/NF-κB 信号通路激活相关。
越来越多的研究认为miRNA 在许多免疫相关疾病中发挥着重要作用[14]。最近的一项研究[13]报告,miR-320 通过与众多靶标结合来调节主要免疫细胞类型,从而调节微环境。肠道是一个巨大的免疫器官,是一个完整而稳定的生物网络[15]。肠道微环境至关重要,肠道菌群越来越被认为是肠道微环境的重要组成部分;许多研究都报道了疾病中肠道菌群的变化。既往研究报道,miRNAs 参与病原菌感染中免疫功能和炎症的调节[16]。LIU等[17]据报道,大肠杆菌和具核梭杆菌的生长受合成的miRNA 模拟物调节,其渗透细菌并因此影响细菌基因调控。miR-320 具有复杂的生物学功能和独特的表达谱,在各种生理和病理过程中起着至关重要的作用[5]。它是一种被广泛研究的miRNA,与免疫和炎症密切相关。既往研究[18]证实,miR-320 在炎症性肠病患者的炎症组织中低表达。此外,有研究[19]发现miR-320 在实验性结肠炎的过程增强肠道屏障功能。本研究得出了相同的结论。此外,AAV9 可以介导肠道中的靶向基因转移来调节miR-320 在肠道中的表达[20]。本研究发现miR-320 过表达减轻了肠道屏障的破坏与炎症水平。因此,进一步证明了miR-320 可能在保护烧伤介导的肠道破坏中起重要作用。
本研究观察到烧伤诱导后,大鼠表现出严重的肠道炎症,这与之前的研究结果一致[3,10]。同时,烧伤诱导肠道TLR4/MyD88/NF-κB 信号通路的明显激活。miR-320 干预改善了肠道炎症,并显著抑制了TLR4/MyD88/NF-κB 的激活。TLR4/MyD88/NF-κB 通路被普遍认为在炎症反应中起关键作用[21]。在健康的成年哺乳动物中,肠道上皮中的TLR4 表达水平通常非常低甚至可以忽略不计,从而限制了针对胃肠道微生物群的过度炎症反应[22];而在各种病理情况下肠道TLR4 表达显著增加,例如缺血/再灌注、内毒素血症、溃疡性结肠炎等[23]。WEN 等[24]发现在严重烧伤大鼠肠道的黏膜中,TLR4和NF-κB蛋白水平高度上调。相比之下,本研究显示烧伤后大鼠肠道组织中TLR4 蛋白表达的明显上调。另一方面,TLR4/NF-κB 激活也被证明可以下调TJP 表达并增加肠道通透性。GUO 等[5]观察到烧伤大鼠回肠远端TLR4/NF-κB 激活,伴随明显的肠道屏障破坏,表现为血浆DAO 和内毒素水平升高,以及ZO-1 和occludin 下调。本研究验证了上述结果,并在体外观察到miR-320 可抑制LPS 诱导的肠上皮细胞TLR4/NF-κB 信号通路激活,表明miR-320 的肠道保护机制与抑制TLR4/NF-κB 通路有关。
总之,本研究揭示了烧伤诱导的肠屏障功能障碍中miR-320 水平降低。miR-320 的上调通过抑制TLR4/MyD88//NF-κB 信号通路来减少炎症反应并改善肠道屏障功能。因此,miR-320 有望成为治疗烧伤诱导的肠道屏障功能障碍的潜在新靶点。
