宁波地区耐碳青霉烯类高毒力肺炎克雷伯菌的分子生物学特征研究
2022-10-19屠艳烨吴巧萍李情操裘雪丹
高 晖,屠艳烨,吴巧萍,李情操,杨 烨,裘雪丹
肺炎克雷伯菌(Klebsiellapneumoniae)是一种革兰阴性兼性厌氧菌,常引起多种机会性感染疾病,如肺炎、脑膜炎、肝脓肿等[1-2]。与经典肺炎克雷伯菌不同,高毒力肺炎克雷伯菌可在健康或免疫功能低下的个体中引起侵袭性感染,往往预后较差、致死率较高[3]。以往研究认为高毒力肺炎克雷伯菌对抗生素高度敏感,然而,近年来越来越多的研究发现耐碳青霉烯类高毒力肺炎克雷伯菌(carbapenem-resistant hypervirulentKlebsiellapneumoniae,CR-hvKP)的存在。兼具耐药性和高毒力的CR-hvKP通常会导致严重院内感染,尤其是院内小规模的流行暴发给临床的抗感染治疗带来严峻挑战[4]。此外,CR-hvKP分子流行特征具有多样性,因此本课题组收集宁波地区3家医院150株耐碳青霉烯类肺炎克雷伯菌,通过对宁波地区CR-hvKP耐药基因及毒力基因的分析研究,为本地区CR-hvKP的院感防控及临床抗感染治疗提供理论依据。
1 材料与方法
1.1 菌株来源 收集自宁波市3家医院临床分离的150株耐碳青霉烯类肺炎克雷伯菌(CRKP)。入选标准:根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M100-S31标准判读,亚胺培南MIC法≥16 μg/mL为耐药[5];耐碳青霉烯类高毒力肺炎克雷伯菌(CR-hvKP)的判定标准:①亚胺培南MIC≥16 μg/mL;②拉丝实验阳性;③毒力基因rmpA阳性。须同时满足以上3个条件,用WHONET 5.6软件剔除重复分离菌株。
1.2 细菌鉴定及药物敏感分析 采用VITEK 2 Compact全自动微生物分析仪对分离菌株进行鉴定和体外药敏试验,用纸片扩散法(Kirby-Bauer法)进行药敏验证,亚胺培南药敏纸片购于英国Oxoid公司,根据CLSI指南KB法亚胺培南≤13 mm为耐药;质控菌株大肠埃希菌(ATCC25922)和阴沟肠杆菌(ATCC700323)由宁波市临床检验中心惠赠。
1.3 高黏液表型的筛选 将150株耐碳青霉烯类肺炎克雷伯菌接种于哥伦比亚血平板中,二氧化碳培养箱35 ℃培养过夜,次日用接种环挑起单一菌落,若两次挑起形成的黏液丝长度≥5 mm,则为拉丝实验阳性。
1.4 细菌DNA提取 从哥伦比亚血琼脂平板上挑取单个菌落置于含250 μL灭菌蒸馏水的灭菌EP管中,震荡混匀后100 ℃高温金属浴加热煮沸10 min,经12 000 r/min高速离心5 min后,吸取上清至1.5 mL灭菌EP管中,保存在-20 ℃冰箱备用。
1.5 菌株血清荚膜型及毒力基因检测 利用PCR扩增技术检测CR-hvKP的6种常见荚膜多糖基因K1、K2、K5、K20、K54、K57;常见毒力基因包括荚膜多糖生成调节基因(rmpA、magA)、铁载体基因(aerobactin、kfu、entB)、菌毛定值与黏附基因(ureA、fimH、kpn、allS、mrkD)、脂多糖形成相关基因(uge、wabG),扩增引物序列参照文献[6-8],部分引物由上海生工生物工程有限公司设计合成(表1);整合子intI1型引物序列为F:CCAAGCTCTCGGGTAACATC;R:CCCGAGGCATAGACTGTA;intI2、intI3型引物参见文献[9]。PCR反应体系:DNA模板3 μL,上下游引物各1 μL,Tag酶10 μL,加ddH2O至25 μL;反应条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。

表1 CR-hvKP常见毒力基因引物Tab.1 CR-hvKP common virulence gene primers
1.6 碳青霉烯类耐药基因检测 利用PCR扩增技术检测碳青霉烯类相关耐药基因,耐药基因包括A类的碳青霉烯酶(KPC);B类的亚胺培南酶(IMP)、新德里金属β-内酰胺酶(NDM)、维罗纳整合子编码金属β-内酰胺酶(VIM);D类的苯唑西林酶48(OXA-48),引物序列参照文献[10]。PCR反应体系为:DNA模板1 μL,上下游引物各1 μL,Tag酶12.5 μL,加ddH2O至25 μL;反应条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.7 PCR扩增产物电泳 电压110 V,电泳时间15 min。电泳结束后用凝胶成像仪拍摄电泳图,并将目的条带送去上海生工生物工程股份有限公司测序验证。
1.8 统计学处理 应用 WHONET 5.6 软件处理数据,计数资料以菌株数和百分数表示。
2 结 果
2.1 CR-hvKP标本来源、临床科室分布及对抗菌药物的耐药率 150株CRKP标本类型来源分别为痰液(78株,52.0%)、全血(26株,17.3%)、尿液(23株,15.3%)、分泌物(13株,8.7%)、引流液(4株,2.7%)、粪便(2株,1.3%)、胆汁(2株,1.3%)及其他类型(2株,1.3%);150株CRKP病区分布情况,其中ICU检出CRKP最多(68株,45.3%),其次为呼吸内科(29 株,19.3%)、血液科(14 株,9.3%)、泌尿外科(13株,8.6%)、感染科(11株,7.3%)、心血管内科(8株,5.3%)、神经外科(5株,3.3%)以及其他科室(2株,1.3%)。
通过拉丝实验及rmpA基因检测,从150株耐碳青霉烯类肺炎克雷伯菌中筛选出14株CR-hvKP,检出率为9.33%(14/150)。主要分离自全血6株、痰液5株、尿液1株、粪便1株和分泌物1株;其中5株CR-hvKP来源于重症监护病房ICU,其次为呼吸内科3株、血液科3株,泌尿外科、感染科和心胸外科各1株(表2),14株CR-hvKP除对阿米卡星和复方新诺明的耐药率为57.14%以外,对表中其它抗生素的耐药率均在85%以上(表3)。
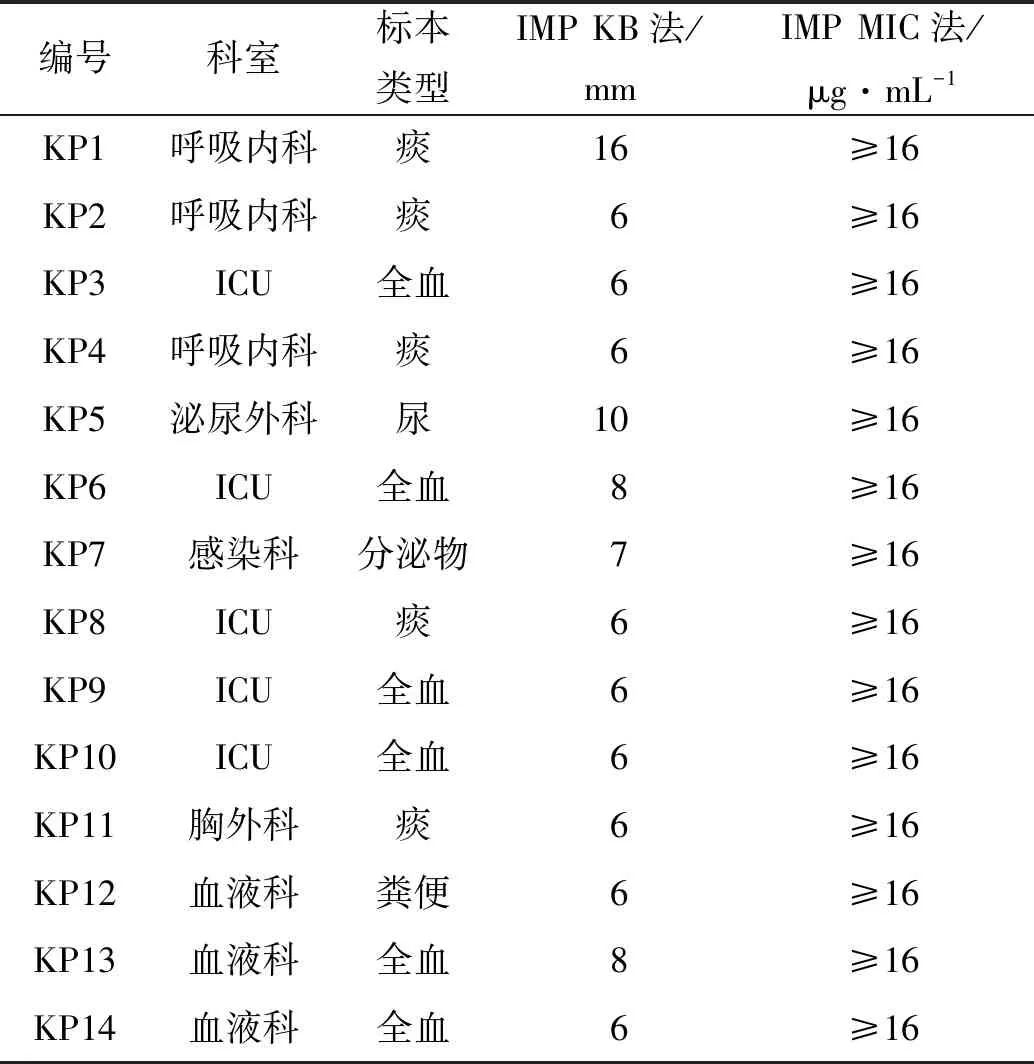
表2 14株CR-hvKP基本资料Tab.2 Basic information on the 14 CR-hvKP strains
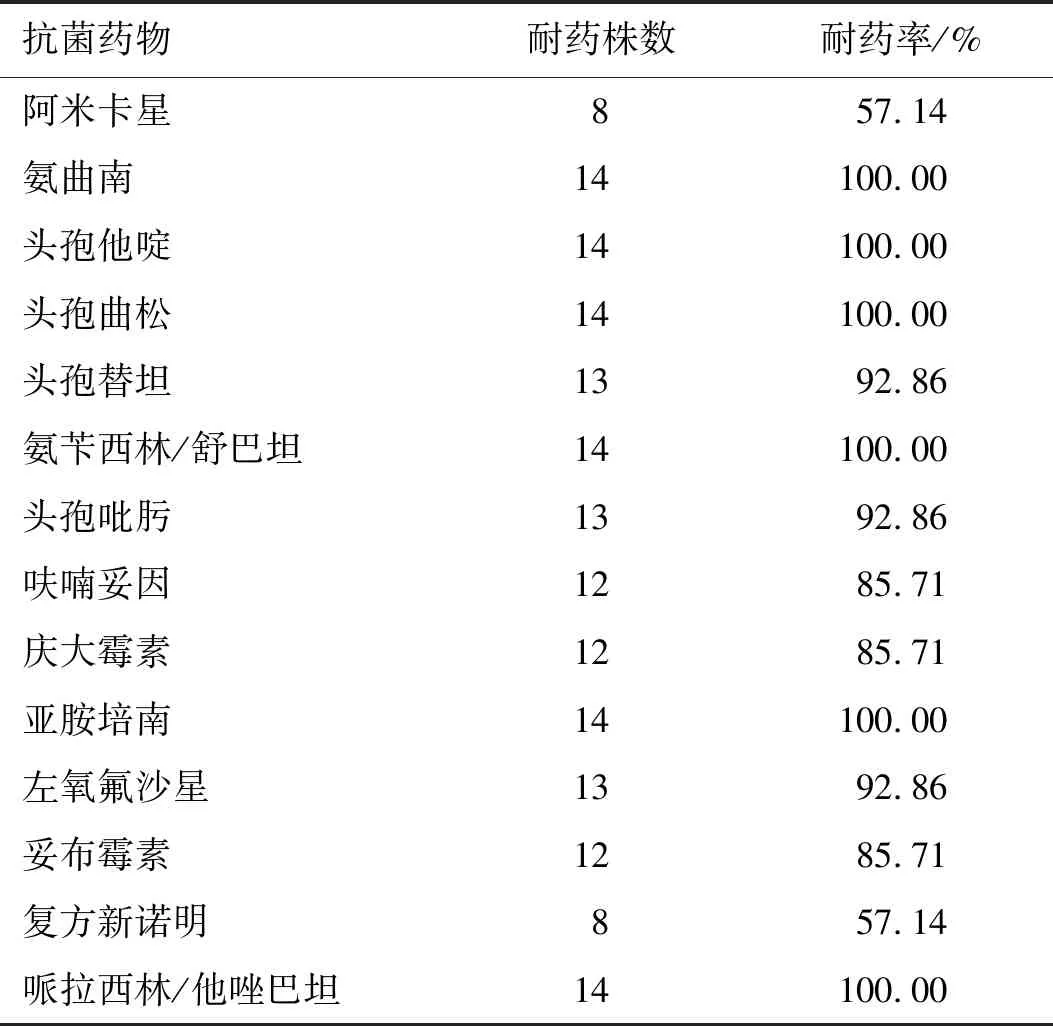
表3 14株CR-hvKP对抗菌药物的耐药情况Tab.3 Resistance rates of the 14 CR-hvKP strains to antibiotics
2.2 CR-hvKP表型及耐药基因检测 14株CR-hvKP拉丝试验阳性,荚膜血清分型结果显示9株为K2型,1株为K57型,4株未分型;14株均为intI1型整合子,intI2型、intI3型整合子均未检出。检测14株CR-hvKP耐药基因结果显示,12株(85.71%)携带KPC-2基因,4株(28.57%)携带NDM-1基因,1株(7.14%)携带IMP-1基因,其中有3株(21.43%)同时携带KPC-2和NDM-1基因(表4)。
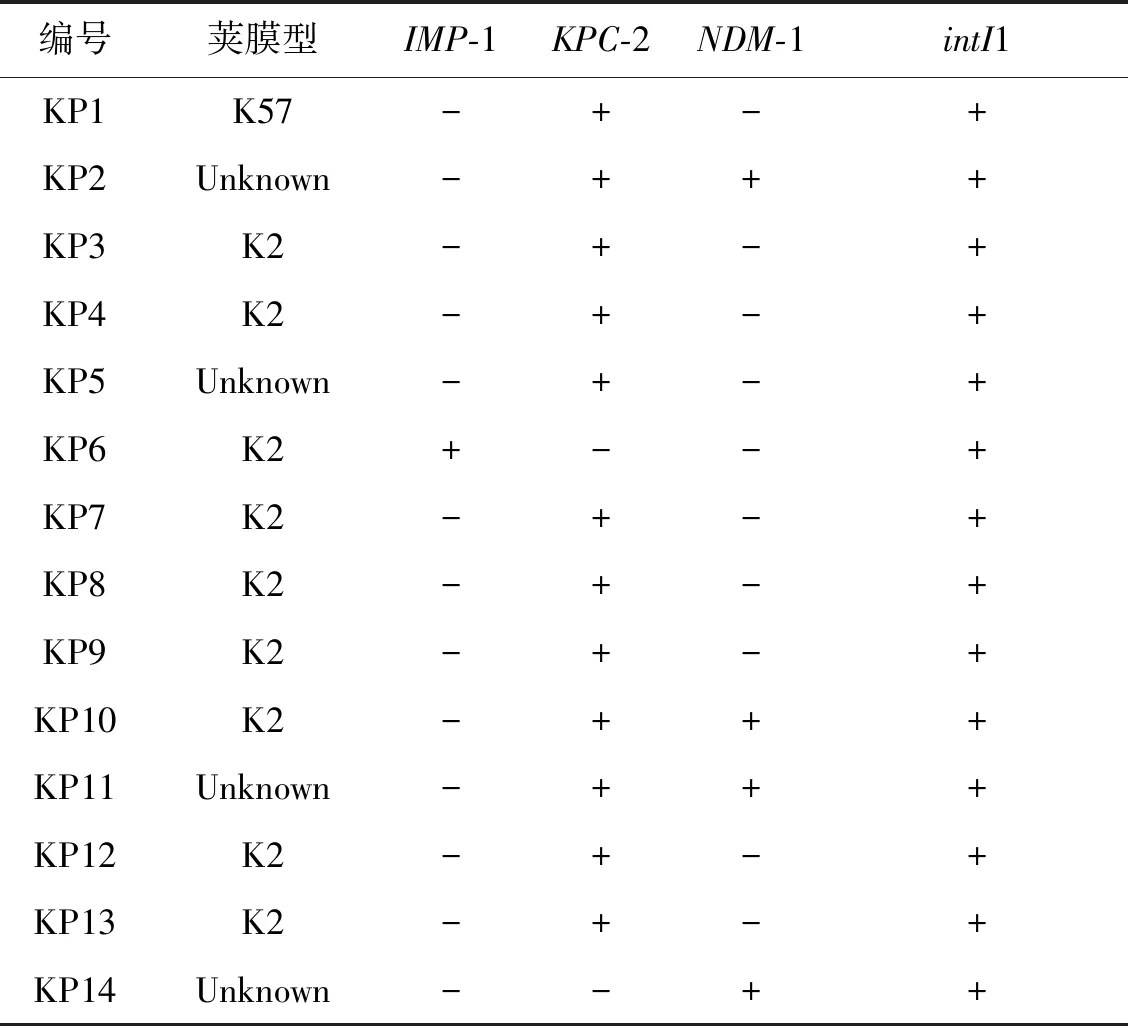
表4 14株CR-hvKP荚膜血清型、耐药基因及整合子检测结果Tab.4 Detection of the capsular serotype,drug resistance genes and integron type in 14 CR-hvKP strains
2.3 CR-hvKP毒力基因检测 对14株CR-hvKP的毒力基因进行检测,结果显示14株CR-hvKP均携带rmpA、kpn、entB、wabG、ureA、fimH基因,携带率为100%;13株携带uge基因,携带率为92.86%;6株携带mrkD基因,携带率为42.86%;2株携带aerobactin基因,携带率为14.29%;携带kfu、allS基因各1株,携带率仅为7.14%;未发现携带magA基因菌株;且14株菌株携带的毒力基因最多达9种。见图1和表5。

图1 毒力因子在CR-hvKP中所占比例Fig.1 Proportion of virulence factors in CR-hvKP

表5 14株CR-hvKP毒力基因携带情况Tab.5 Virulence gene carriage status of 14 CR-hvKP strains
3 讨 论
近年来,随着高毒力肺炎克雷伯菌(hypervirulentKlebsiellapneumoniae,hvKP)耐药性的增强,越来越多的临床CR-hvKP分离株被报道[11]。CR-hvKP在健康人群中常常会引起严重的、难以治疗的感染疾病,Zhou等发现国内CR-hvKP的临床检出率呈现逐渐上升的趋势,已对公共健康构成重大威胁[12]。本研究从宁波地区3家医院150株耐碳青霉烯类耐药肺炎克雷伯菌中筛查出14株CR-hvKP(9.33%),检出率明显高于Zhang等人报道的国内平均水平(5.2%)[13]。14株CR-hvKP主要分离自全血(6株,42.9%)和痰液(5株,35.7%),与王晶俏等报道的徐州地区CR-hvKP主要分离自痰液有所不同[14],本地区血流感染的CR-hvKP占据主要地位,提示传播情况较为严重;本地区患者主要来自ICU(5株,35.7%)、呼吸科(3株,21.4%)和血液科(3株,21.4%),可能与上述科室抗生素的长期高剂量应用及血液病人本身免疫功能低下有关。
本研究对14株CR-hvKP的荚膜血清型分型结果显示,9株为K2型,1株为K57型,4株未分型为非常见荚膜血清型,这与主流报道的CR-hvKP常见荚膜血清型为K1、K2型相一致[13],而与Zhou等报道上海地区分离的CR-hvKP荚膜血清型主要为K64型明显不同[12],且本次筛选本地区CR-hvKP未发现K1型荚膜,这与CR-hvKP形成的基因多态性有关,因此荚膜血清型存在地域差异。14株CR-hvKP的药敏结果显示其对临床常用抗生素呈现多重耐药性,对14株CR-hvKP耐药基因检测显示,宁波地区耐碳青霉烯类耐药基因以KPC-2基因为主(12株,85.71%),这与Zhang等2020年全国多中心CR-hvKP的研究结果相符合[13],但携带NDM-1基因(4株,28.57%)和IMP-1基因(1株,7.14%)的CR-hvKP检出率比上海地区要明显升高[12],此外,我们首次在宁波地区检出了同时携带KPC-2和NDM-1基因(3株,21.43%)的CR-hvKP,可能与其同时携带多种耐药质粒有关,其具体耐药机制有待进一步研究。经检测14株CR-hvKP均为intI1型整合子,未检出intI2型、intI3型整合子,与以往文献报道肺炎克雷伯菌携带I类整合子相一致[15]。
CR-hvKP的毒力因子在其致病机制中具有重要作用,本研究对14株CR-hvKP的毒力基因检测发现,与荚膜多糖生成有关的基因(rmpA、wabG、kpn)、铁转运相关的基因(aerobactin、kfu、entB、ureA、uge)、菌毛介导的与宿主细胞黏附相关的基因(allS、fimH、mrkD)均有不同程度的表达,其中kpn、entB、wabG、ureA、fimH携带率最高,为100%;其次为mrkD基因,携带率为42.86%;气杆菌素铁载体aerobactin基因携带率为14.29%;而kfu、allS基因携带率仅为7.14%;本地区未发现携带magA基因的菌株;且KP1和KP11号菌株携带多达9种毒力基因。对于14株CR-hvKP的具体形成机制,需要进一步研究进行阐明。目前已有研究发现,非高毒力耐碳青霉烯类肺炎克雷伯菌可通过pLVPK-like毒力质粒获得hvKP携带的毒力基因[16],hvKP也可以经碳青霉烯类抗生素诱导外膜孔蛋白变异或捕获编码碳青霉烯酶的质粒转变为CR-hvKP[17-19],后续我们将对2株携带气杆菌素铁载体aerobactin基因的菌株进行全基因组测序,并对其形成的分子机制进行研究。
目前,临床感染CR-hvKP呈逐渐上升趋势,而对于CR-hvKP的形成机制及致病机理却并未完全阐明,Gu等报道了一起院内CR-hvKP暴发事件[20],为我们敲响了CR-hvKP院内感染的警钟。因此,了解本地区CR-hvKP的分子流行特征及耐药分布,加强耐药监测及管控临床抗生素的使用,对减少CR-hvKP的院内感染及传播具有重要意义。
利益冲突:无
引用本文格式:高晖,屠艳烨,吴巧萍,等.宁波地区耐碳青霉烯类高毒力肺炎克雷伯菌的分子生物学特征研究[J].中国人兽共患病学报,2022,38(9):796-801.DOI:10.3969/j.issn.1002-2694.2022.00.115
