培养核心素养 提高解题能力
——例析陌生方程式书写的应对策略
2022-10-19高梅英曹义龙
高梅英 曹义龙
《普通高中化学课程标准(2017年版2020年修订)》中关于高中化学课程性质与基本理念一节明确提出:普通高中化学课程是与义务教育化学或科学课程相衔接的基础教育课程,是落实立德树人根本任务、发展素质教育、弘扬科学精神、提升学生核心素养的重要载体;化学学科核心素养是学生必备的科学素养,是学生终身学习和发展的重要基础;化学课程对于科学文化传承和高素质人才的培养具有不可替代的作用。
一、陌生氧化还原方程式的考查价值及统计
在历年化学高考题中,方程式书写都是热门、高频的考查形式,且陌生方程式书写的考查渐趋增多,难度渐趋增大,这也是随着新课程改革不断深入,高考试卷不断由知识立意向能力立意转化的必然结果。这种形式可以很好地考查学生的证据推理、模型认知、科学精神与社会责任等核心素养,所占分值的权重近几年始终保持在较高的水平,这也是未来高考等级考的发展趋势。
笔者对近年来北京市化学高考直接考查方程式书写的题目进行了统计,如下表:
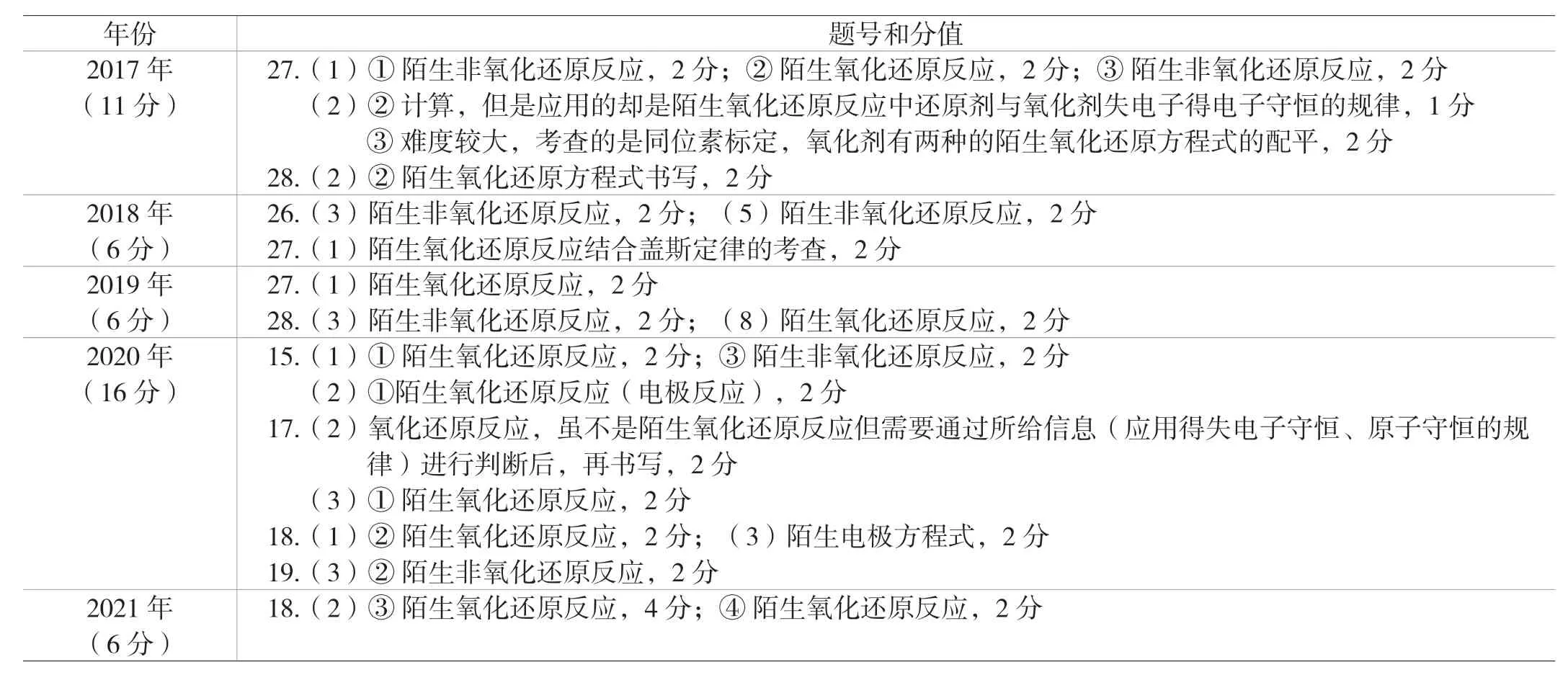
年份 题号和分值2017年(11分)27.(1)① 陌生非氧化还原反应,2分;② 陌生氧化还原反应,2分;③ 陌生非氧化还原反应,2分 (2)② 计算,但是应用的却是陌生氧化还原反应中还原剂与氧化剂失电子得电子守恒的规律,1分 ③ 难度较大,考查的是同位素标定,氧化剂有两种的陌生氧化还原方程式的配平,2分28.(2)② 陌生氧化还原方程式书写,2分2018年(6分)26.(3)陌生非氧化还原反应,2分;(5)陌生非氧化还原反应,2分27.(1)陌生氧化还原反应结合盖斯定律的考查,2分2019年(6分)27.(1)陌生氧化还原反应,2分28.(3)陌生非氧化还原反应,2分;(8)陌生氧化还原反应,2分2020年(16分)15.(1)① 陌生氧化还原反应,2分;③ 陌生非氧化还原反应,2分 (2)①陌生氧化还原反应(电极反应),2分17.(2)氧化还原反应,虽不是陌生氧化还原反应但需要通过所给信息(应用得失电子守恒、原子守恒的规 律)进行判断后,再书写,2分 (3)① 陌生氧化还原反应,2分18.(1)② 陌生氧化还原反应,2分;(3)陌生电极方程式,2分19.(3)② 陌生非氧化还原反应,2分2021年(6分)18.(2)③ 陌生氧化还原反应,4分;④ 陌生氧化还原反应,2分
二、对学生进行问题调研和问题分析
2020年北京高考是新一轮高考综合改革后的首次高考,化学等级考试题整体难度不大,但学生在解答第17题时,情况却不太理想,尤其是第17题的第(3)问,这种情况引起了笔者的思考,并促使笔者对学生产生错误的原因进行针对性的调研,发现学生出错主要是因为证据推理及模型认知的化学核心素养不够。
笔者针对2020年北京高考等级考17题的原题(12分)对学生出现的问题一一进行剖析。
用如下方法回收废旧CPU中的单质Au(金)、Ag和 Cu。
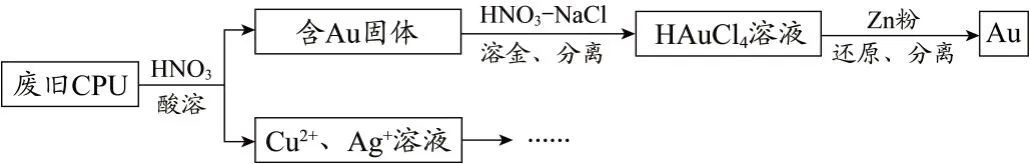
已知:① 浓硝酸不能单独将 Au 溶解。
② HAuCl4 = H+ + AuCl4- 。
(1)酸溶后经______操作,将混合物分离。
(2)浓、稀HNO3 均可作酸溶试剂。溶解等量的Cu消耗HNO3 的物质的量不同,写出消耗HNO3物质量少的反应的化学方程式:__________________。
(3)HNO3-NaCl 与王水[V(浓硝酸)∶V(浓盐酸) =1∶3]溶金原理相同。
(4)将溶金反应的化学方程式补充完整:
Au+□NaCl+□HNO3 = HAuCl4+□___+□___+□ NaNO3
答案:Au+4NaCl+5HNO3 = HAuCl4+NO↑+2H2O+ 4NaNO3
学生的错因分析:不能根据信息正确判断还原产物是NO;配平过程混乱,无法配平;因配平过程思维混乱,导致无法正确判断缺少的产物是H2O;在对还原产物NO判断无误后,因对各物质在反应中所起作用不清,导致配平错误。
三、建立陌生氧化还原方程式的书写模型
基于学生的问题,在解答有关陌生方程式书写问题时,教师可以建立以下的模型。
首先,判断书写反应的反应类型。根据化合价有无变化,判断是非氧化还原反应(无化合价变化),还是氧化还原反应,包括陌生电极反应式(有化合价变化),对非氧化还原反应还应判断出是酸碱反应、沉淀反应,还是络合反应。
其次,判断书写反应形式及核心反应物和产物。一是无论哪种反应,均要注意试题要求书写反应的形式——化学方程式还是离子方程式;二是根据题目信息,即文字信息、图表信息等,正确写出反应的核心反应物、生成物的化学式或离子符号。
再次,根据反应类型不同,选择不同配平方法。如是非氧化还原反应,根据核心元素的原子守恒定律,配平部分物质的化学计量数;再分析反应环境是中性、酸性还是碱性,根据其他原子如H或O守恒配平即可,若书写离子方程式,也可据电荷守恒配平。
如是氧化还原反应,首先找出核心物质,是氧化剂、还原剂、还原产物还是氧化产物,当然根据反应的不同,上述物质也可能是三种,如歧化反应、归中反应;也可能是四种以上,如当氧化剂或还原剂不只一种,亦或是还原产物、氧化产物不只一种;然后根据得失电子守恒(或化合价升降总数相等),求出得失电子(或升降价)的最小公倍数,先配平物质的化学计量数,再根据据原子守恒和反应环境判断并书写出其他反应物或产物。这部分是学生最易忽视,或虽重视了但遇到具体情况时经常会出现判断失误的环节,更需在平时训练中多加重视。
最后是配平方程式。据原子守恒配平其他物质的化学计量数,如果是离子方程式或电极反应式,电荷守恒就是经常优先考虑的配平方法,如烃或烃的含氧衍生物做燃料电池负极反应物时,碱性条件下书写负极反应式,要优先使用电荷守恒配OH-的化学计量数,再使用原子守恒配平H2O的化学计量数,使配平更简单。配平的一般顺序:金属元素→非金属元素(除H、O之外)→H(O)→O(H),因题而异,灵活运用。
四、应用模型解决问题
下面我们用以上模型来分析2020年北京高考化学等级考第17.(3)题的陌生方程式书写。首先判断要书写反应的反应类型是氧化还原反应并找出核心物质,根据题目中“HNO3-NaCl 与王水[V(浓硝酸)∶V(浓盐酸) = 1∶3]溶金原理相同”的证据,及王水中的硝酸浓度约为原来浓HNO3浓度的1/4,应视作稀硝酸,按HNO3的一般还原规律,还原产物应为NO。
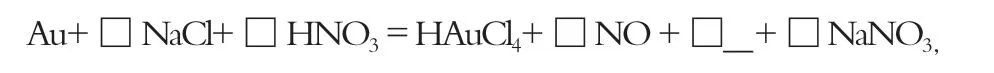
然后标价,求总数:
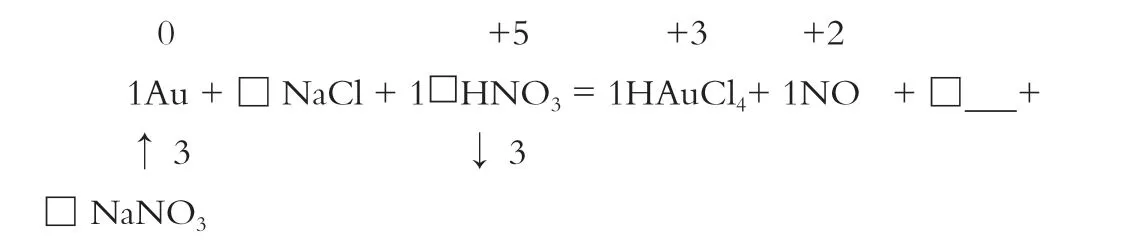
再看环境,确定其他参与或生成的物质:
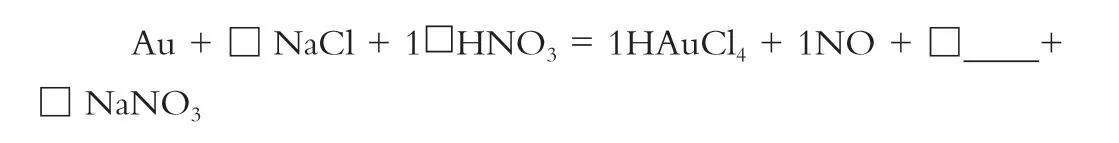
最后按原子守恒配平方程式:
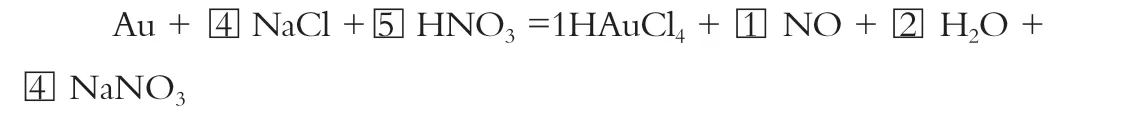
根据Cl-守恒,NaCl化学计量数为4;根据Na+守恒,NaNO3化学计量数为4;根据N原子守恒,HNO3最终化学计量数为1+4=5 ;根据H或O原子守恒,H2O的计量数为2。完成方程式的配平。
学生在配平复杂的氧化还原方程式时,往往缺乏上述配平的逻辑思维,导致配平过程混乱,最后无法完成配平任务。
2020年高考是北京市对选科实行等级考的第一年,题目相对要简单,而2021年北京高考化学等级考的难度明显增大,对陌生氧化还原方程式的书写考查难度更是前所未有地加大了定量的考查,这已经不是学生简单地掌握了陌生氧化还原方程式的书写模型就能顺利解决的问题了。
这样的变化符合《中国高考评价体系说明》的相关要求,而且这应该也是今后高考的出题方向,《中国高考评价体系说明》明确了“一核”“四层”“四翼”。“一核”即“立德树人,服务选才、引导教学”的考查目的,是对素质教育中高考核心功能的概括;“四层”即“核心价值、学科素养、关键能力、必备知识”,是素质教育目标在高考中的提炼。[1]因此教师日常教学就要注意培养学生的化学核心素养。
下面笔者利用前文所述书写陌生氧化还原方程式的书写模型,分析2021年北京市高考等级考化学中的第18题中相关考点。原题:
(1)由钛白粉废渣制备铁黄,流程如下:
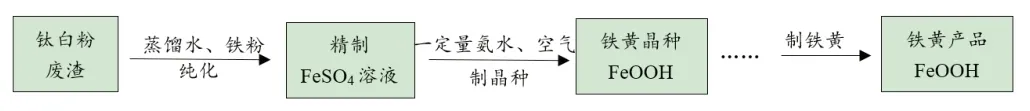
资料:iii.0.1mol·L-1Fe2+生成Fe(OH)2,开始沉淀时pH = 6.3,完全沉淀时pH = 8.3
0.1mol·L-1Fe3+生成FeOOH,开始沉淀时pH = 1.5,完全沉淀时pH = 2.8
(2)制晶种:向FeSO4溶液中滴加氨水,先出现白色沉淀,后变为灰绿色。加氨水至pH = 6时,开始通入空气,溶液pH随时间的变化曲线如图
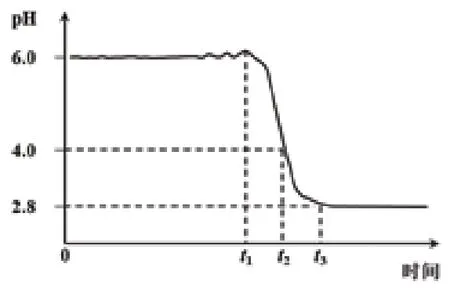
(3)0-t1时刻,pH几乎不变,t1-t2时刻,pH减小,结合方程式解释原因:______。
(4)pH = 4时制备晶种,t3时刻之后,再通空气,pH几乎不变,c(Fe2+)仍然减小,但c(Fe3+)在增加,c(Fe2+)的减小量大于c(Fe3+)的增加量,结合总方程式说明原因:_______。
本题考查的是还原剂+2价Fe被O2氧化为+3价Fe的陌生方程式的书写,难点是学生要根据题目已知条件ⅲ,以及通入空气后溶液pH随时间变化的曲线图这两个证据,正确推理出两种价态Fe的具体存在形式。若解决了上述难点问题,再结合前述模型来书写方程就变得很容易。
0-t1时刻,溶液pH基本维持6.0,据已知ⅲ,溶液中+2价Fe有两种存在形式Fe2+、Fe(OH)2,+3价Fe为FeOOH。若反应物为Fe2+,按离子方程式的电荷守恒判断,必然生成H+,而题目中pH几乎不变,故反应物为Fe(OH)2,按上述书写模型,很容易写出该方程为:4Fe(OH)2+ O2= 4FeOOH↓ +2H2O,c(H+)不变。
t1-t2时刻,pH:6.0→4.0,据已知ⅲ,按上述分析,还原剂应为Fe2+,氧化产物为FeOOH,很容易写出方程式:4Fe2++O2+6H2O = 4FeOOH↓+8H+,c(H+)增大。
pH=4时,根据已知ⅲ,+2价Fe的存在形式为Fe2+;根据t3时刻后pH几乎不变,说明无H+消耗或生成;根据c(Fe2+)仍然减小,但c(Fe3+)在增加,说明Fe3+为氧化产物;c(Fe2+)的减小量大于c(Fe3+)的增加量,据Fe原子守恒,说明Fe3+只是氧化产物之一,+3价Fe还有FeOOH的形式;反应前后Fe2+与Fe3+保持电荷守恒;故按配平模型,分以下几步完成整个离子方程式的书写。
1)Fe2++O2= Fe3++FeOOH↓;
2)4Fe2++O2=Fe3++FeOOH↓(依据:得失电子守恒、电荷守恒、Fe元素守恒);
3)12Fe2++ 3O2+ 2H2O = 8Fe3++ 4FeOOH↓(依据H、O原子守恒,配平方程式中化学计量数为最简整数比)。
故答案为:12Fe2++3O2+2H2O = 8Fe3++4FeOOH↓,c(H+)不变,消耗的Fe2+多,生成的Fe3+少。
笔者应用前文给出的模型对2020年北京高考等级考第17题(3)和2021年第18题(2)三个较为复杂方程式的配平步骤进行了详细的分析,对笔者以后的教学产生了良好启发。
陌生方程式的考查未来应该仍将是高考的重点考查形式,如果教师从高一开始就注意采用本文中的模型方法,不断对学生进行有意识的训练,学生在三年后可达到较好的模型认知水平,并具有应用模型解决高考相关问题的能力。
