lncRNA GHET1通过Wnt/β-catenin信号通路对子痫前期滋养层细胞生物学行为的影响
2022-10-18黄晓妹王洪伟韩贞艳韦秋园黄素静
黄晓妹,王洪伟,韩贞艳,韦秋园,黄素静
(海南医学院第二附属医院产科,海南 海口 570100)
子痫前期(preeclampsia,PE)作为一种临床常见的妊娠期并发症,严重影响母婴健康,是导致孕产妇和围产儿死亡的重要原因之一[1]。迄今为止,PE的病因和发病机制尚未完全阐明。既往研究[2]显示:胎盘滋养层细胞浸润不足是导致子宫螺旋动脉功能障碍并最终形成PE的主要原因。研究[2]显示:滋养层细胞的高增殖和高侵袭特性与肿瘤细胞具有一定的相似性,探究肿瘤相关分子在滋养层细胞侵袭中的作用可能对阐明PE发生机制具有积极意义。
长 链 非 编 码RNA(long non-coding RNAs,lncRNAs)是一类长度超过200个核苷酸且不具有蛋白质编码功能的RNA序列。lncRNAs通过基因印迹、组蛋白修饰、染色体重塑、选择性剪切和细胞周期控制等作用在表观、转录和转录后水平调控基因的表达,参与机体的病理生理过程[3]。位于7号染色体上的lncRNA胃癌高表达转录本1(lncRNA gastric carcinoma high expression transcript 1,lncRNA GHET1)是一种已被证实能够上调胃癌、肝癌、前列腺癌及宫颈癌等多种肿瘤细胞增殖、侵袭、迁移和上皮-间充质转化(epithelial-mesenchymal transformation,EMT)等能力进而促进疾病进展的lncRNA[4]。对于其能否通过影响滋养层细胞增殖和侵袭能力而参与PE的进展及其相关作用机制尚未完全阐明。本研究旨在探讨lncRNA GHET1在PE患者胎盘组织中表达及其对滋养层细胞增殖、细胞周期进展和细胞侵袭等行为的影响及其作用机制,以期为lncRNA GHET1可能成为治疗及改善PE的潜在控制靶点提供理论和实验依据。
1 材料与方法
1.1 临床资料选择2018年10月—2019年10月于海南医学院第二附属医院产科住院分娩的孕产妇30例作为研究对象。根据谢兴等主编的第9版《妇产科学》中的相关诊断标准[5]将研究对象分为正常对照孕产妇组(正常组)15例和PE孕产妇组(PE组)15例。
1.2 纳入和排除标准纳入标准:①所有孕产妇均为阴道分娩;②所有孕产妇年龄均在20~35岁;③所有研究对象均为自然单胎受孕。排除标准:①并发原发性高血压或肝、肾、心、脑、糖尿病及内分泌系统疾病等;②孕期使用激素类药物或并发胎盘早剥及前置胎盘等妊娠并发症;③既往有早产、宫内死胎和胎儿染色体异常等不良分娩史。本研究经本院伦理委员会审批,所有研究对象均签署知情同意书。
1.3 细胞、主要试剂和仪器人绒毛膜滋养层细胞HTR-8/SVneo(HTR-8细胞)(美国ATCC细胞库)。RPMI-1640(美国Hyclone公司),胎牛血清(杭州天航生物科技有限公司),100 U·mL-1青霉素和100 mg·L-1链霉素双抗混合液(美国Sigma公司),过表达lncRNA GHET1和阴性对照序列pcDNA 3.1载体质粒(上海吉玛制药技术有限公司),Lipofectamine 3 000和TRIzol(美 国Invitrogen公司),PrimeScriptTMRT Master Mix反转录试剂盒和SYBR ExScript RT-PCR试剂盒(日本TaKaRa公司),RIPA裂解液、蛋白酶抑制剂、BCA试剂盒和PI/RNase细胞周期流式检测试剂盒(上海碧云天生物技术有限公司),HE染色试剂盒和辣根过氧化物酶标记的山羊抗兔二抗(北京索莱宝科技有限公司),CCK-8试 剂 盒、小 鼠 抗E-钙 黏 蛋 白(E-cadherin)和波形蛋白(Vimentin)单克隆抗体(美国Abcam公司),兔抗糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)、磷酸化糖原合成酶激酶3β(phosphorylated glycogen synthase kinase 3β,p-GSK3β)和β-连 环 蛋 白(β-catenin)单克隆抗体(美国Santa Cruz公司),兔抗细胞性骨髓细胞瘤病病毒癌基因(cellularmyelocytomatosis viral oncogene,c-Myc)、细胞周期 素D1(cyclinD1)和GAPDH(美 国Cell Signaling Technology公司),Matrigel基质胶(美国BD Biosciences公司)。Transwell小室(8 μm)(美国Millipore公司),光学显微镜(日本Olympus公司)。
1.4 2组研究对象胎盘组织处理孕产妇分娩中胎盘娩出后立即收集全层胎盘组织约20~40 g,置于冰上迅速带回实验室。无菌生理盐水充分清洗血污后,将胎盘组织分为2部分,一部分固定于4%多聚甲醛溶液中进行HE染色,以观察2组胎盘组织的形态表现;另一部分置于-80℃冰箱冻存备用。
1.5 HTR-8细胞培养、转染和分组HTR-8细胞培养于含10%FBS和1%青-链霉素DMEM-1640培养基中,置于37℃、5%CO2培养箱中培养。转染前,常规使用1%胰蛋白酶进行消化生长融合至80%HTR-8细胞,计数后,按每孔2×105个细胞接种至6孔细胞培养板中,培养过夜后,使用Lipofectamin 3 000转染试剂将过表达lncRNA GHET1和阴性对照序列pcDNA3.1载体质粒转染至HTR-8细胞中,培养6 h后更换为含10%FBS的DMEM-1640培养液,继续培养24 h后收集细胞进行后续实验。将HTR-8细胞随机分为对照组(常规培养)、lncRNA GHET1组(转染过表达lncRNA GHET1质粒)和阴性对照组(转染阴性对照序列质粒)。
1.6 HE染色观察2组研究对象胎盘组织病理形态表现将2组研究对象的胎盘组织样本置于4%多聚甲醛溶液中固定24 h,常规石蜡包埋,制备4 μm厚切片,二甲苯和梯度酒精脱蜡至水,随后使用苏木素染色5 min,水洗1 min,氨水返蓝,伊红染色2 min,再次进行酒精脱水和二甲苯透明,最后封片、镜检。
1.7 实时荧光定量PCR(real-time fluorescence quantitative,RT-qPCR)法检测2组研究对象胎盘组织和各组HTR-8细胞中lncRNA GHET1 mRNA表达水平使用TRIzol提取胎盘组织和滋养层细胞中总RNA,紫外分光光度计测定所提取RNA的纯度及浓度后,按照PrimeScriptTMRT Master Mix试剂盒说明书进行反转录获得cDNA。RT-qPCR反应条件:95℃预变性30 s,95℃变性10 s,60℃退火/延伸20 s,40个循环。25 μL RT-qPCR反应体 系:引 物10 pmol,2×SYBR ExScript kit试剂10 μL,模板3 μL,ddH2O 10 μL。RT-qPCR引物:lncRNA GHET1,F 5′-CCCCACAAATGAAGACACT-3′,R 5′-TTCCCAACACCCTATAAGAT-3′;GAPDH,F 5′-GTCGGTGTGAACGGATTTG-3′,R 5′-AAGATGGTGATGGGCTTC-3′。以GAPDH为内参,采用2-ΔΔCt法计算2组研究对象胎盘组织和各组HTR-8细胞中lncRNA GHET1mRNA表达水平。
1.8 CCK-8法检测各组HTR-8细胞增殖率HTR-8细胞按每孔5×103个接种于96孔细胞培养板,每组设置5个复孔,分别置于37℃、5%CO2培养箱中培 养12、24和48 h后加入10 μL CCK-8试剂,孵育3 h,于酶标仪450 nm波长处检测各组各时间点的吸光度(A)值。其中以各组0 h时的A值为对照组A值,计算细胞增殖率,实验单独重复3次。细胞增殖率=(实验组A值-对照组A值)/对照组A值×100%。
1.9 流式细胞术检测各组不同细胞周期HTR-8细胞百分率取HTR-8细胞,4℃预冷PBS缓冲液轻轻洗涤,胰蛋白酶常规消化,300 g离心5 min,收集细胞沉淀,500 μL PBS缓冲液重悬细胞后加入-20℃预冷70%乙醇溶液3.5 mL,4℃固定过夜。PBS缓冲液洗涤细胞3次,按照细胞周期流式检测试剂盒说明书方法加入500 μL PI/RNase染色液,4℃避光孵育30 min。采用流式细胞仪分析各组不同细胞周期HTR-8细胞百分率,实验单独重复3次。
1.10 Transwell小室实验检测各组HTR-8细胞侵袭能力常规消化转染后HTR-8细胞,将重悬于不含FBS培养基中各组HTR8细胞按每孔5×104个接种于包被Martrigel基质胶的Transwell小 室 中,Transwell上 室 加 入600 μL含15%FBS常规RPMI-1640培养液。每组设定3个复孔,于37℃、5% CO2恒温培养箱培养24 h。取出上室,PBS缓冲液洗涤2次,湿棉签擦拭小室上层未穿出细胞,4%多聚甲醛室温下固定15 min,0.1%结晶紫染色30 min,PBS缓冲液洗涤2次,光学显微镜下随机选取5个视野观察,并计算侵袭细胞数,代表细胞侵袭能力。上述实验单独重复3次。
1.11 Western blotting法检测各组HTR-8细胞中c-Myc、cyclinD1、GSK3β、p-GSK3β、E-cadherin、Vimentin和β-catenin蛋白表达水平采用RIPA裂解液、蛋白酶和磷酸酶抑制剂提取各组HTR-8细胞总蛋白。BCA法蛋白定量后,每组取约40 μg蛋白样品于SDS聚丙烯酰胺凝胶电泳,随后转移至聚偏氟乙烯膜上。室温下,5%脱脂奶粉封闭1 h,4℃抗体孵育过夜,包括E-cadherin(1∶1 000)、Vimentin(1∶1 000)、GSK3β(1∶800)、p-GSK3β(1∶800)、β-catenin(1∶1 000)、c-Myc(1∶800)、cyclinD1(1∶800)和GAPDH(1∶2 000)。次日,室温下用过氧化物酶标记的山羊抗兔二抗(稀释1∶5 000)孵育1 h。滴加增强化学发光液,采用凝胶成像系统曝光拍照,采用Image J软件分析蛋白条带灰度值,实验单独重复3次。以GAPDH为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.12 统计学分析采用GraphPad Prism 5.0统计软件进行统计学分析。2组研究对象年龄、分娩孕周、体质量指数(body mass index,BMI)、血压、24 h尿蛋白、胎盘质量和新生儿体质量及胎盘组织中lncRNA GHET1 mRNA表达水平,各组HTR-8细胞中lncRNA GHET1 mRNA表达水平、细胞增殖率、不同细胞周期细胞百分率、侵袭细胞数及各组HTR-8细 胞 中c-Myc、cyclinD1、E-cadherin、Vimentin和β-catenin蛋 白 表 达 水 平 及p-GSK3β/GSK3β比值均符合正态分布,以±s表示,2组间样本均数比较采用配对样本t检验,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 2组研究对象临床资料正常组与PE组孕产妇 的 临 床 资 料 中 年 龄 [(30.31±3.06) 和(27.89±4.11)岁]、孕周[(37.12±0.40)和(35.26±0.81)周)、产前BMI[(22.19±1.30)和(23.11±0.84)kg·m-2]、新 生 儿 体 质 量[(2 930.67±554.83)和(2 670.02±689.77)g]比较差异均无统计学意义(P>0.05)。与正常组比 较,PE组患者 收缩压[(112.33±2.58)和(156.10±7.09)mmHg]、舒 张 压[(74.03±3.28)和(94.22±1.01)mmHg]及24 h尿蛋白水 平[(0.00±0.00)和(0.48±0.17)g·L-1]均明显升高(P<0.01),胎盘质量[(525.17±63.30) 和 (410.73±59.10)g] 明 显 降 低(P<0.01)。
2.2 2组研究对象胎盘组织病理形态表现HE染色结果显示:正常组胎盘组织绒毛发育良好,绒毛内血管密度丰富,可见少量钙化灶和合体结节。与正常组比较,PE组胎盘组织的绒毛发育不良,数量减少,绒毛内及间质血管分布紊乱,血管壁出现纤维素样坏死,钙化区域及绒毛上的合体结节增加。见图1。
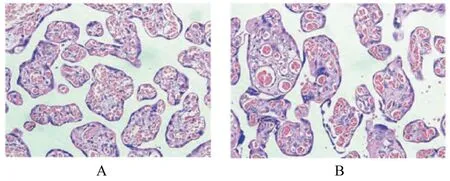
图1 2组研究对象胎盘组织病理形态表现(HE,×200)Fig.1 Pathomorphology of placenta tissue of subjects in two groups(HE,×200)
2.3 2组研究对象胎盘组织和各组HTR-8细胞中lncRNA GHET1 mRNA表达水平RT-qPCR结 果显示:与正常组比较,PE组患者胎盘组织中lncRNA GHET1 mRNA表达水平明显降低(P<0.05)。见图2。与对照组比较,GHET1组HTR-8细胞中lncRNA GHET1 mRNA表达水平明显升高(P<0.01),阴性对照组上述指标差异无统计学意义(P>0.05)。见图3。

图2 2组研究对象胎盘组织中lncRNA GHET1 mRNA表达水平Fig.2 Expression levels of lncRNA GHET1 mRNA in placenta tissue of subjects in two groups
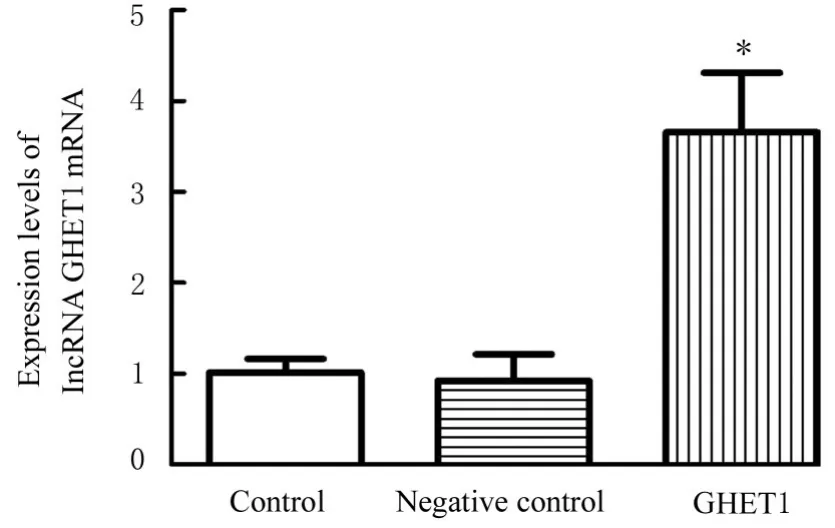
图3 各组HTR-8细胞中lncRNA GHET1 mRNA表达水平Fig.3 Expression levels of lncRNA GHET1 mRNA in HTR-8 cells in various groups
2.4 各组HTR-8细胞增殖率CCK-8法检测结果显示:与对照组比较,培养24和48 h时GHET1组HTR-8细胞增殖率明显升高(P<0.05),阴性对照组上述指标差异无统计学意义(P>0.05)。见图4。

图4 CCK-8法检测各组HTR-8细胞增殖率Fig.4 Proliferation rates of HTR-8 cells in various groups detected by CCK-8 method
2.5 各组不同细胞周期HTR-8细胞百分率流式细胞术检测结果显示:与对照组比较,GHET1组HTR-8细胞中G1期细胞百分率明显降低(P<0.05),S期细胞百分率明显升高(P<0.05),阴性对照组上述指标差异无统计学意义(P>0.05)。见图5。
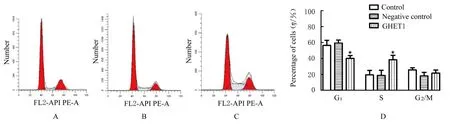
图5 流式细胞术检测各组不同细胞周期HTR-8细胞百分率Fig.5 Percentages of HTR-8 cells at different cell cycles in various groups detected by flow cytometry
2.6 各组HTR-8细胞侵袭能力Transwell小室实验结果显示:与对照组(102个±11个)比较,GHET1组HTR-8细胞中侵袭细胞数(114个±27个)明显升高(P<0.05),阴性对照组侵袭细胞数(97个±19个)差异无统计学意义(P>0.05)。见图6。

图6 Transwell小室实验检测各组HTR-8细胞侵袭情况(结晶紫,×100)Fig.6 Invasion of HTR-8 cells in various groups detected by Transwell chamber experiment(Crystal violet,×100)
2.7 各组HTR-8细胞中c-Myc、cyclinD1、E-cadherin、Vimentin和β-catenin蛋白表达水平及p-GSK3β/GSK3β比值Western blotting法检测结果显示:与对照组细胞比较,GHET1组HTR-8细胞中c-Myc、cyclinD1蛋白表达水平均明显降低(P<0.05),阴性对照组HTR-8细胞中c-Myc和cyclinD1蛋白表达水平差异无统计学意义(P>0.05)。见 图7。与 对 照 组 比 较,GHET1组HTR-8细 胞 中E-cadherin蛋白表达水平明显降低(P<0.05),Vimentin蛋白表达水平明显升高(P<0.05);阴性对照上述指标差异无统计学意义(P>0.05)。见图8。与对照组比较,GHET1组HTR-8细胞中 β-catenin蛋白表达水平和p-GSK3β/GSK3β比 值 均 明 显 升 高(P<0.05),阴性对照组上述指标差异无统计学意义(P>0.05)。见图9。
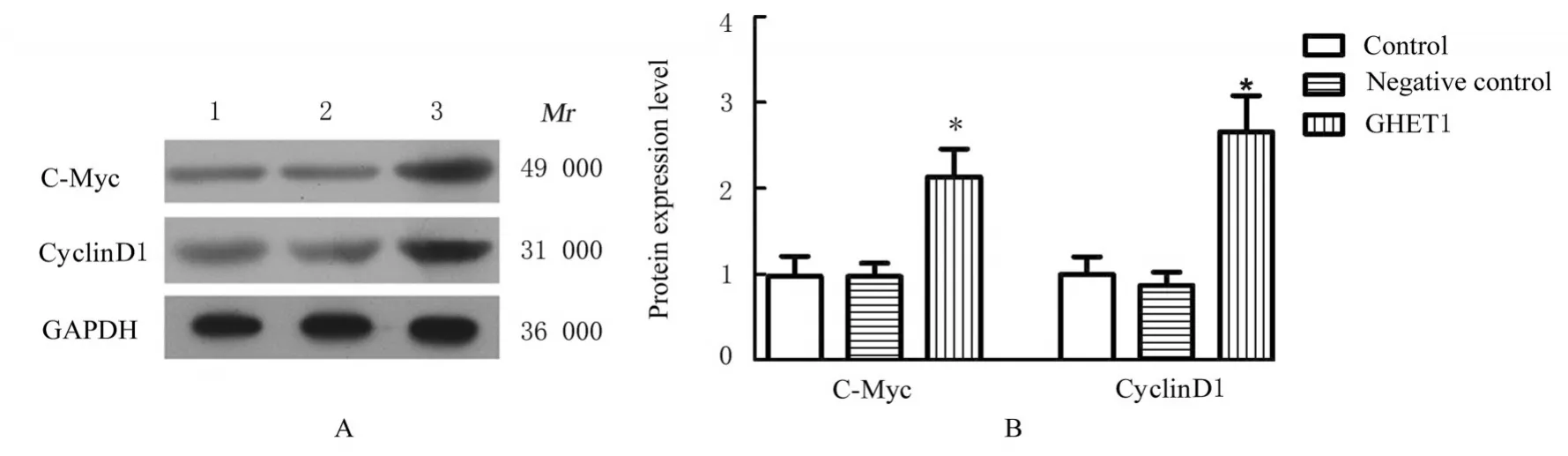
图7 Western blotting法检测各组HTR-8细胞中细胞周期相关蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram(A)and histogram(B)of expressions of cell cycle-related proteins in HTR-8 cells in various groups detected by Western blotting method
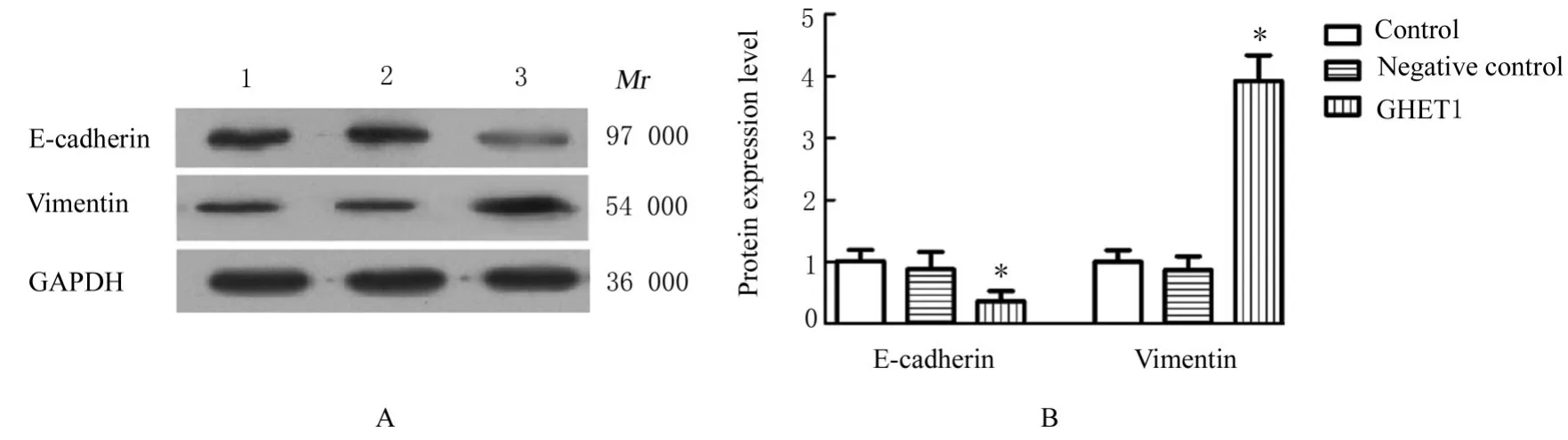
图8 Western blotting法检测各组HTR-8细胞中EMT相关蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram(A)and histogram(B)of expressions of EMT-related proteins in HTR-8 cells in various groups detected by Western blotting method
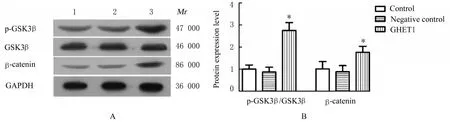
图9 Western blotting法检测各组HTR-8细胞中Wnt/β-catenin信号通路相关蛋白表达电泳图(A)和直条图(B)Fig.9 Electrophoregram(A)and histogram(B)of expressions of Wnt/β-catenin signaling pathway-related proteins in HTR-8 cells in various groups detected by Western blotting method
3 讨 论
胎盘结构和功能异常导致的胎盘组织灌注减少是PE患者胎盘组织最明显的病理特征,而滋养层细胞作为胎盘组织和功能维持的主要细胞,其对胎盘 组 织 的 发 育 和 形 成 具 有 重 要 作 用[1-2]。研 究[3,6]显示:在PE表达失调的lncRNA可通过调控滋养层细胞功能而参与影响PE的发生发展。本研究结果表明:过表达lncRNA GHET1可能通过Wnt/β-catenin信号通路促进细胞增殖、细胞周期进展和细胞侵袭,具有改善PE发生进展的作用。
LncRNA GHET1被认为是胃癌特异性lncRNA之一,研究[4]显示:lncRNA GHET1作为一种新型的致癌lncRNA,广泛参与促进包括胃癌、肝癌、前列腺癌和骨肉瘤等多种肿瘤的发生发展。在胃癌中,利用小干扰RNA下调肿瘤细胞中lncRNA GHET1表达能通过降低细胞周期调节因子c-Myc、cyclinD1和周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)等蛋白表达水平,诱导胃癌细胞阻滞于G1期,并抑制其增殖、迁移和侵袭能力[7-8]。在肝癌中,高表达的lncRNA GHET1能够通过靶向调控激活转录因子1 mRNA和蛋白表达水平促进肝癌细胞的增殖、迁移、侵袭和EMT[9]。在骨肉瘤中,敲除lncRNA GHET1能通过下调Wnt/β-catenin信号通路减弱肿瘤细胞增殖、迁移和EMT能力,并促进细胞凋亡[10]。而滋养层细胞作为一种类似肿瘤细胞的特殊类型细胞,与肿瘤细胞具有一定程度的相似性。研究[11]表明:滋养层细胞的EMT能力是其对蜕膜组织及子宫侵袭的基础。EMT是细胞表型的一种转化过程,其主要表现为表皮细胞标记物黏附分子E-cadherin表达降低和间质细胞标记物N-钙黏蛋白(N-cadherin)和Vimentin等表达上调。在EMT过程中细胞骨架重组,细胞间黏附能力降低,细胞极性丧失[12]。在滋养层细胞上表现为E-cadherin蛋白表达水平降低和Vimentin蛋白表达水平升高,即细胞出现EMT转化[13-14],其有利于胚胎成功着床和胚胎的正常形成。本研究结果显示:PE组患者胎盘组织中lncRNA GHET1表达水平较正常组明显降低,过表达lncRNA GHET1能够明显促进滋养层HTR-8细胞侵袭和EMT能力,与LI等[15]的研究结果一致,提示lncRNA GHET1能够促进滋养层细胞侵袭能力。研究[16-17]证实:PE患者胎盘组织异常可能与滋养层细胞增殖和细胞周期阻滞有关。因此,本研究进一步探究lncRNA GHET1对滋养层细胞增殖活性的影响,结果显示:过表达lncRNA GHET1可通过上调细胞周期相关蛋白c-Myc与cyclinD1表达,促进细胞周期的进展及增殖活性,与其在胃癌细胞中的作用类似[7-8]。
Wnt/β-catenin信号通路是调节细胞生存、发育、增殖及和凋亡等生物学过程的重要途径,也是参与影响多个器官或系统形成的重要机制[18-19]。国内学者李慧等[20]研究发现:Wnt/β-catenin信号通路的失活导致滋养层细胞侵袭和增殖能力减弱。ZHANG等[21]研究证实:与正常胎盘组织比较,PE患者胎盘组织中Wnt/β-catenin信号通路种相关蛋 白p-GSK3β、β-catenin、c-Myc和cyclinD1 mRNA和蛋白表达水平均明显降低,提示Wnt/β-catenin信号通路参与PE的进展。此外,lncRNA GHET1同 样 也能通 过Wnt/β-catenin信 号通路调控肿瘤细胞增殖和侵袭等恶性生物学行为[10,22]。因此,本研 究检测Wnt/β-catenin信号通路相关蛋白表达结果显示:过表达lncRNA GHET1能上调GSK3β磷酸化水平和β-catenin蛋白表达水平。
综上所述,lncRNA GHET1在PE患者胎盘组织中表达较正常孕产妇明显下调,过表达lncRNA GHET1可能通过Wnt/β-catenin信号通路来促进滋养层细胞增殖、细胞周期进展、细胞侵袭和EMT能力。
