免疫检查点TIGIT慢病毒表达载体的构建和稳定表达TIGIT细胞系的建立
2022-10-18穆业腾胡楠楠杨馥旭范宇鑫郭峰霖关新刚
穆业腾,郭 冲,胡楠楠,杨馥旭,薛 晗,范宇鑫,郭峰霖,关新刚,2
(1.北华大学医学技术学院医药生物工程重点实验室,吉林 吉林 132013;2.台州学院医学院基础医学系,浙江 台州 318000)
免疫检查点是一类在免疫细胞上表达的负性调控分子,免疫检查点分子主要包括细胞毒性T淋巴细 胞 抗 原4(cytotoxic T lymphocyte antigen 4,CTLA4)、程序性死亡受体1(programmed cell death 1,PD-1)、信号调节蛋白α(signal regulatory protein-α,SIRPα)、T细 胞 免 疫 球 蛋 白3(T cell immunoglobulin domain and mucin domain-3,TIM-3)、淋 巴 细 胞 激 活 基 因3(lymphocyte activation gene 3,LAG-3)和T细胞免疫球蛋白和免疫受体酪氨酸抑制基序结构域(T cell immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain,TIGIT)等[1-7]。肿瘤细胞通过表达检查点配体分子与免疫细胞上的检查点结合,诱导T细胞功能失调或衰竭,从而逃避免疫系统的攻击。研究者[8-9]在对含有免疫受体酪氨酸抑制基序(immunoreceptor tyrosin-based inhibitory motif,ITIM)的T细胞进行基因组筛选时发现了TIGIT(也称为Vsig9、Vstm3或WUCAM),其为CD28蛋白家族中的成员。TIGIT由1个胞外免疫球蛋白结构域、1个Ⅰ型跨膜区和1个胞内ITIM结构域组成,主要在NK细胞和T细胞上表达,尤其是在记忆T细胞、滤泡辅助性T细胞和Treg细胞上表达[10-13]。在肿瘤微环境中,TIGIT在肿瘤浸润淋巴细胞中的表达上调,作为抑制性受体参与诱导免疫细胞衰竭,在抑制CD8+T淋巴细胞依赖的抗肿瘤反应中发挥重要作用[14-16]。
TIGIT通过参与复杂的免疫调控在先天性免疫和适应性免疫中发挥重要作用,目前报道的配体主要有CD155、CD112、CD113和nectin-4,其中对CD155的研究最为深入[17-18]。肿瘤细胞表面高表达的CD155与TIGIT结合后,会抑制免疫细胞对肿瘤的杀伤作用[19]。TIGIT与共刺激受体CD226均可竞争性结合CD155,但其对CD155的亲和力高于CD226[20]。研究[21-22]显示:选择性阻断TIGIT/CD155信号轴正成为一种有前景的肿瘤免疫治疗策略,利用单克隆抗体阻断TIGIT可逆转细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)诱导的免疫细胞衰竭并抑制肿瘤生长。迄今 为 止, 已 有Ociperlimab、Tiragolumab、Domvanalimab、Vibostolimab、EOS-448和BMS-986207等多种TIGIT抗体进入临床Ⅱ/Ⅲ期实验,其中由基因泰克公司开发的Tiragolumab于2021年1月获得美国FDA授予的突破性疗法认定[23]。为深入研究TIGIT蛋白参与肿瘤免疫逃逸机理及以其为靶点的免疫治疗药物研发,本研究通过构建TIGIT-绿色荧光蛋白(green fluorescent protein,GFP)慢病毒表达载体及建立稳定表达TIGITGFP的细胞系,为后续研究以TIGIT为靶点的免疫治疗奠定理论基础。
1 材料与方法
1.1 细胞、主要试剂和仪器人胚胎肾HEK293T细胞为北华大学医学技术学院医药生物工程重点实验室冻存。胎牛血清购自杭州四季青生物工程材料公司,培养基购自美国Hyclone公司,pLenti-CmGFP质粒和pCMV6-TIGIT质粒购自美国Origene公司,EcoRⅠ和NotⅠ限制性内切酶购自日本TaKaRa公司,T4 DNA连接酶购自美国NEB公司,质粒提取试剂盒和凝胶回收试剂盒购自美国Axyprep公司,Lipofectamine 3 000转染试剂购自美国Invitrogen公司,TIGIT抗体购自英国Abcam公司,辣根过氧化物酶标记山羊抗兔IgG(H+L)和显色底物购自武汉爱博泰克生物科技有限公司。核酸电泳系统、蛋白电泳和转膜系统及凝胶成像系统均购自美国Bio-Rad公司,细胞计数仪购自美国Denovix公司,可视荧光倒置显微镜购自美国Thermo Fisher公司,全自动多功能酶标仪购自瑞士TECAN公司。
1.2 TIGIT慢病毒表达载体的构建取测序正确的pCMV6-TIGIT质粒和表达载体pLenti-C-mGFP各2 μL加入至含限制性内切酶EcoRⅠ和NotⅠ的酶切体系中,37℃酶切4 h,采用0.8%琼脂糖凝胶电泳对相关片段进行分离并回收,洗脱出目的片段,加入T4 DNA连接酶25℃水浴连接1 h获得重组质粒pLenti-TIGIT-GFP,转化至DH5α感受态细胞,接种至含氨苄青霉素的LB平板培养基中,培养过夜。挑取单个菌落于LB管中,170 r·min-1摇床过夜,通过质粒提取和双酶切鉴定,将双酶切成功的质粒送至生工生物工程(上海)股份有限公司进行测序。
1.3 筛选和建立TIGIT稳定转染细胞系将重组质粒pLenti-TIGIT-GFP转染入HEK293T细胞,经有限稀释法筛选获得稳定表达TIGIT-GFP的HEK293T细胞系。转染前1 d,将生长状态良好的HEK293T细胞铺于6孔细胞培养板中,每孔细胞约1.0×106个。第2天细胞汇合度至70%~90%时更换基础培养基,并加入含Lipofectamine 3 000及TIGIT质粒的Opti-MEM混合溶液,5 h后置于荧光显微镜下观察,可见部分细胞有GFP表达,继续培养至48 h,观察TIGIT-GFP表达及细胞膜定位情况。为获取稳定表达TIGIT-GFP的HEK293T细胞系,将转染后的细胞接种于10 cm培养皿中加入嘌呤霉素(8 mg·L-1)筛选,采用有限稀释法获取均一表达的单克隆细胞。将初步筛选的细胞消化并通过细胞计数仪计数后制备密度为1×105mL-1的细胞悬液,8倍稀释后接种至96孔细胞培养板。培养7~10 d后,选取阳性克隆孔再次克隆,重复2~3次,获得稳定表达TIGIT的单克隆稳定细胞系。
1.4 Western blotting法检测细胞中TIGIT-GFP蛋白表达通过有限稀释法获取4个单克隆细胞,分别铺至6孔细胞培养板中,细胞密度达80%~90%时,将细胞置于冰上,PBS缓冲液洗涤2次,每孔加入200 μL RIPA裂解液裂解60 min,期间每隔10 min混匀1次,离心收集上清,BCA蛋白定量后,加入适量Loading Buffer 100℃水浴10 min。取20 μL蛋白上样,经12%SDS-PAGE凝胶分离,半干法转移至PVDF膜上。采用封闭液(5 %脱脂奶粉)室 温 封 闭2 h后,分 别 加 入β-actin一 抗(1∶2 000)和TIGIT一抗(1∶1 000),4℃摇床过夜。次日PVDF膜经TBST洗脱3次后加入辣根过氧化物酶标记的二抗(1∶2 000),室温摇床孵育2 h,再次洗脱3次,将显影液覆盖至PVDF膜上,采用凝胶成像系统显影成像。由于TIGIT和GFP蛋白的相对分子质量均为27 000,若在相对分子质量54 000附近出现特异性条带则提示TIGIT-GFP融合蛋白表达成功。
2 结 果
2.1 慢病毒表达载体pLenti-TIGIT-GFP构建pCMV6-TIGIT质粒双酶切后可见长度约为726 bp的片段,pLenti-C-mGFP质粒双酶切后可见长度约为867 bp的片段(图1)。将切胶回收的载体片段和目的片段连接形成重组质粒,转化至DH5α感受态细胞,挑菌过夜,提取质粒后采用EcoRⅠ和NotⅠ双酶切,琼脂糖凝胶电泳可见2条清晰条带,其中一条长度为7 800 bp与载体片段相符,另一条长度为726 bp与目的基因相符(图2),表明可能构建出重组质粒pLenti-TIGIT-GFP。
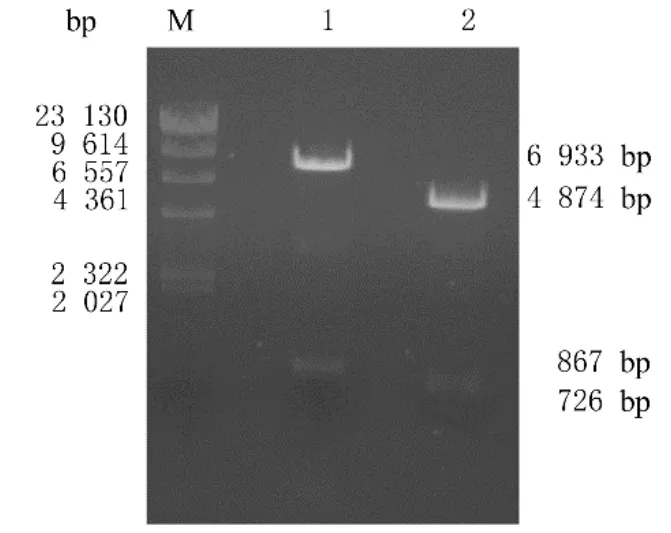
图1 慢病毒表达载体pLenti-C-mGFP和TIGIT质粒pCMV6-TIGIT双酶切结果Fig.1 Double digestion results of lentiviral expression vector pLenti-C-mGFP and TIGIT plasmid pCMV6-TIGIT
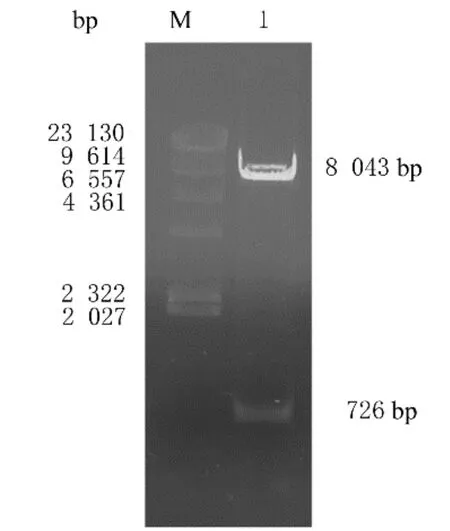
图2 慢病毒表达载体pLenti-TIGIT-GFP双酶切鉴定Fig.2 Double digestion identification of lentiviral expression vector pLenti-TIGIT-GFP
2.2 慢病毒表达载体pLenti-TIGIT-GFP测序鉴定重组质粒pLenti-TIGIT-GFP的DNA测序分析结果显示:TIGIT基因成功插入到表达载体pLenti-C-mGFP中EcoRⅠ位点(GAATTC),提示重组质粒pLenti-TIGIT-GFP构建成功。见图3。
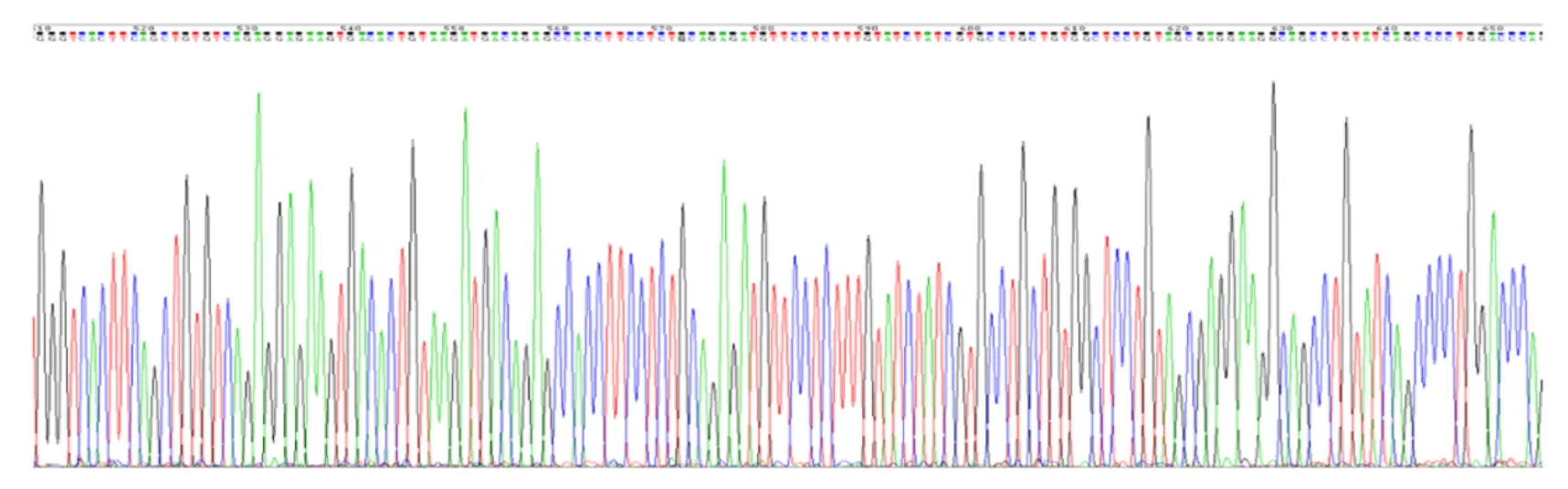
图3 重组质粒pLenti-TIGIT-GFP的DNA测序结果Fig.3 DNA sequencing results of recombinant plasmid pLenti-TIGIT-GFP
2.3 荧光显微镜观察TIGIT-GFP蛋白细胞定位构建成功的重组质粒转染至HEK293T细胞中,48 h后荧光显微镜下可观察到细胞上有GFP表达,GFP主要分布在HEK293T细胞膜上(图4),提示TIGIT-GFP在HEK293T细胞的细胞膜上成功表达。
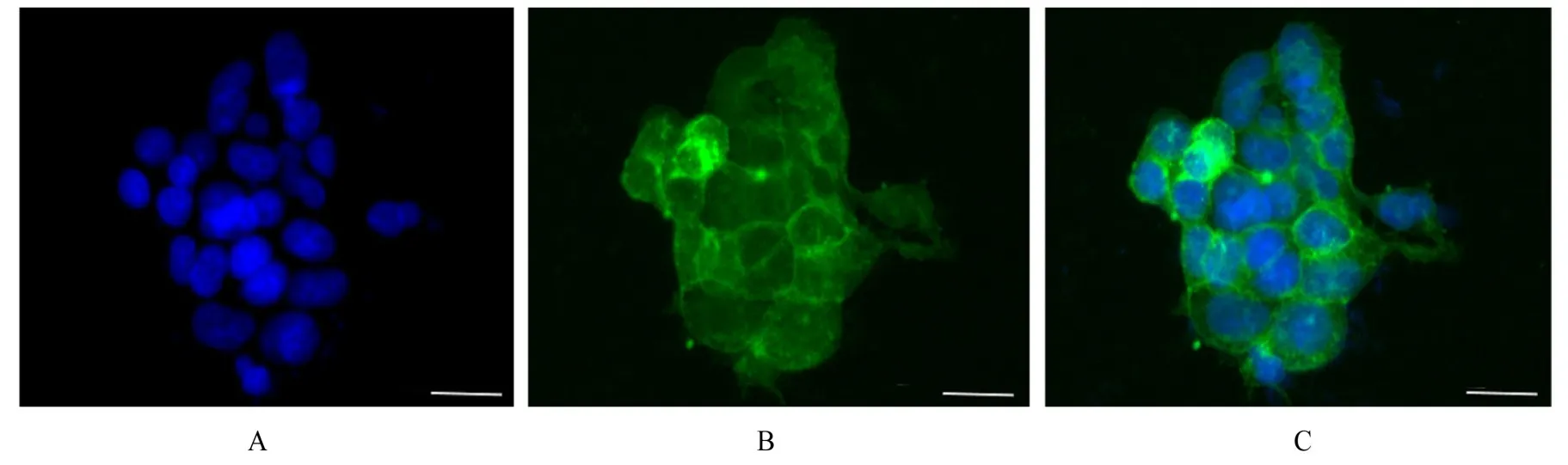
图4 荧光显微镜观察稳定转染pLenti-TIGIT-GFP质粒的HEK293T细胞中TIGIT-GFP的表达(Bar=20 μm)Fig.4 Expression of TIGIT-GFP in HEK293T cells stably transfected with pLenti-TIGIT-GFP observed by fluorescence microscope(Bar=20 μm)
2.4 稳定表达TIGIT-GFP细胞系建立由于外源基因整合到HEK293T细胞的效率不同,导致每个细胞TIGIT-GFP的表达量存在差异。筛选稳定表达TIGIT-GFP的单克隆细胞后,观察到单个孔中有细胞排列紧密、呈集落生长的单个克隆团。经过2次有限稀释单克隆筛选后,共得到4个绿色荧光相对较亮的单克隆细胞。见图5。
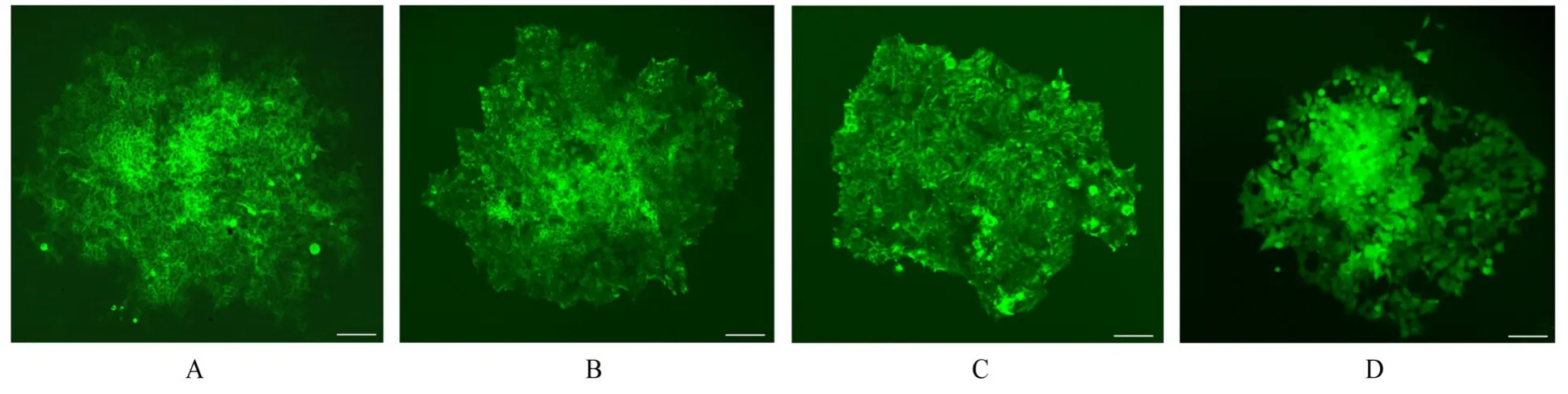
图5 TIGIT-GFP单克隆细胞的绿色荧光成像(Bar=100 μm)Fig.5 Green fluorescence images of TIGIT-GFP monoclonal cells(Bar=100 μm)
2.5 HEK293T细胞中TIGIT-GFP蛋白表达情况Western blotting检 测 结 果 显 示:对 照 组HEK293T细胞中未见TIGIT-GFP蛋白表达,实验组HEK293T细胞中TIGIT-GFP蛋白表达为阳性,表明经转染筛选后,TIGIT-GFP在HEK293T细胞中成功表达。见图6。
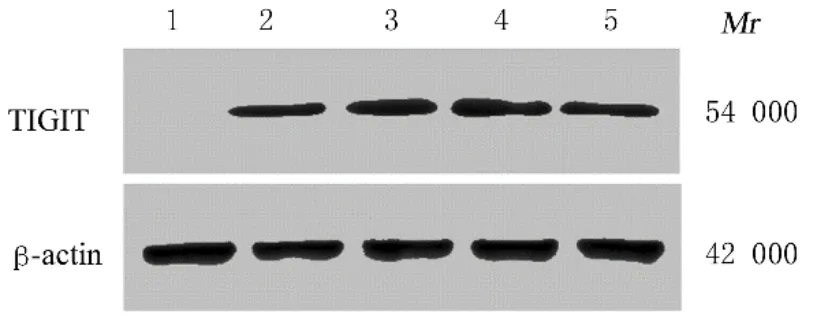
图6 Western blotting法检测2组HEK293T细胞中TIGIT-GFP蛋白表达电泳图Fig.6 Electrophoregram of expression of TIGITGFP protein in HEK293 cells in two groups detected by Western blotting method
3 讨 论
近年来,基于免疫检查点抑制剂的肿瘤免疫疗法取得了较大成功。肿瘤发生发展过程中,肿瘤细胞通过表达检查点的配体分子诱导免疫细胞沉默,逃避免疫系统的清除[24]。免疫检查点抑制剂阻断检查点介导的抑制性信号通路,恢复衰竭T细胞功能,高效杀伤肿瘤细胞[25]。临床数据[26]显示:当前免疫检查点疗法正面临着诸多难题,有一部分患者并未从抗PD-1、程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1) 和CTLA4抗体中获益,因此应开发新的检查点抑制剂用于改善癌症患者免疫治疗效果。
TIGIT作为一种新近发现的免疫检查点分子,在多种肿瘤中异常表达,与肿瘤进展和患者的预后密切相关[27-28]。TIGIT基因敲除小鼠实验[29]表明:体内敲除TIGIT基因可引发比抗PD-1或抗CTLA4单克隆抗体更少的免疫相关不良事件(immune-related adverse events,irAEs)。鉴 于TIGIT单独阻断可观的临床效果,将其与多种免疫检查点抑制剂[如PD-1、T细胞免疫球蛋白黏蛋 白3(T cell immunoglobulin domain and mucin domain-3,TIM-3)和CTLA4等]联合使用同时靶 向 肿 瘤 微 环 境 (tumor micro-environment,TME)中的多条免疫抑制通路,协同逆转免疫沉默,实现肿瘤多靶点协同增效治疗,从而达到改善癌症免疫治疗的目的[30-32]。
综上所述,本研究成功构建TIGIT-GFP慢病毒表达载体并制备稳定表达TIGIT-GFP的人胚胎肾HEK293T细胞系,为深入了解免疫检查点TIGIT蛋白参与肿瘤免疫逃逸机理及以其为靶点的免疫治疗研究奠定基础。
