内镜辅助前哨淋巴结活检在早期乳腺癌中的临床效果评价
2022-10-18于金玲高蓓敏王浩峰沈卫达
于金玲,高蓓敏,崔 静,王浩峰,沈卫达
(上海市长宁区妇幼保健院乳腺科,上海,200050)
1993年Krag将前哨淋巴结概念引入乳腺癌的外科治疗领域,开创了乳腺癌前哨淋巴结检测的先河[1]。经过十余年的发展,乳腺癌前哨淋巴结活检术逐步成熟,可安全有效地进行腋窝淋巴结病理学状态评估[2]。乳腺癌前哨淋巴结活检可提供准确的腋窝淋巴结分期,前哨淋巴结阴性的患者可避免腋窝淋巴结清扫[3]。乳腺癌手术诊疗中保留腋窝功能兼具美观,已成为国内外专家学者探索的热点。目前,内窥镜下前哨淋巴结活检已成为乳腺外科医生新的探索方向,在国内三级甲等医院已逐渐开展[4],但该技术需要一定的手术条件,对术者有较高的操作要求,需要比较长的学习曲线,尚无法在基层医院广泛开展。笔者在临床实践中发现,相较完全腔镜下乳腺癌前哨淋巴结活检,小切口内镜辅助下前哨淋巴结活检可大大降低手术难度,比较容易在基层医院实施。但该术式是否较传统手术有优越性,尚无研究资料支持。因此,本文对2020年1月至2021年12月临床诊断腋窝淋巴结阴性的60例早期乳腺癌患者分别施行小切口内镜辅助下前哨淋巴结活检术与传统手术,通过比较两种手术的效果,探讨其临床应用价值。
1 资料与方法
1.1 临床资料 选取早期乳腺癌患者60例,按入院顺序,以随机数字表法分为内镜辅助组与传统组,每组30例,分别行小切口联合内镜辅助下乳腺癌前哨淋巴结活检与传统手术。患者均为女性,且为单侧原发性乳腺癌。两组患者一般资料差异无统计学意义(P>0.05),具有可比性,见表1。患者均获得知情同意并签署知情同意书。
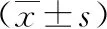
表1 两组患者一般情况的比较
1.2 纳入与排除标准 纳入标准:根据乳腺癌分期系统美国癌症联合委员会第八版TNM分期标准,临床分期为cT1~2N0M0的乳腺癌患者;无放疗及化疗史;对亚甲蓝无过敏。排除标准:炎性乳腺癌或临床穿刺活检证实腋窝淋巴结转移;怀孕期及哺乳期;有腋窝手术史。
1.3 手术方法 内镜辅助下前哨淋巴结活检术[5]:患者取平卧位,患侧上肢外展内旋位,全麻成功后,首先进行染料注射,使用1 mL注射器抽取亚甲蓝染色剂,于乳晕外上选取3个部位进行皮内注射形成皮丘,注射总量为1 mL;10~15 min后于腋下沿皮纹方向做2.5~3 cm小切口,切口位置位于腋窝自然皮纹皱褶下2~3 cm,内侧不能超过胸大肌外侧缘,外侧不能超过背阔肌前缘。切开真皮层,暴露表浅淋巴结管,向腋窝方向分离至浅筋膜浅层,分离至深部时用巾钳悬吊固定皮瓣建腔,助手持直径5 mm内镜显露淋巴管,操作者用腹腔镜电剪循蓝染的淋巴管方向仔细分离,分离过程中注意保护蓝染的淋巴管,避免离断后污染手术野,造成再次寻找困难。找到蓝染的淋巴结后,完整切除蓝染的前哨淋巴结及淋巴管。术中送冰冻病理组织学检查。传统手术:体位及麻醉同内镜辅助组,腋下沿皮纹做5~6 cm切口,根据亚甲蓝染色示踪的蓝染淋巴管,血管钳钝性分离及电刀锐性分离,切除蓝染的前哨淋巴结并送检。术后于术野常规放置一次性引流管,外接负压引流球。如前哨淋巴结存在肿瘤转移或前哨淋巴结活检失败,则行腋窝淋巴结清扫术;前哨淋巴结阴性的患者不接受进一步的腋窝淋巴结清扫。
1.4 观察指标及评价标准
1.4.1 手术相关指标 前哨淋巴结清扫数量及病理结果、手术时间、术中出血量、术后引流量、并发症等。疼痛指标:术后第1天、第3天采用视觉模拟评分法(visual analogue score,VAS)进行疼痛评估[6]。美容满意度指标:术后第3个月采用5级评价法评估患者对切口的美容满意度[7]。
1.4.2 前哨淋巴结检测技术的评价方法 前哨淋巴结检测技术采用美国Louisville大学标准:(1)检出率=前哨淋巴结检出例数/实施前哨淋巴结检测所有例数×100%;(2)敏感度=前哨淋巴结转移阳性例数/腋窝淋巴结转移阳性例数×100%;(3)准确率=(前哨淋巴结转移真阳性+真阴性例数)/前哨淋巴结活检总例数×100%;(4)假阴性率=前哨淋巴结假阴性例数/腋窝淋巴结转移阳性例数×100%。
2 结 果
2.1 前哨淋巴结清扫情况及病理结果 将手术获得的前哨淋巴结术中常规冰冻切片苏木精-伊红染色检查,与最终石蜡切片病理检查结果对照。传统组前哨淋巴结活检成功27例,共检出88枚,平均检出(3.26±0.81)枚。石蜡病理及免疫组化确诊阳性7例,其中6例为术中冰冻病理诊断为转移,1例术中冰冻未确诊,术后石蜡及免疫组化确诊为前哨淋巴结微转移。内镜辅助组前哨淋巴结活检成功29例,共检出95枚,平均检出(3.28±0.80)枚。石蜡病理及免疫组化确诊阳性8例,其中7例为术中冰冻病理诊断明确转移,1例术中冰冻未确诊,术后石蜡及免疫组化确诊为前哨淋巴结转移。两组前哨淋巴结检出率、假阴性率、准确率、敏感度差异均无统计学意义(P>0.05),见表2。
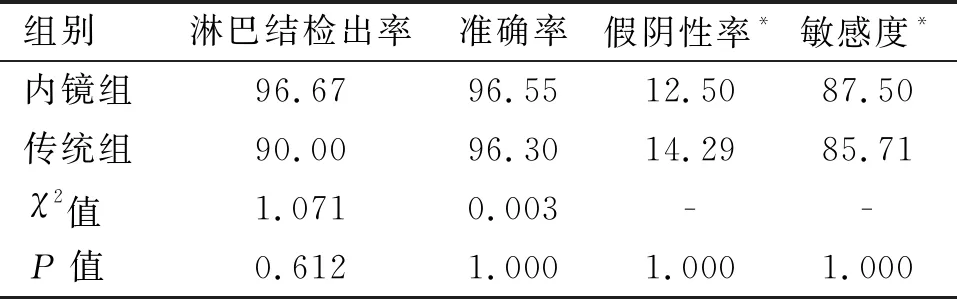
表2 两组患者前哨淋巴结清扫情况的比较(%)
2.2 手术一般情况的比较 两组手术均成功完成,内镜组无手术中转情况发生。两组引流时间差异无统计学意义(P=0.545),内镜组手术时间、术中出血量、术后引流量少于传统组(P<0.05),见表3。术后3个月随访,两组均未发生皮瓣坏死、皮下积液、腋窝功能障碍、感觉异常、上肢淋巴结水肿等并发症。
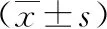
表3 两组患者术中、术后情况的比较
2.3 VAS疼痛评分 术后第1天,内镜组VAS疼痛评分低于传统组(P<0.001),第3天,两组VAS评分差异无统计学意义(P=0.057),见表4。两组均未出现上臂内侧麻木不适感,无因疼痛影响睡眠或使用镇痛剂情况。
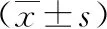
表4 两组患者术后VAS疼痛评分的比较
2.4 美容满意度 术后3个月随访,两组术后美容满意度差异有统计学意义(P=0.003),见表5,内镜组优于传统组。
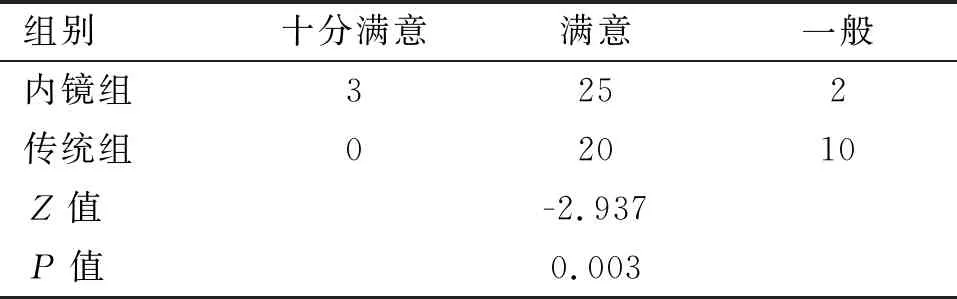
表5 两组患者术后3个月美观满意度的比较(n)
3 讨 论
目前,前哨淋巴结活检已成为预测腋窝淋巴结病理学状态的标准手术评估手段[8],前哨淋巴结活检可作为判断与评价乳腺癌侵犯腋窝淋巴结的金标准[5]。前哨淋巴结阴性的患者可避免行腋窝淋巴结清扫,减少了乳腺癌腋窝淋巴结清扫术后的感觉异常、疼痛综合征、上肢水肿等并发症[9],大大提高了患者的生活质量。然而,传统前哨淋巴结清扫术切口大、费时且不美观。近年,腔镜下前哨淋巴结活检在国内三级医院逐渐得到开展。与传统手术相比,其术后美容效果毋庸置疑。尽管经历了近20年的发展,腔镜技术在乳腺癌手术中的应用越来越多[10],但由于技术难度较高,学习曲线长,需要昂贵的手术设备,临床实践中仍较难普及,国内外开展的医院并不多,尤其基层医院,尚难以推广。尽管多数研究认为,腔镜下前哨淋巴结活检与腋窝淋巴结清扫安全、可行[11-12],但仍有学者提出质疑。Kocher等[13]认为,腔镜下前哨淋巴结活检与腋窝淋巴结清扫可能增加癌细胞在Trocar切口处转移与种植的风险。笔者研究发现,内镜辅助前哨淋巴结活检在临床中比较容易操作,可规避上述问题的潜在风险,弥补传统开放手术的不足,相较传统手术,具有更多的优越性,值得在临床推广。
美国癌症联合委员会认为,乳腺癌前哨淋巴结检出数量<6枚才可被定义为前哨淋巴结[14]。王子函等[15]在一项研究中进行前哨淋巴结活检,检出率分别为100.0%、95.0%、100%,前哨淋巴结检出数量平均3~5枚。中国早期乳腺癌前哨淋巴结活检手术临床实践指南(2022版)[5]推荐,亚甲蓝等可用于早期乳腺癌前哨淋巴结活检术,可在临床合理使用。本研究采用亚甲蓝示踪前哨淋巴结活检,内镜辅助组检出率为96.67%,平均检出淋巴结(3.28±0.80)枚;传统组检出率为90%,平均检出前哨淋巴结(3.26±0.81)枚。两组前哨淋巴结检出率差异无统计学意义,检出率与文献报道相似。本研究中前哨淋巴结评价采用快速术中冰冻切片病理学检查,术后评价采用石蜡连续切片及免疫组织化学检查,结果表明,两组前哨淋巴结活检的假阴性率、准确率、敏感度差异均无统计学意义,提示内镜辅助组前哨淋巴结活检质量可达到传统手术的效果。
在手术时间方面,内镜辅助组平均(24.53±2.42)min,传统组平均(32.23±3.93)min,两组差异有统计学意义。分析原因,我们认为主要有以下几方面因素。传统前哨淋巴结清扫常采用血管钳钝性分离加电刀切割,纤细脆弱的淋巴管道很容易被离断。当通向前哨淋巴结的淋巴管被离断后,断端常回缩入脂肪组织,再次寻找比较困难,费时费力,导致手术时间延长。而内镜辅助下前哨淋巴结清扫,采用更加精细的腹腔镜专用薄剪刀,同时具有分离及切、凝功能,操作节约时间,更精细及省力,更利于保护纤细的前哨淋巴管道。与传统前哨淋巴结活检术相比,内镜辅助组出血量更少,分析其原因为:内镜辅助组由于内窥镜视野的放大作用,术中有助于淋巴管解剖层次的分离及伴行血管的保护。此外,电剪的使用方便灵活,对于毛细血管的处理先凝后剪,减少了出血的发生。相较传统手术,内镜辅助前哨淋巴结清扫术后引流量较少,可能与术中更少的组织分离与损伤有关。此外,本研究还发现,相较传统组,内镜辅助组前哨淋巴结活检术后疼痛更轻,患者对腋窝手术瘢痕有较高的满意度。
内镜辅助前哨淋巴结活检术可在放大的内镜视野下显露更为纤细的蓝染的淋巴管解剖结构,保护纤细的淋巴管道,学习曲线短,手术安全。但该术式对持镜助手配合的默契程度有较高要求。首先,术者必须具备良好的手眼协调、三维空间感知能力,其次,助手的配合也非常重要。稳定而默契的配合,术前镜头的处理,对于保持清晰的术野、手术顺利进行非常必要。内镜使用前可用温热的纱布浸泡镜头,配合碘伏擦拭,做到镜面无残留水雾。手术开始时,先切开皮肤及真皮层,见到蓝染的淋巴管线后,可用薄的手术剪刀小心地沿淋巴管线分离组织。随着切口操作位置的加深,直视下视野暴露困难时,可让助手将镜头对准蓝染的淋巴管,在内镜显示下进行操作。同时提醒助手让视野图像目标平缓移动,进镜时避免过近无法清晰调整焦距。
关于内镜辅助前哨淋巴结活检,最重要的限制是无自然腔隙,需要人工建腔,初期开展应选择腋窝状态相对较好的患者,避免选择肥胖或有副乳的患者。多数学者采用溶脂法建立腔镜下手术操作空间[16-17],徐洁等[18]采用非溶脂法进行腔镜下腋窝淋巴结清扫,取得良好的手术效果。本研究中我们于术中采用非溶脂法进行腔镜下操作,但在脂肪较多的情况下,容易干扰视野。因此,有腋窝手术史或放疗史者,由于组织粘连,解剖层次欠清,会使操作困难,中转开放手术的风险增加,应列为手术禁忌。术前应评估患者腋窝淋巴结情况及腋窝状态,减少中转手术及术中出血的风险。乳腺癌前哨淋巴结的活检与手术方式的制定尚需遵循个体化治疗的选择。此外,无论采取何种术式进行前哨淋巴结清扫,均需要连续石蜡切片加免疫组化检查确保前哨淋巴结转移状态判断的准确性,并重视微转移病灶的评估[19-20]。
综上所述,我们认为,内镜辅助前哨淋巴结活检的手术效果与传统手术相当。与传统腋窝淋巴结清扫术相比,内镜辅助前哨淋巴结清扫术中出血量少,手术时间短,疼痛更轻,患者对腋窝手术瘢痕有较高的满意度,值得在乳腺外科临床中推广应用。但本研究存在一定的局限性,样本例数较少,缺乏与完全内镜下前哨淋巴结活检手术方式的对比分析,研究结论仍需更多的设计合理、执行严谨、样本量大的相关临床研究进一步验证。
