脂肪酸合成酶在乳腺浸润性微乳头状癌中的表达及作用研究*
2022-10-18张婧越吴开良吕鉴可付丽
张婧越 吴开良 吕鉴可 付丽
浸润性微乳头状癌(invasive micropapillary carcinoma,IMPC)是一种特殊的病理组织学类型。IMPC 细胞呈桑葚样、集团性排列、生长,上皮标志物EMA 着色于IMPC 细胞团的外表面[1]。IMPC 具有高淋巴结转移、高脉管侵犯等特征,且高复发、高转移[2]。本课题组前期行空间转录组测序结果显示,与浸润性导管癌-非特殊类型(invasive ductal carcinoma,no special type,IDC-NOS)相比,脂质合成的关键基因脂肪酸合成酶(fatty acid synthase,FASN)在IMPC 中表达显著上调[3]。国内外多项研究表明,FASN 在多种恶性肿瘤中表达升高,与癌症的不良预后相关[4-6]。本研究旨在通过分析FASN 在IMPC 中的表达与功能,为乳腺IMPC 的预后评估提供新的生物学标志物。
1 材料与方法
1.1 材料
1.1.1 临床资料 选取2010 年1 月至2015 年12 月天津医科大学肿瘤医院收治的171 例IMPC 及159例IDC-NOS 乳腺癌手术病例,所有患者术前均未行新辅助化疗及放疗。采用倾向性评分匹配法(PSM)以1∶1 对IMPC 与IDC-NOS 行最近邻匹配(容差值为0.02),以分类变量是否年龄>50 岁,TNM 分期中的T、N 分期为预测变量,标准化差异法评价两组基线资料的均衡性,匹配后分为105 例IMPC 组和105例IDC-NOS 组。
1.1.2 细胞和试剂 乳腺癌T47D 细胞株购自中国PROCELL 公司。慢病毒载体构建和包装由上海生工生物公司完成。
1.2 方法
1.2.1 免疫组织化学法 所有组织标本均经10%中性福尔马林固定,石蜡包埋,4 μm 厚度切片,检测组织中的FASN 表达[7]。结果判定由两名经验丰富的病理医师采用双盲法独立判读。FASN 蛋白主要表达在肿瘤细胞细胞质中,免疫组织化学法染色强度可分为0(无可检测的染色)、1+(弱染色)、2+(中度染色)和3+(强染色)。阳性细胞<5% 计为0,6%~25% 计为1+,26%~50%计为2+,51%~75%计为3+,76%~100%计为4+。计算H 分数=Pi(i+1),其中i 代表肿瘤细胞的着色强度(0~3+),Pi 代表肿瘤细胞染色阳性的百分比。截断值设置为150%,截断值≥150%为FASN高表达,截断值<150%为FASN 低表达。
1.2.2 细胞培养及转染 在37℃、5%CO2培养箱中对T47D 细胞进行培养,待细胞密度达到70%左右时进行转染。构建干扰FASN 表达的慢病毒PLKO.1-FASN-sh1、sh2 实验组和转染空载体PLKO.1-shGFP 阴性对照组。
1.2.3 CCK8 细胞增殖实验 将细胞重悬,调整细胞密度为5×104/mL,取0.5 mL 细胞悬液接种于24 孔板中。从第0 天开始,每日向待测孔中加入10 μLCCK8试剂,孵育3~4 h,检测450 nm 处吸光度(OD)值。
1.2.4 划痕实验 待单层贴壁细胞长满后,使用10 μL无菌枪头在每孔平行划3 条直线,分别于0、12、24 h镜下观察各组划痕并拍照。采用Image J 软件分析统计各时期划痕的平均宽度值。
1.2.5 蛋白免疫印迹实验 提取细胞总蛋白,SDSPAGE 电泳、封闭、加一抗(稀释浓度1∶1 000),4℃孵育过夜,二抗室温孵育1 h,ECL 化学发光法检测蛋白表达。
1.2.6 随访 通过查询电子病历、复查影像学信息及致电询问的途径对患者随访,截止2022 年3 月。
1.3 统计学分析
采用SPSS 24.0 软件进行统计学分析。计数资料采用t检验法,计量资料采用非参数检验法。采用Kaplan-Meier 法进行生存曲线分析,采用Cox 比例风险回归模型分析法进行单因素和多因素分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 PSM 后乳腺 IMPC 与IDC-NOS 临床病理学特征的对比
所有IMPC 患者均经EMA 染色验证(图1,2)。PSM 后105 例患者的分析结果显示,IMPC 组的淋巴管癌栓和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)阳性率显著高于IDCNOS 组(P<0.05);FASN 在IMPC中的高表达为61.0%(64/105),显著高于IDC-NOS 的31.4%(33/105),两者比较差异具有统计学意义(P<0.001,表1)。FASN在IMPC 和IDC-NOS 肿瘤组织中均定位于细胞质,在IMPC 组织中FASN 多呈棕褐色,尤其在IMPC 肿瘤细胞团近间质侧相对深着色,而在IDC-NOS 组织中多为较浅着色(图3)。
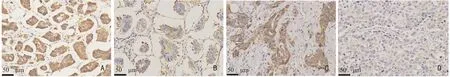
图3 免疫组织化学法检测FASN 在IMPC 及IDC-NOS 中的表达(SP×400)

表1 PSM 后IMPC 组和IDC-NOS 组基线情况比较
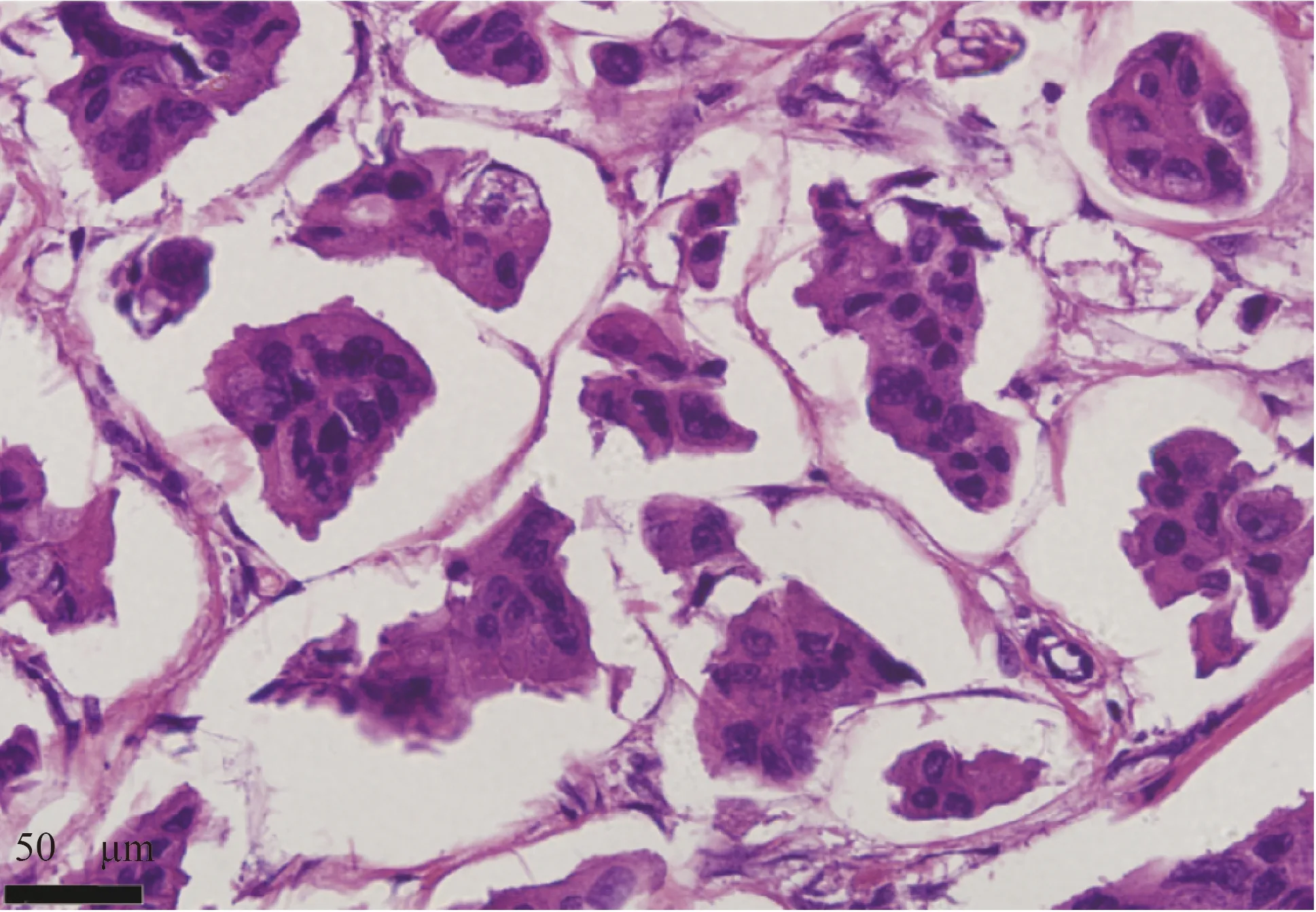
图1 镜下检查IMPC 形态特征(H&E×400)
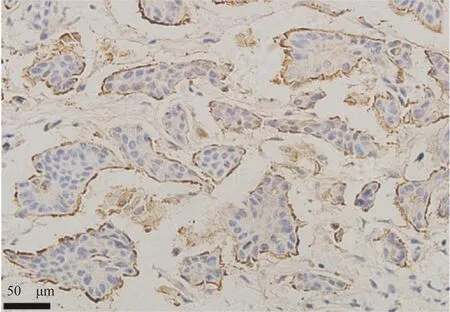
图2 免疫组织化学法检测EMA 表达(SP×400)
2.2 FASN 在IMPC 中的表达及与临床病理学特征的相关性
IMPC 中FASN 的表达与患者脉管癌栓、N 分期及Ki-67 表达呈正相关(P<0.05,表2)。

表2 FASN 表达与IMPC 临床病理学特征的相关性
2.3 乳腺IMPC 患者预后分析
Kaplan-Meier 生存曲线分析发现,FASN 高表达的IMPC 患者无病生存(disease-free survival,DFS)期和总生存(overall survival,OS)期显著短于FASN 低表达者(P=0.004 和P=0.007,图4)。单因素和多因素分析显示,FASN 高表达是IMPC 患者OS、DFS 降低的独立危险因素(P<0.05,表3,4)。
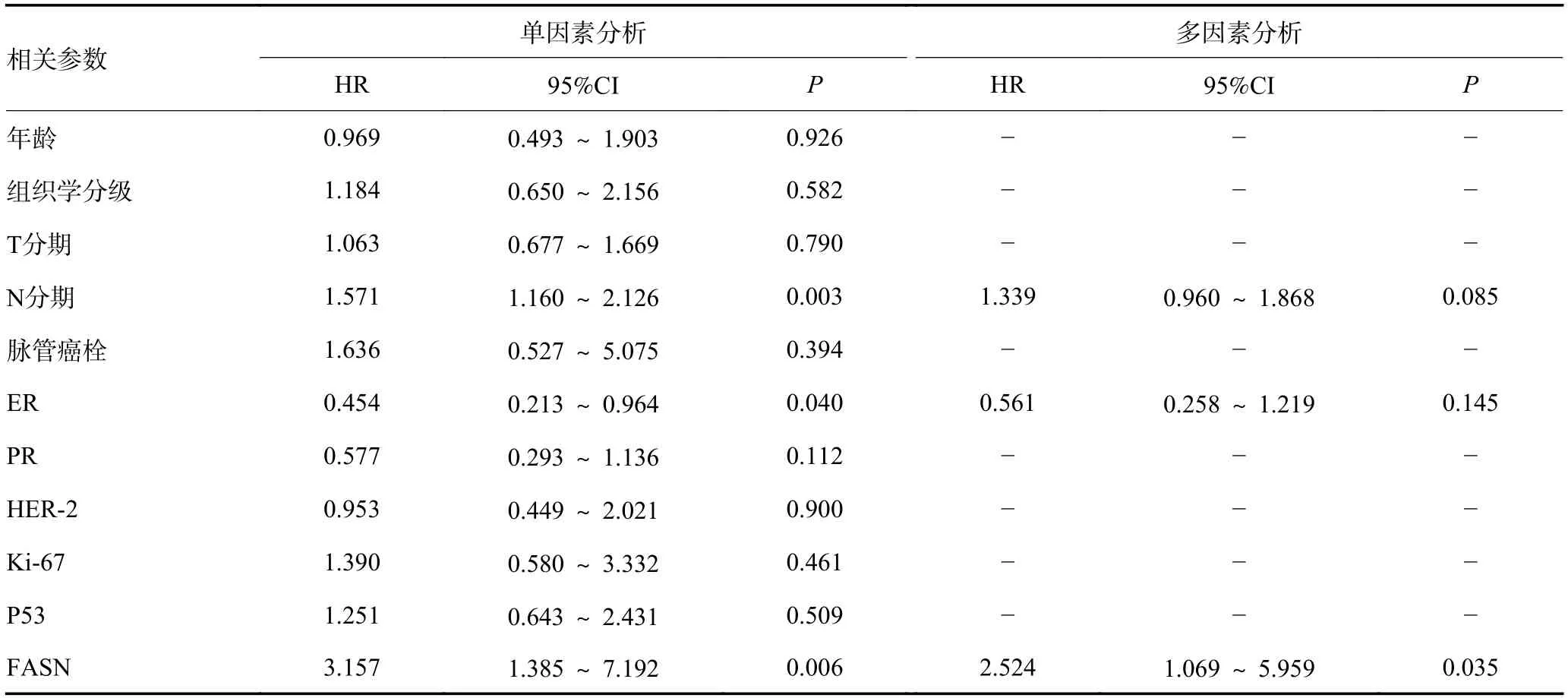
表3 IMPC 患者DFS 的单因素及多因素分析

图4 FASN 对IMPC 患者的预后影响

表4 IMPC 患者OS 的单因素及多因素分析
2.4 FASN 诱导上皮间质转化促进乳腺癌细胞系增殖、迁移
利用慢病毒稳转T47D 细胞构建shFASN 细胞模型(图5A),shRNA 引物序列见表5。实验组(sh1、sh2)细胞增殖、迁移能力均显著下降(P<0.001,图5B~D),其上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白E-cadherin 表达上调,N-cadherin 表达下调,Wnt/β-catenin 信号通路的主要信号分子Cyclin D1、C-myc 蛋白表达下调(图5E)。
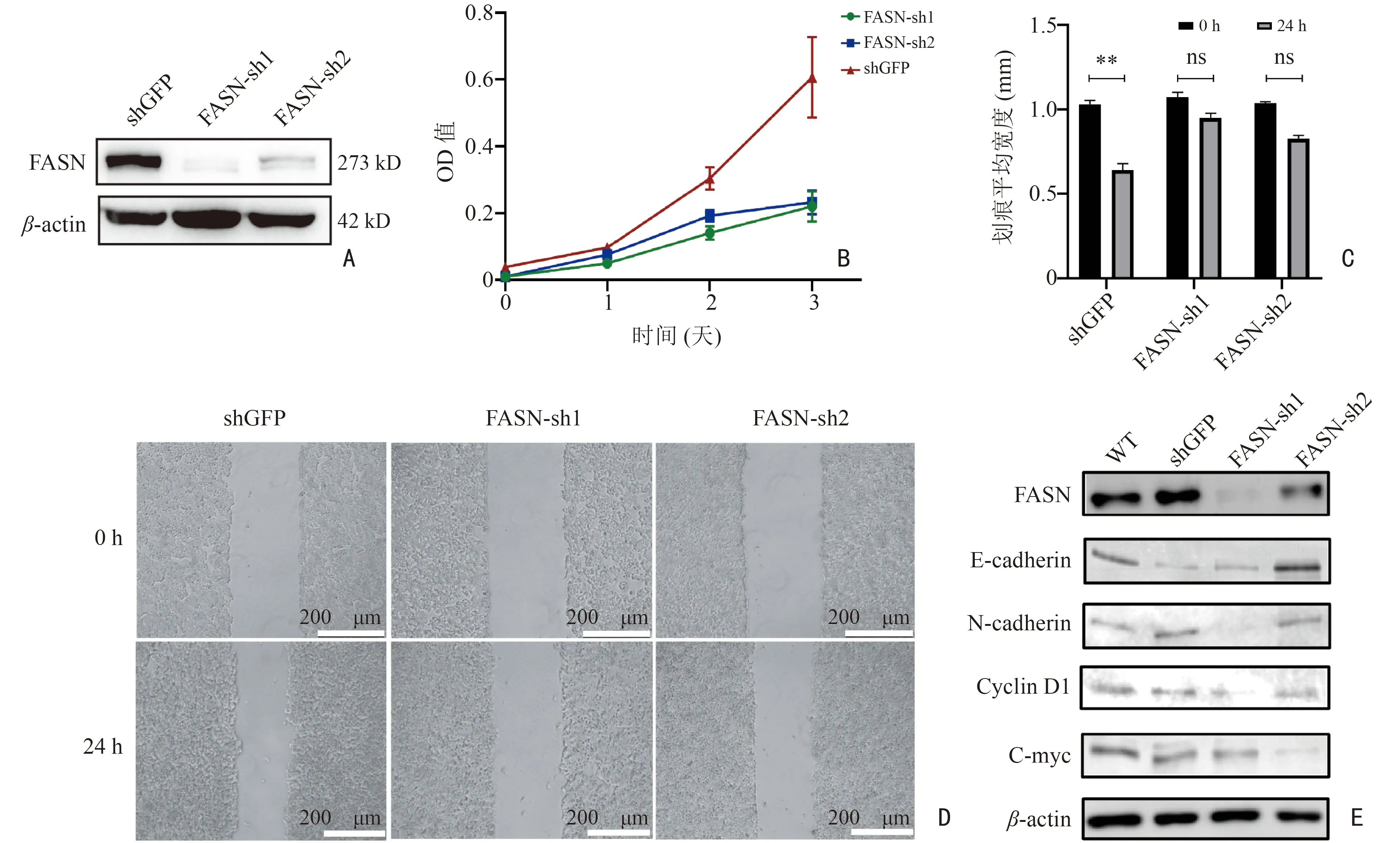
图5 FASN 对乳腺癌T47D 细胞增殖迁移能力的影响

表5 shRNA 引物序列
3 讨论
乳腺癌是女性发病率最高的恶性肿瘤,是除肺癌外死亡率最高的恶性肿瘤,造成肿瘤患者死亡的主要原因是肿瘤的侵袭转移[8]。乳腺IMPC 具有高淋巴结转移、高淋巴管浸润等不良生物学行为,且预后极差[1,9]。FASN 是长链脂肪酸从头合成的关键酶,是癌细胞获得脂肪酸的重要来源[10]。本研究显示,FASN 在IMPC 表达显著高于IDC-NOS,并具有在IMPC 肿瘤细胞团中靠近间质侧的FASN 表达相对较高,而在内侧表达相对低的特点,提示FASN 在IMPC “集团性”侵袭、转移过程中可能发挥重要作用。本研究还发现,FASN 表达与IMPC 患者淋巴结转移和脉管癌栓阳性率呈正相关,提示FASN 是否与IMPC 细胞的嗜淋巴结转移、嗜脉管侵袭密切相关,其潜在机制还有待进一步研究。
本研究提示,FASN 高表达可作为预测IMPC 患者DFS 和OS 的独立危险因素。精准的诊疗是改善IMPC 患者预后的必要前提[11],而IMPC 的精准诊治需要有效治疗靶点的发现。近年来,已有大量研究发现FASN 与多种癌症的预后相关,包括前列腺癌[5]、胆管癌[12]、肾透明细胞癌[6]。本研究中的部分细胞实验的意义,在于发现IMPC 组织中FASN 高表达可能是肿瘤发生、发展和影响预后的重要参与机制,提示FASN可作为IMPC 的潜在治疗靶点。
EMT 与肿瘤的发生有关、并赋予癌细胞转移特性[13]。EMT 的调控与多种信号通路密切相关,包括Wnt/β-catenin、表皮生长因子受体、转化生长因子(TGF)和Notch 通路[14]。研究表明,FASN 介导了卵巢癌细胞的EMT 过程,影响肿瘤的恶性进展[15]。但FASN 对乳腺癌细胞生物学行为的影响及其调控机制还尚未明确。本研究证明FASN 能增强乳腺癌细胞的增殖、迁移能力,并发现shFASN 组细胞的上皮标志物E-cadherin 表达上调,间充质标志物N-cadherin 表达下调,提示FASN 在乳腺癌中诱导EMT,且Wnt/β-catenin 信号通路可能是FASN 调控乳腺癌EMT 进而促进乳腺癌增殖、迁移的潜在机制。
综上所述,FASN 可能通过Wnt/β-catenin 通路诱导EMT 发生,参与IMPC 的集团性侵袭、转移和淋巴管侵犯,其高表达是影响IMPC 患者预后的独立危险因素,可作为评估IMPC 临床预后的重要生物学标志物,为IMPC 诊断、靶向治疗和预后预测提供重要参考。但FASN 调控乳腺癌增殖、迁移的具体作用机制,还有待更为系统的深入研究。
