不同亚型树突状细胞之间的作用在肿瘤免疫中的研究进展*
2022-10-18王建任秀宝
王建 任秀宝
树突状细胞(dendritic cells,DCs)最初由Ralph Steinman 和Zanvil Cohn 于1973 年在小鼠脾脏中发现[1],是迄今为止机体内功能最强大的抗原呈递细胞(antigen-presenting cells,APC),因其成熟时具有树状或伪足样突起而得名。DCs 是连接固有免疫和适应免疫应答的桥梁,可识别抗原并将抗原呈递至T 淋巴细胞,还可通过细胞间接触以及细胞因子传递调节信号来发挥免疫应答或介导免疫耐受,因此DCs 具有多重性免疫调节功能。研究发现DCs 是异质细胞群,其多样性受DCs 的分化发育、表型、组织定位以及功能特异性等多种因素影响[2];其活化与DCs 的成熟状态、免疫微环境、病原微生物等因素密切相关。经典Ⅰ型DCs(conventional DC1,cDC1)被认为在抗肿瘤免疫应答以及交叉呈递中发挥尤为关键的作用。然而,DCs 各亚群的功能特异性以及亚群之间的相互作用在进一步强化抗肿瘤免疫应答中的作用不可忽视。现就DCs 亚群和亚群之间的作用在肿瘤免疫中的研究进展进行综述,以期为以DCs 为靶点的肿瘤免疫治疗提供新的思路。
1 DCs 的来源及分类
1.1 DCs 的来源
DCs 来源于骨髓造血干细胞,广泛分布于全身组织和器官。根据来源途径主要分为髓系DCs(myeloid DCs,MDCs)和淋巴系DCs(lymphoid CDs,LDCs)。根据其特定的转录因子以及功能的不同,DCs 主要分为经典DCs(conventional DCs,cDCs)和浆细胞样DCs(plasmacytoid DCs,pDCs)[3]。另有单核来源的DCs(monocyte-derived DCs,moDCs)依赖于趋化因子受体2(C-C chemokine receptor type 2,CCR2)募集,由血液中的单核细胞在周围组织中分化而来。根据抗原的性质以及启动的T 淋巴细胞的不同,cDCs 又可进一步分为cDC1 和cDC2,分别启动MHCⅠ-CD8以及MHCⅡ-CD4 途径。cDC1 作为肿瘤抗原交叉呈递的关键细胞亚群,具有不同于cDC2 的表型特征,且小鼠和人类表型也不同。小鼠和人类cDC1 表型特征具体汇总见表1。
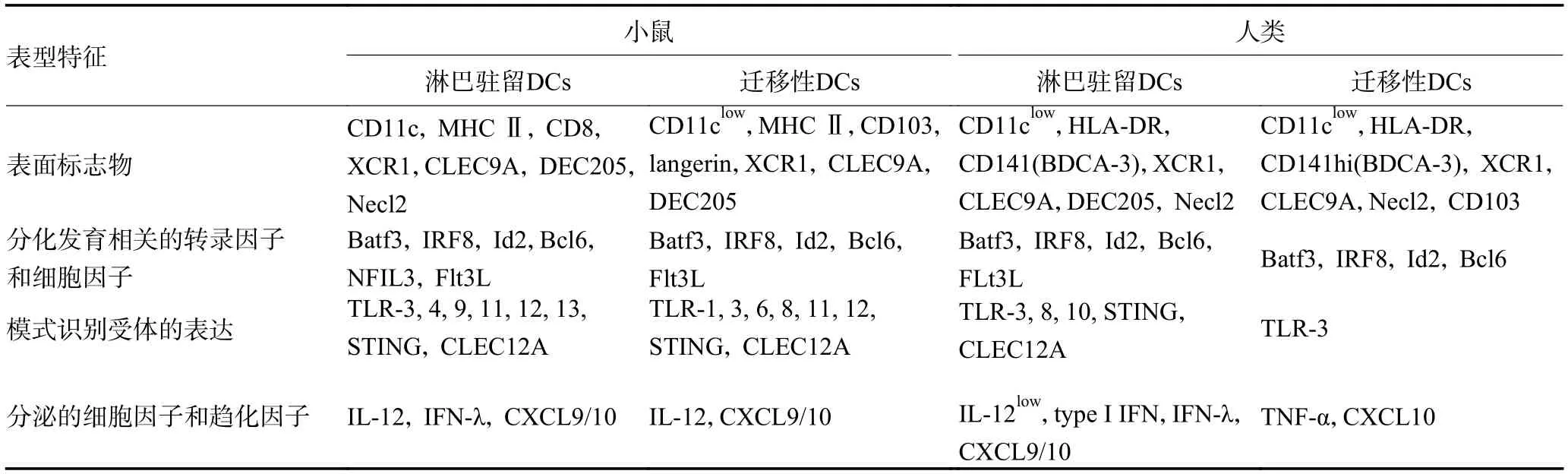
表1 小鼠和人类cDC1 的表型特征
1.2 DCs 各主要亚群的作用
CD8+T 细胞是抗肿瘤免疫的主要效应细胞,抗原交叉提呈可将外源性抗原通过MHCⅠ类分子提呈至CD8+T 细胞,在抗病毒免疫、抗肿瘤免疫以及抗胞内寄生菌免疫中发挥重要作用。cDC1 可通过液泡途径和内体-细胞质途径发挥抗原交叉呈递作用,最终形成抗原肽-MHCⅠ分子复合物,呈递至CD8+T 细胞,提高肿瘤的免疫原性。研究表明,CD8α+DCs、CD103+DCs以及人体中的CD141+DCs 是发挥抗原交叉呈递的主要cDC1 群体[4]。cDC2 主要通过MHCⅡ途径呈递抗原,是激活CD4+T 细胞的主要抗原呈递细胞。在特定的环境中,cDC2 可以刺激Th1、Th2 和Th17 的活化,发挥免疫功能[5]。有研究发现,人类cDC2 能够特异性在人乳突病毒相关的口腔鳞状细胞癌组织中富集,并产生IL-12p70、GM-CSF、TNF-α 等细胞因子,促进Th1 抗肿瘤免疫应答[6-7]。
pDCs 最初发现于人类淋巴结中,称为“干扰素细胞”或“浆细胞”样DCs。在甲基化核苷酸刺激或病毒感染时能够分泌大量的Ⅰ型干扰素(type I interferons,IFN-Ⅰ)参与抗原交叉呈递并发挥强大的抗病毒免疫反应。pDCs 的抗原摄取能力较弱,成熟的pDCs 能够作为APC 特异调控其表面MHCⅡ分子的表达,最终形成MHCⅡ分子复合物,发挥抗原呈递作用。此外,pDCs 在IL-3 和CD40 配体的作用下能够调节免疫应答,诱导免疫耐受[8]。moDCs 是一类与上述DCs 来源途径不同的DCs 群体,在粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)和IL-4 作用下,外周血单个核细胞可以在体外分化成moDCs,分化而来的moDCs 具有DCs 群体的一些表型和功能特征。
2 DCs 亚群相互作用在肿瘤免疫中的研究
2.1 cDC1 在抗肿瘤免疫应答中不可或缺
肿瘤抗原必须通过APC 呈递至CD8+T 初始T细胞才能激发免疫反应。cDC1 捕获肿瘤抗原后通过抗原交叉呈递过程在细胞内组装成MHCⅠ 抗原复合物到细胞表面。而后,cDC1 迁移至肿瘤引流淋巴结等二级淋巴器官,在此处呈递抗原给初始CD8+T 细胞,诱导CD8+T 细胞的活化,产生效应CD8+T 细胞,最终发挥抗肿瘤免疫作用[9]。研究表明,NOX2 介导产生的ROS 以及偏高的pH 环境使得抗原进入胞质增加,内质网相关降解能力下降,最终促进抗原交叉呈递[10];cDC1 吞噬体中有较多内质网相关蛋白如MHCⅠ、TAP、Sec61、Sec22 等的驻留。研究发现,敲低Sec22b 可以导致内质网驻留蛋白至吞噬体的转运减少,导致抗原释放至细胞质减少,吞噬体内抗原降解增加,最终降低抗原交叉呈递的能力[11]。Theisen 等[12]的研究证实了cDC1 的抗原交叉呈递作用,并用Wdfy4 敲除小鼠模型,进一步证实Wdfy4 在cDC1 亚群中特异性地发挥作用。cDC1 除了发挥抗原交叉呈递作用,还是分泌IL-12 的主要DCs 亚群,cDC1 还可以通过激活NK 细胞,诱导CD4+T细胞活化,Th1 极化来发挥抗肿瘤免疫作用[13]。
众多研究用Batf3 敲除小鼠模型来研究cDC1 在抗肿瘤免疫应答中的作用。Batf3 在cDC1 分化中发挥着至关重要的作用,Batf3 敲除小鼠模型缺乏cDC1亚群而并不影响其他DCs 亚群的存在。有研究表明,PD-1/PD-L1 阻断抗体或者CD137 激动剂不能诱导Batf3 敲除小鼠产生免疫应答,进一步预示cDC1 的重要作用[14]。另有研究发现,肿瘤组织驻留cDC1 可以通过释放趋化因子CXCL9 和CXCL10进而吸引CD8+T细胞向肿瘤部位聚集[15]。此外,在人类中也发现了肿瘤组织中cDC1 的数量与患者预后以及免疫治疗疗效密切相关。通过TCGA 数据库分析发现,cDC1 标志物与其他细胞群(单核细胞、巨噬细胞、其他DCs 亚群)标志物比例越高,肿瘤患者预后越好[16]。
2.2 DCs 亚群之间的相互作用及助力抗肿瘤免疫疗效最大化
2.2.1 cDCs-pDC 的相互作用 研究表明,cDCs 和pDCs 在一些免疫环境里面是共定位的,如红斑狼疮患者来源的非炎性淋巴结、皮肤活检组织,甲状腺炎患者来源的甲状腺组织,癌症患者来源的脾脏组织中,均发现了二者的共定位[17]。cDCs 和pDCs 在空间位置上的共定位预示着二者在功能上具有一定的交互作用。pDCs 产生的Ⅰ型干扰素能够诱导cDC1 共刺激分子CD40、CD80、CD86 的表达,进而促进cDCs 在抗肿瘤免疫应答中逐渐成熟,并诱导产生特异性杀伤的细胞毒性T 淋巴细胞(CTL)[18]。活体双光子显微镜分析发现,pDCs 可以依赖CCR5 向cDC1-CD8+T 作用的部位趋化,而激活的CD8+T 细胞也可以通过趋化因子XCL1 吸引XCR1+cDC1 的浸润。另有研究表明,在诸多病毒感染体系中,敲除pDCs 可以破坏CTL 的免疫应答[19]。在淋巴细胞脉络丛脑膜炎病毒感染的模型中,由pDCs 介导的CD4+T 细胞的活化在最终产生抗病毒CTL 应答中发挥了重要的辅助功能。
有研究表明,黑色素瘤患者回输负载抗原的pDCs 能够在患者体内产生强大的T 细胞免疫反应,该反应可能是通过回输的pDCs 与患者体内的cDCs相互作用产生的[20]。另有研究表明,肿瘤浸润的pDCs 与乳腺癌或卵巢癌患者的不良预后相关。这可能归结于pDCs 诱导产生的Tregs 及吲哚胺2,3-双加氧(indoleamine 2,3-dioxygenase,IDO)的表达[21]。因此,pDCs 重塑适应性免疫应答的机制依然比较复杂,这与pDCs 的激活状态、pDCs 与其他细胞之间的相关作用密切相关。
2.2.2 cDC1-cDC2 的相互作用 近期的多项研究表明,高效细胞毒CD8+T 细胞免疫反应的产生不仅需要cDC1 的存在,还需要cDC2 的辅助作用[22-23]。活体显微镜分析显示,在引流淋巴结中,cDC1 主要定位在T 细胞聚集的深层副皮质区,cDC2 主要散在分布于淋巴结周围,同时发现CD8+T 细胞和cDC1 共定位,CD4+T 细胞和cDC2 共定位,该现象同样存在于脾脏组织中[24]。DCs 亚群定位的不同也预示着DCs 亚群动态行为的不同,cDC2 分布在周边可能会更早的接触CD4+T 细胞。在免疫应答激活的过程中,CD4+T 细胞的激活是第一步,激活后的CD4+T 细胞募集到淋巴组织常驻的XCR1+cDC1 区域,为cDC1 发挥作用提供辅助激活信号。接收到刺激信号的cDC1 将信号传递至CD8+T 细胞,随后扩增产生细胞毒性的效应CD8+T细胞。无CD4+T 细胞的辅助,CD8+T 细胞不足以产生强大的免疫反应以及长效的免疫记忆功能[25]。CD4+T细胞激活诱导自身CD40L 的表达,进而诱导cDC1表达共刺激分子CD70、CD80、CD86 以及细胞因子IL-12、IL-15。研究表明,IFN-Ⅰ的分泌对cDC1 发挥功能是很重要的,而pDCs 是IFN-Ⅰ的重要来源细胞群,在Batf3 缺失小鼠体内用PDCA 抗体清除pDCs后发现CD8+T 细胞的免疫应答被破坏[26]。
cDC1 和cDC2 能够协同诱导Th1 的产生。在利什曼原虫感染模型中,cDC1 或cDC2 都能刺激产生分泌IFN-γ 的CD8+T 细胞,cDC2 诱导Th1 依赖于cDC1 分泌IL-12,而cDC1 诱导Th1 通过CD70,并不依赖IL-12[27]。激活的Th1 细胞通过分泌大量的IFNγ 帮助cDC1 刺激活化CTL。因此,不同的DC 亚群产生不同的信号,最终使得T 细胞免疫效应最大化。
3 DCs 亚群相互作用的协作模式
3.1 肿瘤引流淋巴结中DCs 亚群的相互作用
在抗肿瘤免疫应答中CD8+T 细胞发挥免疫效应最大化涉及到连续性的两个关键步骤:1)发生在“抗原捕获”后;2)发生在“抗原转移到淋巴组织常驻cDC1”后。连续协作模式描述如下:具有迁移能力的cDC1在肿瘤部位捕获抗原后迁移至肿瘤引流淋巴结,在淋巴结形成刺激活化CD8+T 细胞的区域,活化后的CD8+T 细胞通过分泌CCL3/4 以及XCL1 分泌募集CCR5+pDCs 和XCR1+淋巴驻留cDC1。但迁移性的cDC1 将抗原转移至淋巴驻留cDC1 的具体机制尚未阐明。同样的,迁移性的cDC2 在肿瘤部位捕获抗原后迁移至肿瘤引流淋巴结刺激活化CD4+T 细胞。淋巴结中募集过来的pDCs 进一步使淋巴驻留cDC1 成熟,同时活化的CD4+T 细胞助力cDC1 产生强大的CD8+T 细胞免疫反应。
3.2 肿瘤组织中DCs 亚群的相互作用
肿瘤组织驻留cDC1 在产生抗肿瘤免疫应答中发挥着重要作用。通过缺失淋巴结的小鼠或者阻断T细胞从淋巴向肿瘤循环实验证实,T 细胞在淋巴结中的启动或者肿瘤组中存在激活的T 细胞对抗肿瘤免疫应答至关重要。研究证实,肿瘤驻留cDC1 是分泌CXCL9/10 的主要来源,可以趋化效应CD8+T 细胞向肿瘤部位募集[14],激活后的T 细胞进一步分泌趋化因子募集DC 向肿瘤部位迁移,最终形成类似淋巴结样的结构,称之为三级淋巴结构(tertiary lymphoid structures,TLS)[28]。TLS 的典型标志是高内皮静脉以及CCL19/21 的表达,CCR7 作为CCL19/21 的受体,对维持DCs 向淋巴迁移至关重要。TLS 主要由B 细胞和T 细胞区、成熟的cDCs 和pDCs 组成。如此有序的结构使得TLS 成为抗肿瘤免疫应答的绝佳场所[29]。有研究表明,人类肿瘤中TLS 的存在与患者预后相关,进一步证实,TLS 中DCs 和Th1 细胞的数目越多,患者预后越好[30]。另有研究表明,相比瘤内具有TLS 的肺癌患者,瘤内只有CD8+T 细胞浸润而无TLS 形成的患者预后较差,进一步证明肿瘤原位形成TLS 与较好的预后密切相关。在肺癌转移模型中,给予TLR9激动剂治疗能够促进CD8+T 细胞的浸润,有助于形成TLS,该模型中LS 的形成依赖于CD4+T 细胞的辅助[31]。研究表明,激活黑色素肿瘤内STING 信号通路有助于TLS 的形成,能够进一步富集CD8+T 细胞以及DCs 细胞,提高肿瘤免疫治疗效果[32]。上述研究证明,DCs 亚群在TLS 中相互作用,最终促进抗肿瘤免疫反应。同时也从另一个角度说明,唤起肿瘤组织中DCs 亚群之间的“协作”比“单打独斗”,更能助力抗肿瘤免疫反应最大化。肿瘤免疫反应的连续协作模式见图1。DCs 亚群之间相互作用在肿瘤免疫中的工作模式:1)瘤内迁移性cDC1 和cDC2 捕获肿瘤抗原后迁移至引流淋巴结;2)迁移性的cDC2 通过MHCⅡ途径呈递抗原至CD4+T 细胞并诱导CD40L 的表达;3)迁移性的cDC1 启动活化CD8+T 细胞;4)激活后的CD8+T 细胞通过CCL3/4-CCR5 途径和XCL1-XCR1 途径趋化pDCs 和淋巴驻留cDC1 向激活部位聚集;5)迁移性的cDC1 能够将肿瘤抗原交接至淋巴驻留cDC1;6)pDCs 释放Ⅰ型IFN 促进cDC1 成熟;7)通过DCs 启动激活后的CTL 进一步扩增并迁移至肿瘤部位发挥肿瘤杀伤作用;8)活化后的CTL 和瘤内的NK 细胞通过释放XCL1 和FLT3L 进一步吸引cDC1 向肿瘤内聚集。

图1 DCs 亚群之间相互作用在肿瘤免疫中的工作模式
4 DCs 肿瘤疫苗在临床应用现状
4.1 基于单核细胞来源的DCs 肿瘤疫苗的疗效以及不足
鉴于DCs 强大的抗原呈递能力和T 细胞活化特性、单核细胞分化和体外DCs 培养技术的发展,DCs疫苗逐渐应用于肿瘤治疗。2010 年基于DCs 的自体前列腺癌疫苗Sipuleucel-T(Provenge)获美国食品药品监督管理局(FDA)批准上市,是首款DCs 治疗性肿瘤疫苗。早期的临床试验结果显示DCs 疫苗安全性高,对肿瘤具有免疫原性[33]。单次注射DCs 的1 周内,患者体内检测到肿瘤抗原特异性的CD8+T 细胞免疫反应,接受DCs 疫苗治疗的患者中约10%以上产生肿瘤持续消退现象。早期的研究发现[34]患者体内来源的CD14+单核细胞和CD34+祖细胞在体外诱导分化的moDCs 在临床试验中已显示对不同类型的癌症有效:如黑色素瘤(临床试验注册编号:NCT01 983748;抗原来源:自体肿瘤RNA 抗原)、前列腺癌(临床试验注册编号:NCT02 111577;抗原来源:辐射过的前列腺癌细胞抗原)以及转移性结直肠癌(临床试验注册编号:NCT02 503150;抗原来源:自体肿瘤裂解物)。另外一项大规模的Ⅲ期临床试验,即基于moDC 的DCs 肿瘤疫苗治疗胶质母细胞瘤(临床试验注册编号:NCT00 045968;抗原来源:自体肿瘤裂解物)的结果显示良好的安全性和显著提高的生存率[35]。近期研究表明,DCs 肿瘤疫苗可以用于治疗食管癌[36]。Gholamin 等[37]用moDCs 负载18E7 以及MAGE-A3 抗原肽构建DCs 疫苗,并发现能够在体内产生大量的IFN-γ以及CTL。另有研究发现,皮下注射Arc/Arg3.1-过表达的DCs 疫苗能够募集肿瘤抗原特异性CD8+T 细胞并重塑肿瘤免疫微环境,产生抗肿瘤效果[38]。
虽然moDCs 肿瘤疫苗具有一定的疗效,但moDCs 在抗原交叉呈递和向引流淋巴迁移方面能力有限,且肿瘤免疫抑制微环境中的moDCs 大部分处于免疫抑制状态,使得moDCs 肿瘤疫苗的疗效仍有一定的局限性。同时,体内天然的DCs 亚群发挥的抗肿瘤免疫效果与单独回输体外分化的moDCs 肿瘤疫苗不同。因此,新型的靶向DCs 的肿瘤免疫治疗手段有待研发。
4.2 “加强协作”优于“单打独斗”
有临床试验显示,天然的pDCs 体外装载HLAA2.1 肽段在黑色素瘤患者中能够产生肿瘤特异性的CTL,显著改善患者的无进展生存期,安全性良好[39]。上述研究已表明,具有抗原交叉呈递作用的cDC1 在抗肿瘤免疫反应中发挥重要作用,使得moDCs 不能作为肿瘤免疫治疗的最佳选择。因此,寻求多DCs 亚群的协作显得尤为重要。
有效的抗肿瘤免疫反应的核心是产生以CD8+T细胞为主体的细胞免疫应答,这也是DCs 作为免疫治疗手段的基础。虽然moDCs 肿瘤疫苗能够刺激患者体内产生抗原特异性CTL,但相比moDCs,cDC1 具有更强大的抗原呈递能力以及向引流淋巴结迁移的能力。因此,如何靶向cDC1 发挥抗肿瘤免疫很关键。综上所述,cDC1 发挥最大化的抗肿瘤免疫反应离不开其他DCs 亚群的辅助作用。此外,在相应的活化信号刺激下,cDCs 和pDCs 均有潜力激活T 细胞来发挥肿瘤杀伤作用。未来利用单细胞测序、空间转录组学等技术,挖掘不同亚群的功能与内在联系,并利用DCs 亚群的相互作用,靶向能够刺激活化多种DCs 亚群的信号,建立一套稳定的、持续的协同治疗体系,使得广谱抗肿瘤效果成为可能。
5 结语
本文综述了DCs 亚群特异性以及DCs 亚群的相互作用在肿瘤免疫中的进展,并对DCs 肿瘤疫苗临床应用现状进行总结,进一步加深了对DCs 功能的理解,有助于为未来开发以DCs 为靶点的免疫治疗提供思路。
