腰椎管狭窄症行后路椎间融合术前、术后邻近节段退变影像学的研究
2022-10-18马辉孙建强莫涛孟长峰高凯旋
马辉,孙建强,莫涛,孟长峰,高凯旋
(1.洛阳市中医院骨科;2.洛阳市第三人民医院骨科,河南洛阳 471000)
腰椎管狭窄症(lumbar spinal stenosis,LSS)患者多见于中老年人群,随着年龄的增加,患者术前常见有多个节段存在退变,而真正致病的责任节段多为其中一个。对此类患者制定手术方案,往往面临严峻挑战:若仅针对责任节段作减压融合,术前已存在影像学退变的其它节段可能会在术后退变加速、面临再次手术;若对其他节段提前行预防性减压,则存在扩大手术指征的嫌疑,且引起节段性稳定性降低、增加了肌肉韧带复合体的损伤程度,可能会增加术后邻近节段退变(adjacent segment degeneration,ASD)的风险[1-2]。因此,客观地评价术前邻近节段退变对LSS患者行减压融合手术疗效的影响,具有重要的临床意义。既往研究中关于术前邻近节段退变的评估,大多是基于椎间盘和小关节退变程度来描述和评价[3-4],但在临床上,邻近节段退行性疾病(adjacent segment disease,ASDis)的翻修手术更常见于椎管狭窄加重、引起神经压迫症状所致,因此逼着认为,对术后邻近节段退变的影像学观察不应忽视“椎管狭窄”这一特征。基于上述原因,本研究的目的有二:(1)通过术前和术后邻近节段的影像学分析,探讨术后邻近节段的影像学变化特征;(2)探讨术前邻近节段退变情况对LSS患者行减压融合手术疗效和术后邻近节段退变的影响。
1 资料与方法
1.1 一般资料
纳入2017年3月~2019年3月行后路腰椎减压固定融合术治疗的LSS患者121例,纳入标准:①患者有长期慢性下腰痛、间歇性跛行等症状,明确诊断为LSS;②病变节段为L4-S1之间,经正规保守治疗无效,行后路减压融合术治疗;③术后随访时间≥2年;④术前和术后随访期间的影像学资料完整。排除标准:①邻近节段术前存在不稳;②存在躯干冠状位或矢状位失衡;③有腰椎感染、肿瘤等疾病;④既往有腰椎融合手术史,或术后失访、随访不足2年,以及影像学资料不全者。
依据患者术前邻近节段的退变情况分为A、B两组:A组68例,术前邻近节段无退变。B组53例,术前邻近节段存在退变。对两组患者的性别、年龄、麻醉风险ASA分级、体质量指数(body mass index,BMI)等资料作比较,仅A组年龄

表1 两组LSS患者的一般资料对比
1.2 术前和术后邻近节段退变的判定
依据患者术前相邻节段MRI表现,拟定以下标准:①椎间盘退变:术前MRI见邻近节段椎间盘存在轻度突出,或有局限性高信号改变(high-intensity zone,HIZ),压迫硬膜囊;②椎管狭窄:术前邻近节段存在中央管或神经根管狭窄。椎管狭窄的分级标准,采用Lee等[5]的方案,分为0、1、2、3级。0级:椎管未见狭窄,马尾神经前方有脑脊液充盈(图1a-b);1级:轻度狭窄,且马尾神经前方无脑脊液充盈,马尾神经终丝聚集但可辩(图1c-d);2级:中度狭窄,马尾神经已积聚成束(图1e-f);3级:重度狭窄,硬膜囊内几乎完全闭塞(图1g-h)。

图1 Lee等[5]椎管狭窄分级的示意图
术前无椎间盘突出或HIZ改变,中央椎管形态0级者,判定为无退变,纳入A组;反之,存在椎间盘突出、压迫硬膜囊,或存在HIZ改变,以及椎管狭窄1级以上者,均纳入B组。
因本研究所纳入病例均为L4-S1节段手术者,故本文统一选择其上位邻近节段作为观察目标。
1.3 手术治疗
所有患者全部在全身麻醉下,接受经典的后路腰椎减压+椎体间植骨融合内固定手术,术中将椎板切除减压,予以植骨融合、椎弓根钉内固定处理,注意避免上位相邻节段的关节突和关节囊损伤。患者术后3~5 d可尝试下床活动,术后3周可开展腰背肌功能锻炼,3个月内仍应以腰围保护。
1.4 观察指标
统计所有患者的手术时间、出血量、住院天数、并发症情况;术后均获2年以上随访,分别于术前、末次随访时进行腰痛、下肢痛的VAS评分、日本骨科学会JOA评分和Oswestry功能障碍指数(Oswestry disability index,ODI)评价,此3项指标属常用评价工具,为学者们熟知,不予赘述。
1.5 术后ASD的判定
术后获访24~31个月,平均随访期为27.3个月。末次随访时,采用腰椎正侧位、屈伸位X线检查和腰椎MRI检查,并与患者术前邻近节段的影像学资料进行比对,以评价邻近节段ASD的发生情况。X线判定标准:①椎间隙高度丢失>10%;②邻近节段椎体的滑移>3 mm,或椎体活动>10°;③终板硬化,存在邻近节段侧弯;④原有骨赘增加>3 mm,或有新骨赘形成。MRI判定标准:①邻近节段椎间盘突出加重、Pfirrmann分级加重,或出现HIZ改变;②邻近节段的椎管狭窄分级加重。上述所有判定标准中,与术前相比的任一项改变均可视为术后ASD。
此外,基于上述判定标准,将术后ASD的改变特征分为:①椎间盘因素:如Pfirrmann分级加重,或椎间盘突出、HIZ改变等。②椎管狭窄分级变化加重;③邻近节段出现滑移或侧弯等,但除外椎管狭窄。若术后ASD出现的同时,引起患者腰痛或下肢根性症状明显加重,则判定为ASDis。
1.6 数据分析
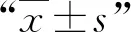
2 结果
2.1 手术情况和早期并发症
手术时间、术中失血量和住院时间方面,两组间差异均无统计学意义(P>0.05)。A组术后早期并发症发生率为11.8%,包括脑脊液漏2例,心衰1例,切口感染1例,一过性下肢无力2例,硬膜外血肿2例;B组发生率为11.3%,包括脑脊液漏3例,切口感染1例,心衰1例,一过性下肢无力1例。两组并发症发生率差异无统计学意义(P>0.05)。见表2。

表2 两组LSS患者的手术情况和早期并发症分析
2.2 术后ASD发生情况
A组出现术后ASD14例,发生率20.6%;B组33例,发生率62.3%。B组的发生率显著高于A组,差异有统计学意义(P<0.05)。从术后ASD发生的影像学变化特征来看,两组均以椎管狭窄最为常见,分别占比9/14和24/33,见表3。与术前相比,A、B两组末次随访时的Pfirrmann分级未见显著变化(P>0.05);两组间相比,术前和末次随访时的Pfirrmann分级均有显著的组间差异性(P<0.05),其中B组的Pfirrmann分级程度更重,见表4。

表3 两组LSS患者术后ASD发生的影像学变化分析
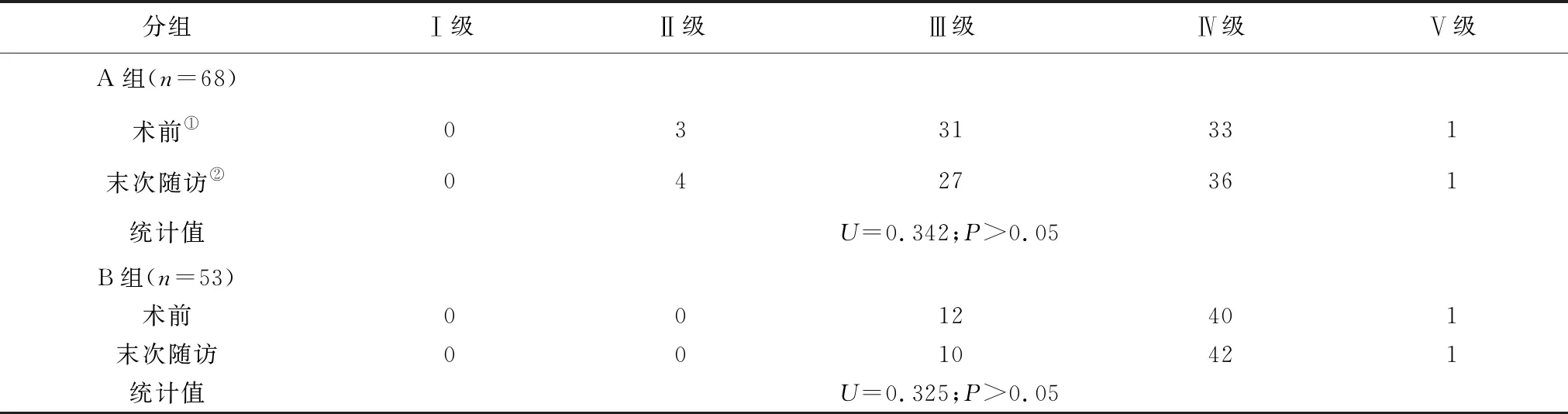
表4 两组LSS患者的椎间盘退变Pfirrmann分级比较
2.3 术后疗效
2.3.1 总体疗效分析
与术前比较,两组患者术后的VAS评分和ODI指数均显著降低(P<0.05),JOA评分显著升高(P<0.05)。A组末次随访的JOA评分显著高于B组,差异有统计学意义(P<0.05)。见表5。

表5 两组LSS患者的疗效指标比较
2.3.2 术后ASD患者的疗效分析
与术前比较,A组、B组患者末次随访时的腰痛、下肢痛VAS评分和JOA评分、ODI指数均获显著改善(P<0.05)。各亚组之间的组内比较如下:(1)A组的ASD亚组和无ASD亚组之间,术前、末次随访时的各项指标均无统计学差异(P>0.05);(2)B组的ASD亚组在末次随访时的腰痛VAS评分和ODI指数均显著高于无ASD亚组(P<0.05)。见表6。

表6 术后ASD和无ASD患者的疗效指标比较
2.4 术后ASD的影响因素分析
将本研究所有的潜在因素,如麻醉ASA分级、患者年龄、性别、BMI、术前邻近节段存在退变等因素均纳入到多因素Logistic回归模型中进行处理,见表7:术前邻近节段存在退变(OR=6.571)和BMI(OR=1.623),均是术后出现ASD的独立风险因素。
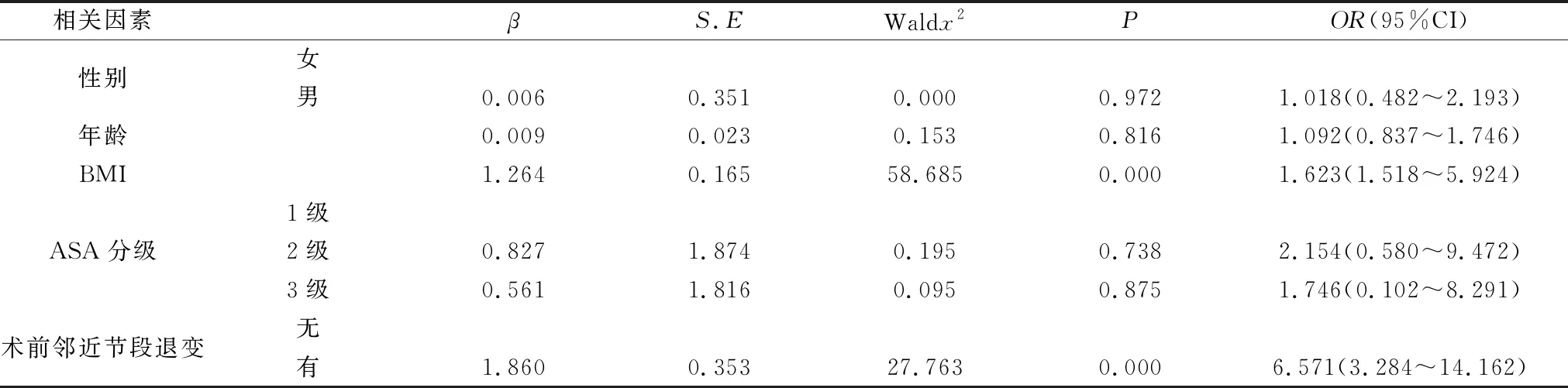
表7 LSS患者行后路减压融合术后出现ASD的影响因素Logistic回归分析
3 讨论
目前,关于腰椎融合术后ASD的原因分析较多,包括患者个体因素(年龄、BMI等),手术因素(融合节段数量、融合方式等),以及脊柱-骨盆矢状位失衡等[6]。部分研究已证实,术前邻近节段退变是腰椎融合术后发生ASD的独立风险因素[7]。但关于术前邻近节段退变的观察角度、术前退变对LSS患者术后疗效的影响,及其对LSS患者术后ASD发生情况的影响,均少见有系统性文献分析。本研究逐一探讨如下:
3.1 术前邻近节段退变对LSS患者术后疗效的影响
表5-6中可见,A、B组患者末次随访时的上述指标均获显著改善(P<0.05),但A组JOA评分高于B组(P<0.05);结果说明,术前存在邻近节段退变对患者行腰椎融合术后的神经功能恢复有一定影响。此外,B组患者中,ASD亚组在末次随访时的腰痛VAS评分和ODI指数均高于无ASD亚组(P<0.05);结果说明,术前存在退变的患者,随着术后ASD的加重,对患者腰痛和腰椎功能障碍的改善效果已产生一些不利影响。笔者分析可能的原因:①当责任节段接受腰椎减压融合手术后,术前邻近节段退变相关的轻微症状、体征得以显露,从而对术后恢复产生影响;②术前邻近节段已产生退变,由于责任节段融合术后丧失了活动功能,导致邻近节段的生物力学环境发生明显变化,加速其退变进程,从而使患者术后的腰痛和功能障碍改善效果受到影响。
本研究随访时间较短(平均27.3月),虽然术后出现了47例ASD ,但无一例为出现严重症状的ASDis患者,因此尚不能确定术前邻近节段退变对LSS患者术后远期疗效的影响。此外,表3中可见,B组术后ASD的发生率显著高于A组(62.3%vs20.6%,P<0.05);表7中也证实,术前存在邻近节段退变和BMI均为患者术后发生ASD的独立风险因素(P<0.05)。结果说明,术前存在退变对患者术后ASD的发生也产生了重要影响。
3.2 术后邻近节段退变的影像学变化特征
临床中,腰椎融合术后ASDis面临翻修手术的主要原因,多为邻近节段椎管狭窄程度加重、压迫神经根导致严重症状[8-9]。因此,单纯对邻近节段椎间盘或小关节的退变程度进行探讨,则忽略了其椎管狭窄的情况,也难以从整体上评价术后邻近节段的退变情况。为此,本研究同时将椎间盘退变和椎管狭窄作为术后邻近节段退变的主要观察指标。其中,椎管狭窄的判定依据是参考Nakashima[10]、Yugué[11]和Lee[5]等的研究方案后,决定以Lee等[5]的方法作为标准,该分级标准较为简便直观,可信度较高。
表3-4可见,A、B两组患者术后ASD的影像学改变均以椎管狭窄为主,分别占比9/14和24/33;而椎间盘退变Pfirrmann分级在末次随访时并未有明显加速。这与Cheh等[9]的结论较为一致,他们对188例患者融合术后随访5年以上,42.6%(80/188)的患者发生了ASD,30.3%(57/188)的患者则出现ASDis,其中椎管狭窄者占比最高、达82.5%(47/57)。Okuda等[12]也得出类似结论。笔者分析其生物力学原因在于:腰椎融合手术后,邻近节段的生物力学变化主要表现为应力增加和活动度的代偿性增加。活动度的增加,主要源于椎间盘和后方韧带、小关节退变。但是在术后早期,因椎间盘存在弹性形变的限制,因而其活动度的增加更多地来源于后方关节囊韧带和黄韧带的拉伸,以及小关节活动范围的增加,易引起后方韧带拉伸褶皱和小关节退变,从而加重椎管狭窄程度。但这一观点仅为推测,目前尚缺乏三维有限元分析和临床数据的证实。
总之,术前邻近节段退变对LSS患者行腰椎减压融合手术疗效和术后ASD均有一定影响;此外,椎管狭窄是术后ASD发生的主要影像学变化,术前对邻近节段退变的评估中应高度重视。
