核因子NF-κB抑制剂PDTC对胶质瘤干细胞放疗增敏的效用研究
2022-10-17邓庆芬刘晓丽周玉璞
邓庆芬 刘晓丽 周玉璞
胶质瘤干细胞具有侵袭性、成瘤性强的双重特点,同时对放疗、化疗存在较明显的抵抗性。核因子-κB(NF-κB)为诱导性转录因子,是主要的细胞存活通路,在人体多种生理活动中发挥重要作用,还可以抑制肿瘤细胞凋亡[1-2]。有报道显示[3-4],放射治疗后NF-κB通路可发挥抑制放射治疗诱导的细胞凋亡,进而在胶质瘤干细胞中放化疗抵抗中起到关键性作用。但目前相关研究较少,故本研究观察核因子-κB(NF-κB)抑制剂四氢化吡咯二硫代氨基甲酸酯(PDTC)对放射治疗诱导的胶质瘤干细胞凋亡的影响。现报告如下。
1 材料与方法
1.1 材料
胶质瘤干细胞3#(购于中国科学院昆明动物研究所),PDTC购自上海碧云天公司。人小脑胶质细胞HAC(通派(上海)生物科技有限公司)、溶剂DMSO(Sigma,美国),FBS(Gibco,美国),双抗(100 X)P/S(上海碧云天公司),Trypsin(Abcam,中国),Phosphate缓冲液(南京森贝伽生物科技有限公司),MTS比色试剂盒(上海宸功生物技术有限公司),液体DMEM/F-12(上海泽叶生物科技有限公司),Triton X-100(上海信裕生物科技有限公司),Annexin V-FITC(杭州昊鑫生物科技股份有限公司)。
1.2 方法
1.2.1 胶质瘤干细胞的培养 以1∶150 的比例用PBS稀释后以2.5 mL/6cm皿的比例铺板,4~8 h后将PBS吸出,将长至3/4 左右密度的胶质瘤干细胞3#细胞消化后用5倍体积的DMEM/F-12停止消化;离心后分离收集胶质瘤干细胞3#,用干细胞培养液重悬细胞后传入铺有laminin的6 cm器皿中,待细胞状态良好时开始实验(48~72 h 后)[5]。正常人小脑胶质细胞,无需铺laminin,0.25% Trypsin 消化后,应用常规培养基培养。
1.2.2 总RNA提取、反转录和PCR反应 细胞中加入Trizol(上海源叶生物科技有限公司)进行冰上裂解,然后依次进行萃取、沉淀RNA、乙醇清洗等提取细胞总RNA。按照反转录试剂盒(美国Thermo Scientific)的说明书进行操作,反转录为cDNA。之后加入SYBR Green Realtime PCR Master Mix(日本ToYoBo)和相应的上下游引物,放入Real-time PCR仪中,根据说明书要求设置相应反应条件。反应结束后,参考2-△△Ct方法计算研究数据。
1.2.3 X线照射 将细胞放在Rad Source RS2000pro 生物学X射线辐照仪样品箱中,常用照射剂量率为1 Gy/min,按照本研究所需要照射剂量(8 Gy)设置照射时间。照射结束后常规换液,将细胞放在培养箱中继续培养48 h。
1.2.4 分组 将细胞分成C组(加二甲基亚砜30 μmol/L)、PDTC组(30 μmol/L,加PDTC)、放疗组(8 Gy,加二甲基亚砜30 μmol/L)和PDTC联合放疗组。每组均加入相应PDTC或二甲基亚砜预处理2 h后进行8 Gy的放射线照射,培养结束后收集细胞进行观察指标的测定。
1.2.5 Western blot蛋白浓度检测 采用聚丙烯酰氨凝胶电泳法进行NF-κB蛋白测定,电泳实验结束后,采用200 mA恒流转膜,将NF-κB蛋白转移到硝酸纤维素膜上,室温下,采用5%脱脂奶粉对膜封闭60 min,孵育相应一抗(1∶500)4 ℃ 12 h。洗涤后加入对应的二抗(1∶2000)孵育60 min。洗涤后在无光条件下采取增强化学发光法进行显色[6]。
1.2.6 细胞凋亡检测 对所有细胞进行2次洗涤。加入200~500 μL的缓冲液重悬细胞,然后避光条件下加入2∶1的LAnnexin与PI充分混匀,开始凋亡染色,室温条件下,避光孵育15 min,流式细胞仪上机检测[7]。
1.3 统计学处理
数据采用SPSS 20.0软件分析,实验结果用LSD-t检验对各组结果进行对比,当P<0.05 为差异有统计学意义。
2 结果
2.1 放疗对胶质瘤干细胞中NF-κB蛋白表达影响
X线照射后,胶质瘤干细胞中NF-κB蛋白表达明显增加,与C组比较差异有显著性(P<0.05);而PDTC可下调NF-κB蛋白表达,差异有统计学意义(P<0.05)。见表1。

表1 放疗对胶质瘤干细胞中NF-κB蛋白表达影响
2.2 PDTC联合放疗对胶质瘤干细胞凋亡的影响
PDTC组、放疗组和联合组的胶质瘤干细胞凋亡率与C组比较,依次半圆(1.50±0.16)倍、(2.48±0.15)倍、(6.55±0.24)倍,表明PDTC联合放疗时胶质瘤干细胞凋亡明显增加。各组胶质瘤干细胞凋亡率见图1。
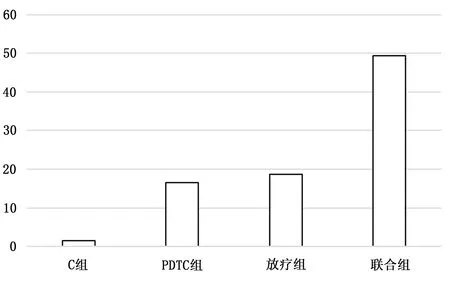
图1 PDTC联合放疗对胶质瘤干细胞凋亡的影响
3 讨论
胶质瘤干细胞具有两大特点,一是无限的增殖能力,二是持续的自我更新能力。不仅如此,胶质瘤干细胞还与胶质瘤的复发、转移及抗药有关[8-9],为此,针对胶质瘤干细胞的药物治疗,越来越多的学者认可其可能成为胶质瘤治疗新途径[10-11]。报道显示[12],活化的NF-κB是同胶质母细胞瘤相关的重要转录因子之一,可通过抑制细胞凋亡、侵袭、免疫和炎症激活等作用在肿瘤的发生、转移中起促进作用。以往有报道显示[13-15],NF-κB活化与胶质瘤级别和恶性程度存在一定的相关性,并且与胶质瘤患者的预后存在紧密的联系。
本研究显示,X线照射后,胶质瘤干细胞中NF-κB蛋白表达明显增加,与C组差异有显著性(P<0.05)。表明放疗后胶质瘤干细胞中NF-κB通路被活化。同时结果还发现与C组比较,PDTC组NF-κB蛋白表达下降,与PDTC组比较,放疗组NF-κB蛋白表达增加,与放疗组比较,联合组NF-κB蛋白表达下降。表明加入NF-κB通路抑制剂后可下调NF-κB蛋白表达。细胞凋亡情况显示,PDTC组、放疗组和联合组的胶质瘤干细胞凋亡率均较C组增加显著,且联合组增加更加显著。表明胶质瘤干细胞X线照射后细胞凋亡率明显增加,而联合PDTC后胶质瘤干细胞凋亡明显增加,进一步表明PDTC对胶质瘤干细胞放疗有增加其敏感性的作用。
综上所述,NF-κB通路在胶质瘤干细胞的放射治疗中具有重要作用,并可以作为对胶质瘤干细胞放疗增加敏感性的重要靶点。但本研究尚存在一定不足,如NF-κB通路在机体生理过程中作用广泛,在多种生理过程中发挥作用,而本研究未对PDTC抑制NF-κB通路的具体机制进行深入研究,故未来应对其具体作用机制进行深入研究。
