HMB在小鼠急性呼吸窘迫综合征相关ICU获得性衰弱中的作用及其机制
2022-10-16潘晓佳徐朝霞林宁林正霄赵磊冯健李福祥
潘晓佳,徐朝霞,林宁,林正霄,赵磊,冯健*,李福祥*
1西南交通大学医学院,四川 成都 610031;2西部战区总医院重症医学科,四川 成都 610083;3西部战区总医院营养科,四川 成都 610083
ICU获得性衰弱(ICU-acquired weakness,ICUAW)是危重症患者常见的获得性神经肌肉功能障碍,中后期患者的病死率及致残率居高不下[1-2]。但目前尚无有效的干预措施能持续地预防危重症患者的肌肉损失,主要原因在于其发病机制不完全清楚。既往研究表明,E3泛素连接酶的肌环指蛋白1(muscle ring finger protein l,MuRF1)及肌萎缩盒F蛋白(atrogun 1/muscle atrophy F-box,Atrogin1/MAFbx)与肌肉蛋白质的降解密切相关,在ICU-AW发病过程中发挥重要作用[3]。另有研究表明,叉头框蛋白O(forkhead box O,FoxO)能够通过磷酸化与非磷酸化的转化调控MuRF1及Atrogin1的表达[4-6]。在FoxO蛋白家族成员中,FoxO3a缺失较少受到其他因素的补偿,表明FoxO3a是萎缩程序的关键因素。而蛋白激酶B(protein kinase B,Akt/PKB)对FoxO3a的表达及磷酸化/非磷酸化转化过程具有调控作用[7],当FoxO被Akt磷酸化后,会向细胞质中转位,从而失去对肌萎缩基因的调控作用;非磷酸化的FoxO位于细胞核中,可通过促进肌萎缩基因MuRF1及Atrogin1等的表达,加剧肌萎缩[8]。上述研究提示,Akt-FoxO3a-MuRF1/Atrogin1信号通路在骨骼肌蛋白降解途径中发挥着重要作用,但其在ICU-AW中的作用机制尚不完全清楚。β-羟基-β-甲基丁酸(β-hydroxy-β-methylbutyrate,HMB)是一种安全有效的营养补充剂,也是必需支链氨基酸亮氨酸的代谢物[9]。有文献报道,HMB可用于增强骨骼肌的质量及强度,在老年人及癌症相关的恶病质患者中,补充HMB可以减少骨骼肌萎缩[10-11],但其具体的作用机制以及是否通过Akt-FoxO3a-MuRF1/Atrogin1这一经典信号通路发挥作用尚不清楚。因此,深入研究HMB改善骨骼肌萎缩的机制对ICU-AW的防治具有重要意义。本研究观察了HMB对急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)相关的ICU-AW小鼠骨骼肌形态学及功能的影响,并探讨了其作用机制,以期为ICU-AW的防治提供新思路。
1 材料与方法
1.1 实验动物 8~10周龄SPF级雄性C57BL/6小鼠60只,体重(27.2±1.3) g,购自成都达硕实验动物有限公司[动物许可证号:SCXK(川)2020-030]。动物SPF级常规饲养,室温维持在20~25 ℃,12 h光照与黑暗交替,给予常规饲料自由饮食,正式实验开始前适应性饲养2周。本研究获得西部战区总医院实验动物伦理委员会批准(批准号:2020ky025),实验过程符合国家及单位有关实验动物的管理及使用规定。
1.2 主要试剂 HMB购于上海麦克林生物科技股份有限公司,大肠埃希菌(O55:B5L2880)脂多糖(LPS)购于美国Sigma公司,全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒均购于北京索莱宝科技有限公司,抗体MuRF1、Atrogin1及山羊抗兔二抗均购于英国Abcam公司,抗体β-tubulin、Akt、p-Akt、FoxO3a、p-FoxO3a均购于美国Cell Signaling公司,qRT-PCR引物购于四川生工科技有限公司。
1.3 研究方法
1.3.1 动物分组及模型建立 选取40只小鼠,采用随机数字表法分为对照组、假手术组、模型组及HMB组,每组10只。按照Files等[12]的方法于小鼠气管内滴注LPS,建立ARDS相关ICU-AW模型,动物术前称重、编号,禁食12 h,自由饮水。于小鼠腹腔注射1%戊巴比妥钠(50 mg/kg),待麻醉生效后将动物仰卧固定于操作台上,颈部正中切开5~8 mm,钝性分离皮下组织,暴露气管。用微型注射器由气管向肺分向注射,模型组及HMB组小鼠气管内注入3 μg/g LPS,1 min内注射完毕;假手术组给予等体积生理盐水,注射后立即将动物直立并旋转,使药物均匀分布于两肺。缝合皮肤,待小鼠苏醒后放回饲养笼。自模型建立第2天开始,HMB组以340 mg/(kg·d) HMB灌胃[13],其余3组给予等体积生理盐水,连续给药2周。另取与HMB组相同处理的小鼠20只,随机分为ARQ-092组与Akt抑制剂对照组,每组10只。在0.01 mol/L磷酸载体(pH值7.25)中配制ARQ-092,从造模后第2天开始,ARQ-092组在HMB灌胃10 h后口服100 mg/kg ARQ-092[14-15],1次/d,持续12 d,Akt抑制剂对照组给予等体积磷酸载体。
1.3.2 肌肉力量评估 造模开始至第16天,每天用无创爪抓力测试仪测量小鼠前肢肌肉抓力[16-17]。将小鼠的前肢放在爪抓力测试仪金属板上,逐渐向后拉,当小鼠爪子松开时会收缩肢体,此时,金属板连接着的力传感器可测量当前产生卸力的量程,此数据为小鼠当次的抓力值,连续测量5次,结果取平均值[18]。
1.3.3 肌肉减少指数(sarcopenia index,SI)检测 造模第16天后处死小鼠,称量各组小鼠体重并记录。采用戊巴比妥钠麻醉小鼠,分离腓肠肌并剔除肌腱等结缔组织,取出腓肠肌后浸入生理盐水,洗去附着的血液,称量前用滤纸吸除多余的生理盐水及组织液,称量骨骼肌质量,计算小鼠腓肠肌质量(mg)与体重(g)的比值,即SI。
1.3.4 肺组织及肌肉组织病理学检查 取造模48 h小鼠的肺组织及干预完成后小鼠的腓肠肌,迅速放入4%多聚甲醛溶液中固定48 h,脱水,常规石蜡包埋,4 μm厚度切片,按照HE染色试剂盒操作说明书步骤进行HE染色,并在光学显微镜下观察、拍照。
1.3.5 qRT-PCR检测相关基因mRNA的表达 采用qRT-PCR检测腓肠肌中Akt、FoxO3a、MuRF1及Atrogin1mRNA的表达水平,引物序列见表1。采用Trizol法提取腓肠肌组织标本中的总RNA,离心、洗涤、再溶解,测定总RNA纯度及浓度。一步法qRT-PCR反应条件:反转录反应42 ℃ 5 min,95 ℃10 s;PCR反应95 ℃ 15 s,63 ℃ 1 min,共40个循环。每孔为总体积25 μl含RNA的反应液,每组2~3个复孔。以GAPDH作为内参照,采用2–ΔΔCt法计算各组目的基因的相对表达量。

表1 基因引物序列Tab.1 Primer sequences of genes
1.3.6 Western blotting检测腓肠肌中Akt、p-Akt、FoxO3a、p-FoxO3a、MuRF1及Atrogin1蛋白相对表达量 裂解腓肠肌组织,提取总蛋白,采用BCA法进行蛋白定量,经SDS-PAGE电泳、转膜、封闭后,加入相应的一抗Akt(1:1000)、p-Akt(1:1000)、FoxO3a(1:1000)、p-FoxO3a(1:1000)、Atrogin1(1:1000)、MuRF1(1:1000)、α-Tubulin (1:2000),4 ℃孵育过夜,TBST漂洗3次后加入相应的辣根过氧化物酶标记二抗(1:2000)孵育1 h,TBST漂洗3次,每次10 min。洗膜后DAB显色,采用凝胶图像分析系统拍照,以α-tubulin为内参照,对目的基因条带灰度值进行统计分析。
1.4 统计学处理 使用GraphPad Prism V5及SPSS 20.0软件进行制图及数据分析。计量资料以±s表示,符合正态分布且方差齐时,多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验;两组间比较采用t检验;方差不齐时采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肺组织及腓肠肌组织形态比较 利用气管内滴注LPS建立ARDS相关ICU-AW小鼠模型,造模48 h的肺组织HE染色结果显示,对照组及假手术组小鼠肺泡结构完整,无损伤表现;模型组及HMB组出现肺间质水肿,中性粒细胞浸润,肺泡间隔增宽、结构紊乱,表明气管内滴注LPS的小鼠有明显的ARDS病理表现(图1A)。HMB干预2周后腓肠肌HE染色结果显示,对照组及假手术组小鼠肌束结构完整,肌纤维排列紧密,大小形态正常,未见细胞碎裂、溶解,两组间无明显差异;与对照组及假手术组比较,模型组出现肌肉萎缩及不同程度的肌束结构破坏,可见细胞数量减少,肌纤维排列更为疏松,横截面积减少;与模型组比较,HMB组小鼠腓肠肌损伤程度减轻(图1B)。
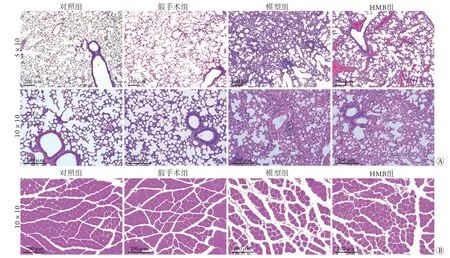
图1 各组小鼠肺组织(A)及腓肠肌组织(B)病理学表现Fig.1 Pathological appearance of lung tissues (A) and gastrocnemius tissues (B) of mice in each group
2.2 HMB对ARDS相关ICU-AW小鼠骨骼肌力量及SI的影响 各组小鼠造模前抓力值比较差异无统计学意义(P>0.05);第2、3、4天,与对照组比较,假手术组小鼠抓力值降低(P<0.05);第1~16天,与对照组及假手术组比较,模型组小鼠抓力值均降低(P<0.05);第3~16天,与模型组比较,HMB组小鼠抓力值均升高(P<0.05,图2A)。与对照组比较,假手术组小鼠SI无明显变化(P>0.05),模型组小鼠SI则明显降低(P<0.05);与模型组比较,HMB组小鼠SI明显升高(P<0.05),但模型组与对照组及假手术组比较,差异均无统计学意义(P>0.05,图2B)。
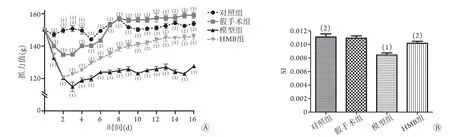
图2 各组小鼠抓力值(A)及SI(B)比较(n=10)Fig.2 Comparison of grasping force (A) and SI (B) of mice in each group (n=10)
2.3 HMB对ARDS相关ICU-AW小鼠Akt-FoxO3a-MuRF1/Atrogin1信号通路的影响 qRT-PCR检测结果显示,对照组及假手术组小鼠腓肠肌组织中Akt、FoxO3a、MuRF1及Atrogin1的mRNA表达水平比较差异均无统计学意义(P>0.05);与假手术组比较,模型组小鼠腓肠肌组织中Akt和FoxO3a的mRNA表达水平明显降低(0.35±0.09vs.1.10±0.12;0.32±0.08vs. 1.04±0.12,P<0.05),Atrogin1的mRNA表达水平明显升高(1.55±0.23vs.0.99±0.24,P<0.05),MuRF1的升高趋势更明显(2.79±0.27vs. 1.12±0.14,P<0.05,图3A);而HMB干预则逆转了这一趋势。Western blotting结果与qRT-PCR结果趋势一致(图3B、C)。
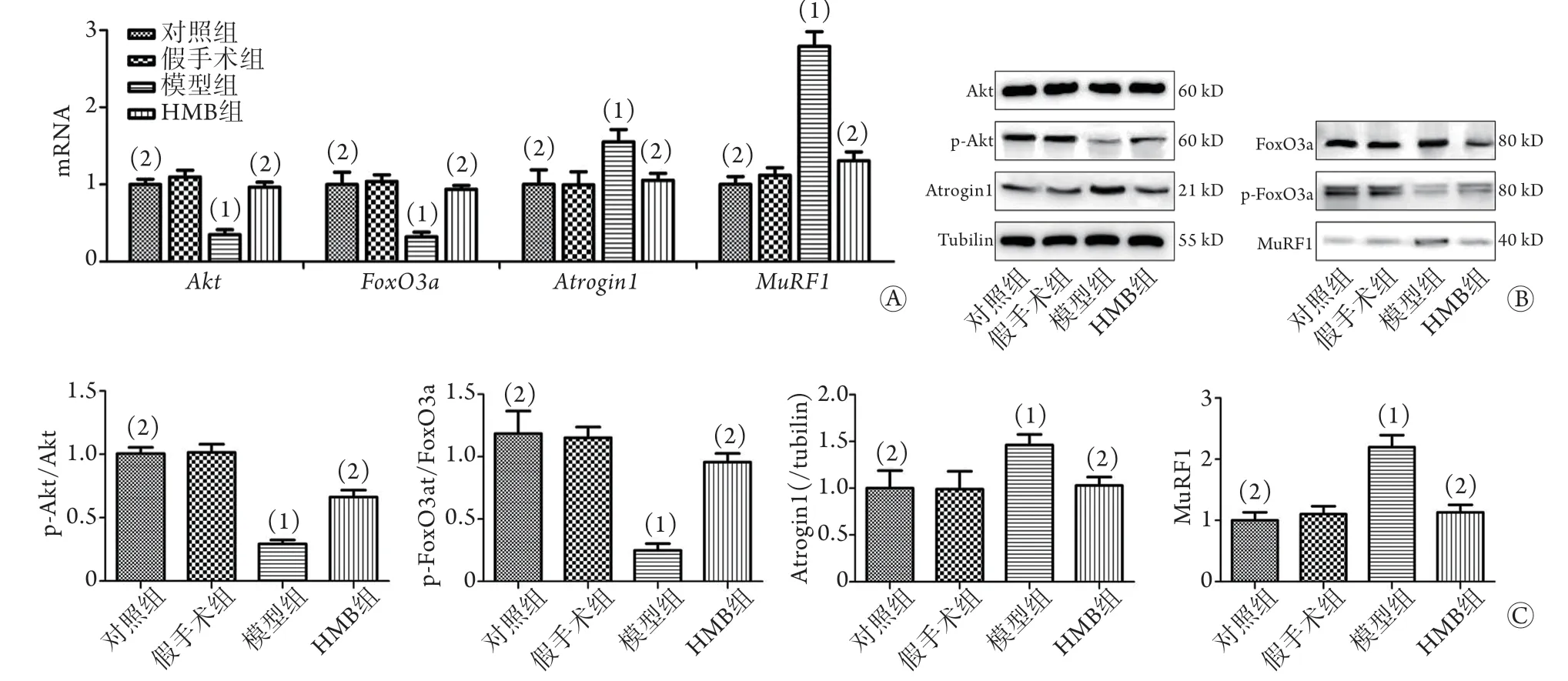
图3 HMB干预对Akt-FoxO3a-MuRF1/Atrogin1信号通路mRNA及蛋白表达的影响Fig.3 Effects of HMB intervention on mRNA and protein expression of Akt-FoxO3a-MuRF1/Atrogin1 signaling pathway
2.4 Akt抑制剂ARQ-092对HMB保护作用的影响造模第5~16天,ARQ-092组抓力值及SI均低于Akt抑制剂对照组(P<0.05,图4A、B)。腓肠肌组织HE染色结果显示,ARQ-092组较Akt抑制剂对照组的细胞数量减少,肌纤维横截面积缩小,排列疏松(图4C)。qRT-PCR结果显示,与Akt抑制剂对照组比较,ARQ-092组Akt及FoxO3a的mRNA表达水平均明显降低(0.35±0.07vs. 0.97±0.18;0.50±0.10vs. 1.08±0.15,P<0.05);Atrogin1及MuRF1的mRNA表达水平均明显升高(1.49±0.18vs. 1.00±0.08;2.81±0.26vs. 1.39±0.27,P<0.05,图4D)。Western blotting结果与qRT-PCR结果趋势一致(图4E、F)。
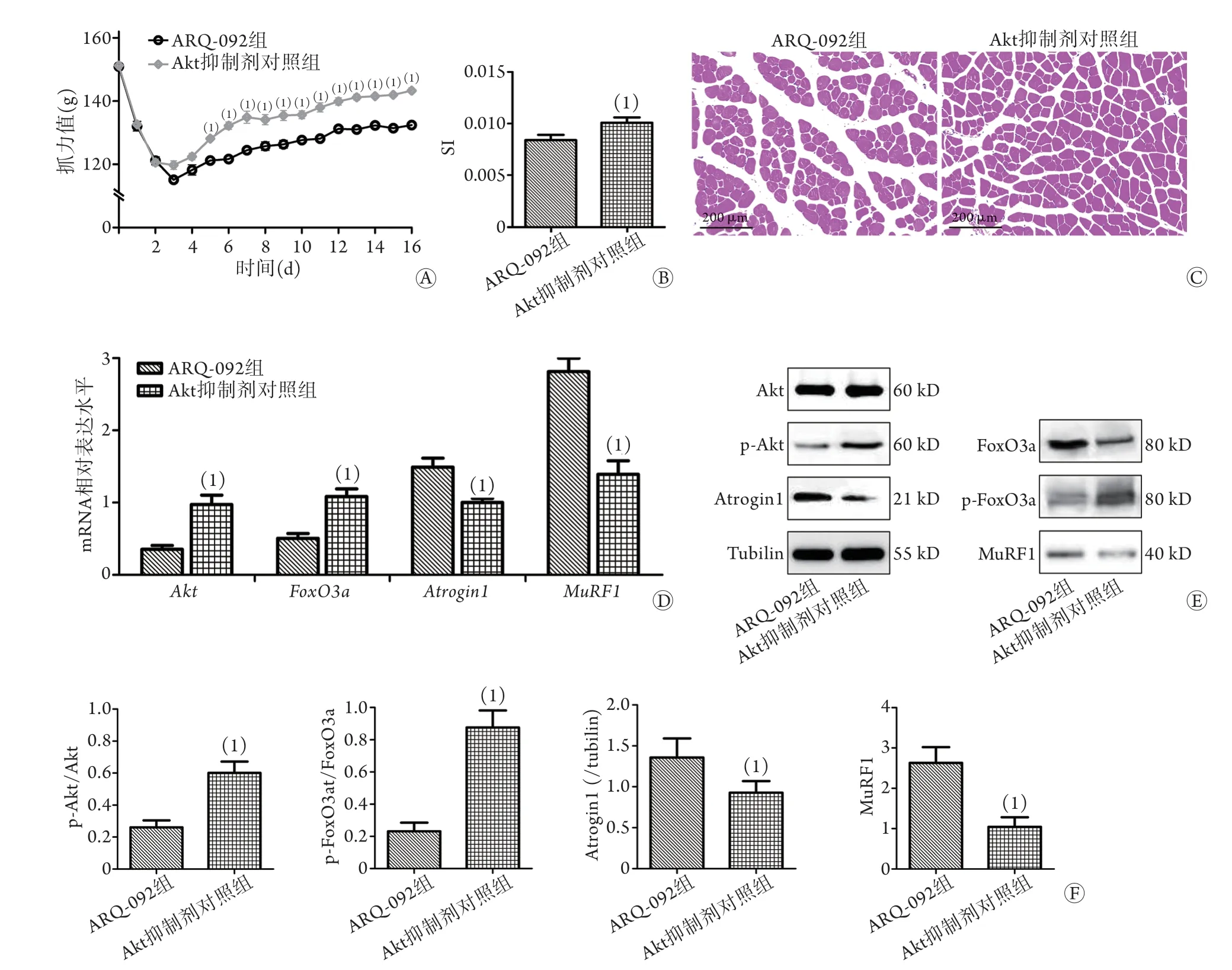
图4 Akt抑制剂ARQ-092对HMB保护作用的影响Fig.4 Effect of Akt inhibitor ARQ-092 on HMB protection
3 讨 论
大量研究表明,脓毒症是ICU-AW发生发展的主要危险因素,肺部感染相关ICU-AW是导致患者病死率及长期罹病率较高的重要因素[19]。ICU-AW的病死率居高不下,严重威胁患者健康,并给家庭及社会造成沉重的经济负担,关于ICU-AW的研究已成为近年来研究的热点。为深入探讨ICU-AW的发病机制,本研究采用Files等[12]的方法建立ARDS相关ICUAW小鼠模型,该模型成功复制人类ICU-AW相关肌肉萎缩的一些关键特征,包括严重的骨骼肌萎缩、与ARDS相关的无力、与肌肉功能下降相关的肌肉收缩蛋白的优先丧失、ARDS消退后的肌肉无力持续存在等,提示该ARDS相关ICU-AW小鼠模型可作为本研究的理想动物模型,为下一步研究ICU-AW的发病机制及治疗措施创造了有利条件。
HMB是必需氨基酸亮氨酸的一种内源性代谢物,目前已在人类及动物模型中对HMB开展了深入研究。在动物模型中,HMB可有效减轻脓毒症引起的膈肌无力及地塞米松诱导的肌肉萎缩[20-21];在临床人群中,HMB已被证实可减轻癌症恶病质、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、获得性免疫缺陷综合征、肝硬化及肌肉减少症患者或虚弱老年人的肌肉萎缩[22-24]。本研究结果显示,经HMB治疗后,ARDS相关ICU-AW小鼠的骨骼肌抓力值明显升高,表明HMB具有保护骨骼肌功能的作用。另外,本研究还发现,HMB能明显增加ICU-AW小鼠的腓肠肌质量并升高SI。小鼠腓肠肌组织病理切片显示,与模型组比较,HMB组肌束中由肌膜围绕的肌纤维排列更加规则有序,肌纤维及肌束的横截面积增加,炎性细胞浸润少,损伤程度更轻,证实HMB治疗能减轻ICU-AW小鼠的骨骼肌萎缩,并提高骨骼肌的力量,保护ICU-AW小鼠的骨骼肌,这与上述研究结果一致。
既往研究表明,蛋白质降解与合成失衡是ICUAW骨骼肌萎缩的主要机制之一[25]。当蛋白质降解率超过合成时会导致肌肉萎缩,其中蛋白质降解主要与泛素-蛋白酶体途径的激活有关[8]。泛素-蛋白酶体系统中的两种主要标志物Atrogin1及MuRF1的过表达可以促进肌肉蛋白质分解及肌肉萎缩,进而参与ICU-AW的发生发展。因此,深入研究Atrogin1及MuRF1的调控机制,对骨骼肌蛋白降解及ICUAW的防治具有重要意义。FoxO3a是骨骼肌蛋白水解途径中的重要分子,且能够通过诱导自噬相关基因表达参与骨骼肌功能的调控[26],因而受到研究者关注。FoxO3a具有磷酸化及非磷酸化两种状态,非磷酸化的FoxO3a能够上调骨骼肌中的Atrogin1及MuRF1表达,从而加速蛋白降解,引起骨骼肌萎缩,而FoxO3a磷酸化与非磷酸化状态的转化受Akt调控,活化的Akt能够促进FoxO3a由非磷酸化转为磷酸化状态,从而通过阻止Atrogin1及MuRF1表达来减轻骨骼肌萎缩[6,27-28]。由此可见,Akt-FoxO3a-MuRF1/Atrogin1信号通路在骨骼肌蛋白降解过程中具有重要作用。本研究采用qRT-PCR及Western blotting评估mRNA及蛋白表达,结果显示模型组小鼠腓肠肌组织中Akt及FoxO3a的mRNA表达水平明显下降,磷酸化水平明显降低,MuRF1及Atrogin1的表达明显增加,提示ICU-AW小鼠骨骼肌分解代谢水平升高。HMB干预使Akt及FoxO3a的mRNA表达水平及磷酸化水平均有提高,明显降低MuRF1及Atrogin1的表达,表明HMB可能通过激活Akt/FoxO3a信号通路,促进Akt及FoxO3a的磷酸化,进而抑制MuRF1/Atrogin1介导的骨骼肌分解代谢途径发挥保护作用。本研究为进一步验证这一猜想,采用Akt抑制剂ARQ-092进行干预,结果表明ARQ-092能够逆转HMB对ICU-AW小鼠的保护作用。
综上所述,本研究提示HMB可能通过调控Akt-FoxO3a-MuRF1/Atrogin1信号通路在ICU-AW中发挥保护作用,对ICU-AW的防治具有重要价值。本研究的不足之处在于仅在ARDS相关ICU-AW的蛋白质降解方面进行了观察验证,初步探索了HMB治疗ARDS相关ICU-AW的机制,但缺乏对蛋白质合成、自噬以及细胞凋亡三者之间信号通路的探究,需要后续深入研究予以验证。
