基于术前NLR、LMR、CEA和CA19-9对结肠癌根治术后预后列线图预测模型的构建及评价
2022-10-16蒋永杰寇邦国杜文龙边攀李兵太尹兰宁
蒋永杰,寇邦国,杜文龙,边攀,李兵太,尹兰宁,2*
1兰州大学第二医院普通外科,甘肃 兰州 730030;2兰州大学第二医院西固医院,甘肃 兰州 730060
结肠癌是消化道最常见的恶性肿瘤之一,主要特点为发病率高、预后差,近年来其发病率和病死率在国人癌症中均居第4位,在消化道恶性肿瘤中均居第1位,且呈逐年上升趋势[1-4]。目前绝大多数患者就诊时已处于中晚期,且行结肠癌根治术治疗的患者预后差异较大。因此,制定综合性、个体化的治疗方案,以改善预后,以及寻找有效的影响结肠癌根治术预后的临床病理因素特别是简单、实用、经济的预后影响因素尤为重要。有研究发现,癌症相关炎症反应促进了恶性肿瘤的发生发展,并与患者的生存有关[5]。临床上反映全身炎症反应的常规指标是白细胞(如中性粒细胞、淋巴细胞和单核细胞等)及急性期蛋白。研究发现,中性粒细胞可通过分泌细胞因子和趋化因子促进肿瘤微环境的形成,从而促进肿瘤细胞的增殖和转移[6]。淋巴细胞在癌症免疫监测中起着至关重要的作用,可通过介导细胞毒性和细胞死亡来抑制肿瘤细胞的增殖和生长[7]。因此,中性粒细胞/淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)可反映肿瘤炎症状态与抗肿瘤免疫状态之间的平衡,二者比例失衡可能与肿瘤的发生和发展有关,较高的NLR提示机体可能处于炎症反应激活和抗肿瘤免疫抑制状态[8]。来自外周单核细胞的肿瘤相关巨噬细胞可抑制获得性免疫反应并促进肿瘤细胞的生长和肿瘤滋养层血管生成,进而引起肿瘤侵袭和转移[9]。此外,研究发现,单核细胞还可通过调节中性粒细胞和肿瘤相关巨噬细胞分泌相关细胞因子来影响肿瘤干细胞的活性,从而降低肿瘤对化疗的敏感性[10]。研究发现,NLR和淋巴细胞/单核细胞比值(lymphocyte to monocyte ratio,LMR)作为评价全身免疫炎症相关的重要指标,在结直肠癌的诊断和预后预测中具有一定的临床应用价值[11-13]。此外,循环血癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)是临床常用的消化道恶性肿瘤辅助诊断指标,尤其在结肠癌的辅助诊断中具有较高的特异性,在临床上应用广泛[14-15]。有研究发现,血清CEA、CA19-9水平不仅与结肠癌的发病有关,且与患者预后相关[16-17]。本研究旨在分析术前NLR、LMR、CEA和CA19-9对结肠癌根治术(R0)患者预后的影响,并构建结肠癌根治术后1、2、3年生存率的列线图预测模型,以期为临床提供一种更为便捷的预后预测方式。
1 资料与方法
1.1 研究对象 回顾性分析2014年4月-2018年12月在兰州大学第二医院普通外科行结肠癌根治术的185例结肠癌患者的临床病理资料。纳入标准:(1)经病理检查确诊为结肠癌;(2)临床化验检查及病理资料完整;(3)术前未接受过新辅助放化疗;(4)肿瘤行根治性R0切除;(5)术后行奥沙利铂联合化疗。排除标准:(1)术后发生严重并发症致生存时间<30 d;(2)重复癌或并发直肠癌;(3)既往存在其他恶性肿瘤病史;(4)存在炎症性疾病的感染证据或病史,影响血常规结果;(5)存在精神性疾病或其他严重内科疾病。本研究经兰州大学第二医院医学伦理委员会审批(2022A-039),所有患者均已签署知情同意书。
1.2 方法 按照结肠癌术后标准方案对所有患者进行随访。术后2年内每3个月随访1次,第2~5年每半年随访1次,5年后每年随访1次。随访内容包括血常规,肿瘤标志物(CEA、CA19-9),胸部、腹部和盆腔增强CT,以及肠镜等。结局指标为总生存期(overall survival,OS)和无病生存期(disease-free survival,DFS)。OS定义为手术日期至患者死亡的时间,DFS定义为手术日期至患者因结肠癌发生复发、转移或死亡的时间。末次随访截止时间为2020年7月。
1.3 NLR、LMR、CEA和CA19-9的最佳截断值 采用受试者工作特征(receiver operator characteristic,ROC)曲线分析NLR、LMR、CEA和CA19-9预测结肠癌根治术后患者总生存状态(生存/死亡)的最佳截断值[由约登指数(Youden index)确定,约登指数=灵敏度+特异度-1,在约登指数最大处取最佳截断值],根据NLR、LMR的最佳截断值将患者分为高NLR组与低NLR组、高LMR组与低LMR组。
1.4 列线图预测模型的构建及评价 使用R4.1.1软件分析结肠癌根治术后患者DFS的影响因素,将Cox风险比例回归模型中的独立危险因素引入rms包,绘制列线图。
1.4.1 区分度评价 采用一致性指数(C指数)评价列线图预测模型的区分度,C指数在0.50~0.70为准确度较低,0.71~0.90为准确度中等,高于0.90则为准确度高。
1.4.2 一致性分析 采用校准曲线分析列线图预测模型的一致性,预测模型对应曲线与校准图中45°对角线贴合度越高表明模型预测结果与实际情况一致性越好。
1.4.3 列线图预测模型风险分层 使用X-tile软件根据Cox风险得分对列线图预测模型进行风险分层,以低、中、高风险三个水平分别对应患者预后良好、中等、差三个分组。
1.5 统计学处理 采用SPSS 26.0软件进行统计分析。计量资料以±s表示,两组间比较采用t检验;计数资料以例(%)表示,两组间比较采用χ2检验或Fisher's精确检验。使用Kaplan-Meier法和log-rank检验分析两组生存的差异,使用Cox比例风险回归模型分析影响结肠癌根治术后患者预后的因素。使用GraphPad Prism 7.00软件绘制生存曲线。检验水准为α=0.05。
2 结 果
2.1 一般资料 入选符合纳入排除标准的结肠癌患者2 2 9 例,失访4 4 例,最终纳入1 8 5例。其中男111例(60.0%),女74例(40.0%);年龄23~79(55.0±11.7)岁;临床分期Ⅰ-Ⅱ期98例(53.0%),Ⅲ-Ⅳ期87例(47.0%);NLR为2.98(1.1~48.6),LMR为3.75(0.4~11.4)。185例患者术后1、2、3、5年累计总生存率分别为88.7%、83.8%、82.7%、81.1%,累积无复发生存率分别为83.8%、76.2%、71.9%、66.7%。
2.2 NLR、LMR、CEA和CA19-9预测结肠癌根治术后患者总生存状态的ROC曲线分析 NLR、LMR、CEA和CA19-9预测结肠癌根治术后患者总生存状态的ROC曲线如图1所示,其AUC分别为0.784、0.672、0.727和0.656,最佳截断值分别为3.40、3.25、4.30 ng/ml和21.82 U/ml。
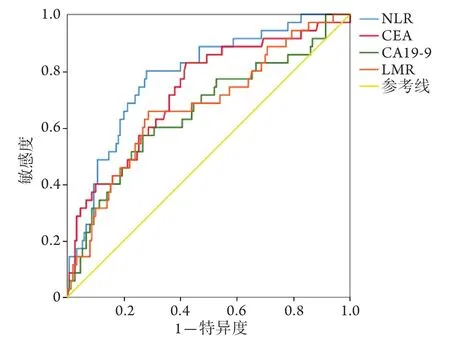
图1 NLR、LMR、CEA和CA19-9预测结肠癌根治术后患者总生存状态的ROC曲线Fig.1 ROC curves of NLR, LMR, CEA and CA19-9 predicting overall survival situation of patients with colon cancer after radical resection
2.3 术前NLR、LMR与结肠癌临床病理特征的关系 根据NLR、LMR的最佳截断值将患者分为低NLR组(≤3.40,n=115)与高NLR组(>3.40,n=70)、低LMR组(≤3.25,n=74)与高LMR组(>3.25,n=111)。高NLR组与低NLR组患者肿瘤浸润深度、肿瘤最大径和术前CEA水平比较,差异有统计学意义(P<0.05);高LMR组与低LMR组患者肿瘤浸润深度、肿瘤部位和肿瘤最大径比较,差异有统计学意义(P<0.05,表1)。
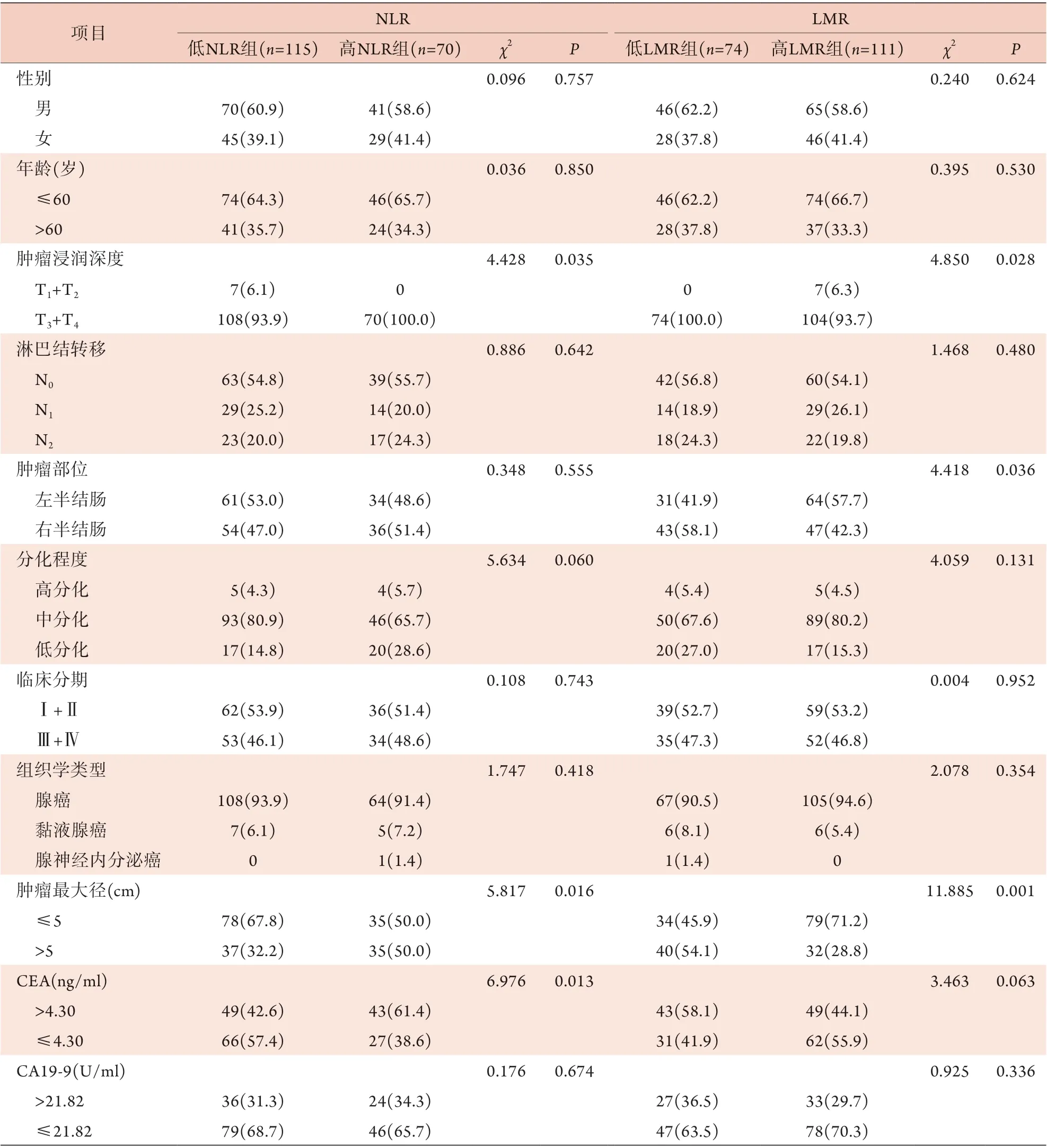
表1 术前NLR、LMR与结肠癌临床病理特征的关系[例(%)]Tab.1 Relationship between preoperative NLR, LMR and clinicopathological features of colon cancer [n(%)]
2.4 结肠癌根治术后患者生存分析 随访截至2020年7月,共随访3~68个月,中位随访时间为32个月,其中52例(28.1%)出现肿瘤复发,死亡35例(18.9%),累积无病生存率为71.89%,累积总生存率为81.08%。Kaplan-Meier法和log-rank检验结果显示,高NLR组患者的OS和DFS明显短于低NLR组,低LMR组患者的OS和DFS明显短于高LMR组(P<0.001)(图2)。
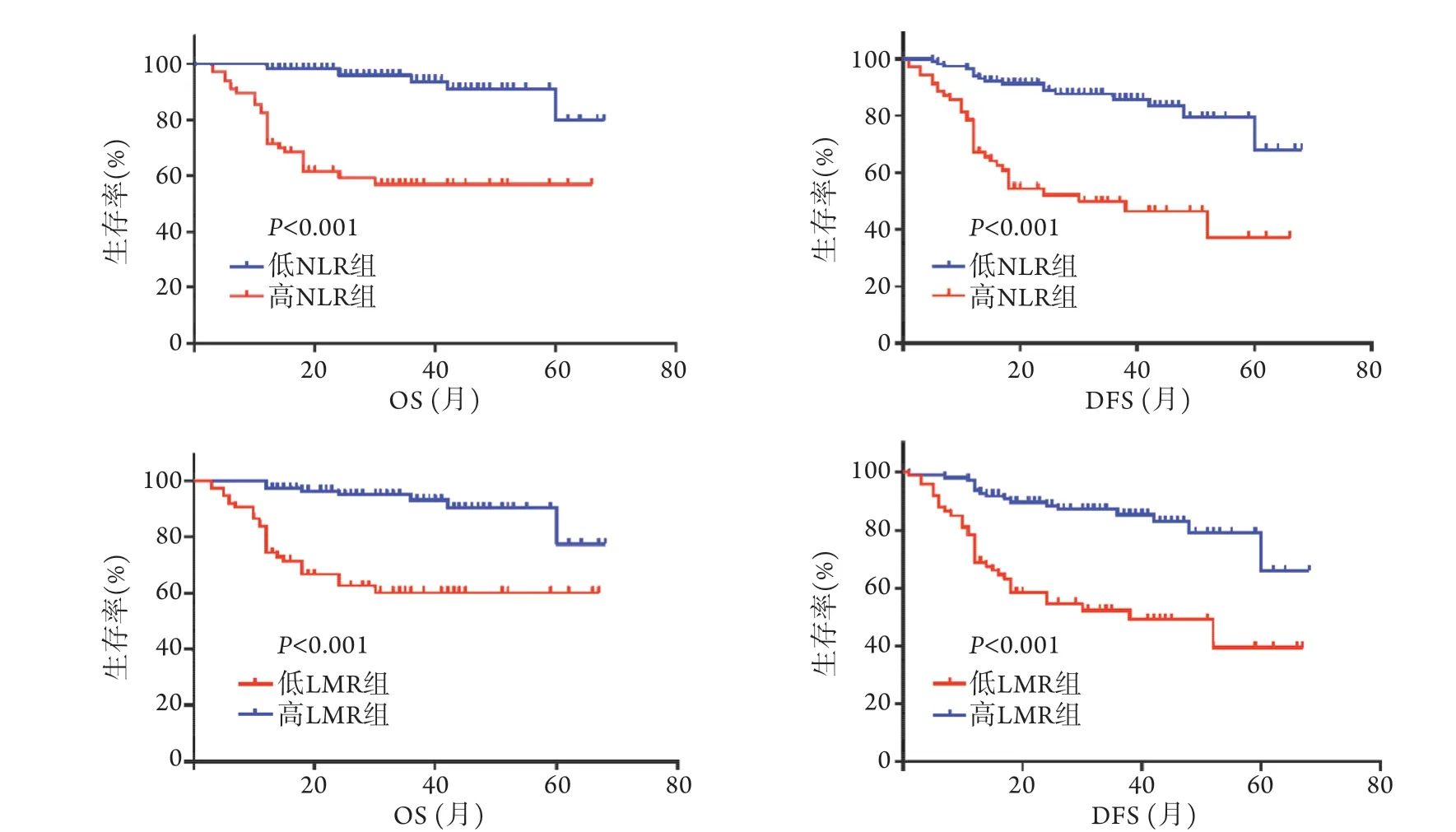
图2 不同NLR、LMR结肠癌患者的总生存期(OS)和无病生存期(DFS)曲线Fig.2 Survival curves of overall survival (OS) and disease-free survival (DFS) of patients with different NLR and LMR
2.5 影响结肠癌根治术后患者生存的单因素和多因素Cox回归分析 单因素分析结果显示,性别、年龄、肿瘤浸润深度、肿瘤分化程度、肿瘤部位和肿瘤最大径与结肠癌根治术后患者的OS和DFS无关(P>0.05),而淋巴结转移、组织学类型、临床分期、NLR、LMR、CEA及CA19-9与结肠癌根治术后患者的OS和DFS有关(P<0.05)(表2)。

表2 影响结肠癌根治术后患者生存的单因素分析Tab.2 Univariate analysis of survival of colon cancer patients after radical resection

(续 表)
将单因素分析中P<0.05的因素纳入多因素Cox回归分析,结果显示,NLR、CEA及组织学类型为结肠癌根治术后患者OS的独立影响因素(P<0.05),而NLR、LMR、CEA、CA19-9及临床分期为结肠癌根治术后患者DFS的独立影响因素(P<0.05),其中LMR为保护性因素(表3)。
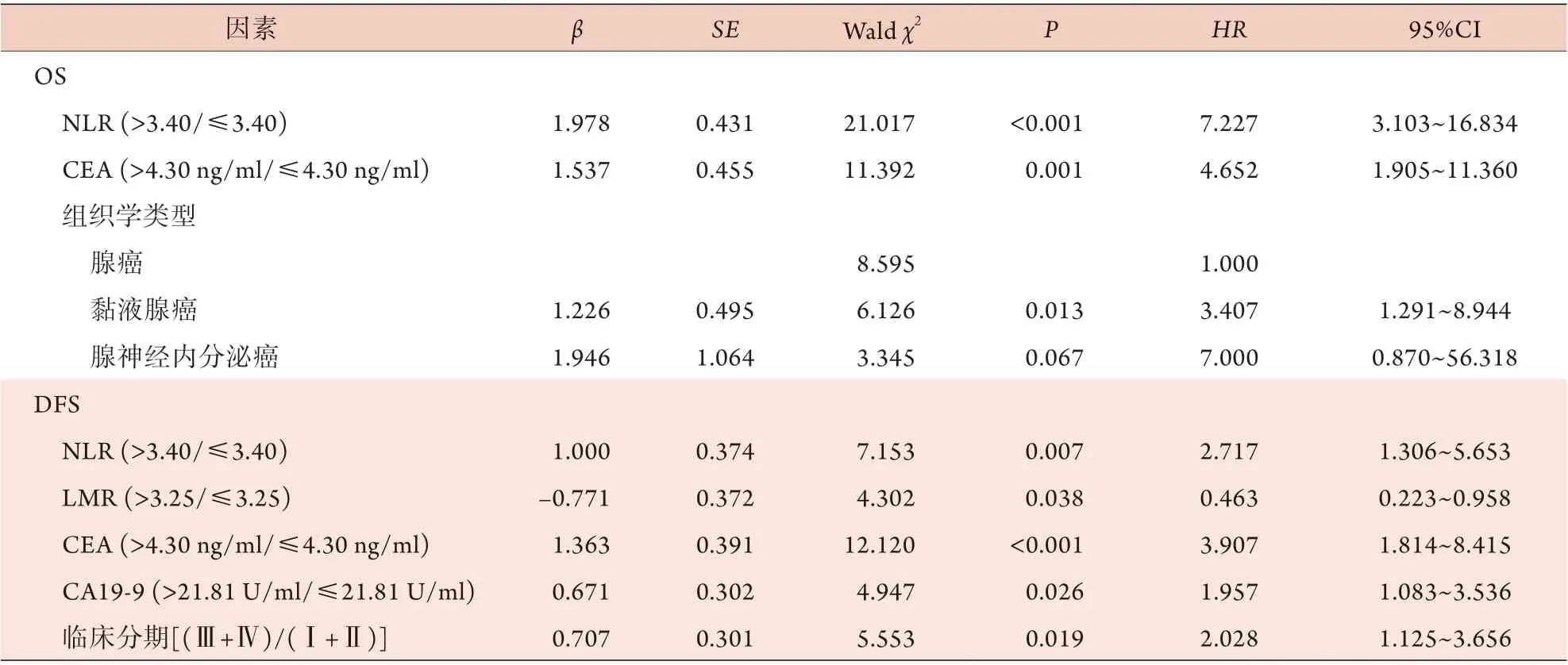
表3 影响结肠癌根治术后患者生存的多因素Cox回归分析Tab.3 Cox regression analysis of survival of colon cancer patients after radical resection
2.6 预测结肠癌根治术后患者1、2、3年DFS的列线图 使用R4.1.1软件,纳入多因素Cox回归分析中影响DFS的因素(NLR、LMR、CEA、CA19-9及临床分期)建立函数模型并绘制列线图,这些因素的每一个数字或类别在分数量表上的分数相加,对应在总分标上,向下画直线,与1、2、3年无病生存率坐标轴的交点表示生存概率(图3)。

图3 预测结肠癌根治术后患者1、2、3年DFS的列线图Fig.3 Nomogram for predicting DFS at 1, 2, and 3 years in colon cancer patients after radical resection
2.7 列线图预测模型的效能评价
2.7.1 区分度评价和一致性分析 列线图预测模型C指数为0.851(95%CI 0.804~0.899),表明该模型具有较好的区分度;一致性分析结果显示,列线图预测模型所得无病生存率曲线与校准图中45°对角线贴合度较高,提示该预测模型有较好的一致性(图4)。
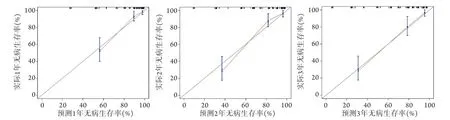
图4 预测结肠癌根治术后患者1、2、3年无病生存率的列线图预测模型校准图Fig.4 Calibration chart of the nomogram prediction model for predicting the 1, 2, and 3 years disease-free survival rate of patients with colon cancer after radical resection
2.7.2 列线图预测模型风险分层 使用R4.1.1软件计算列线图预测模型风险得分,然后使用X-tile软件将该模型根据Cox风险得分分为低(<3.9分)、中(3.9~14.6分)、高(>14.6分)风险三个水平(图5),分别对应患者预后良好、中等、差三个分组,Kaplan-Meier生存曲线分析显示,低风险组的DFS明显优于中、高风险组(P<0.001)。
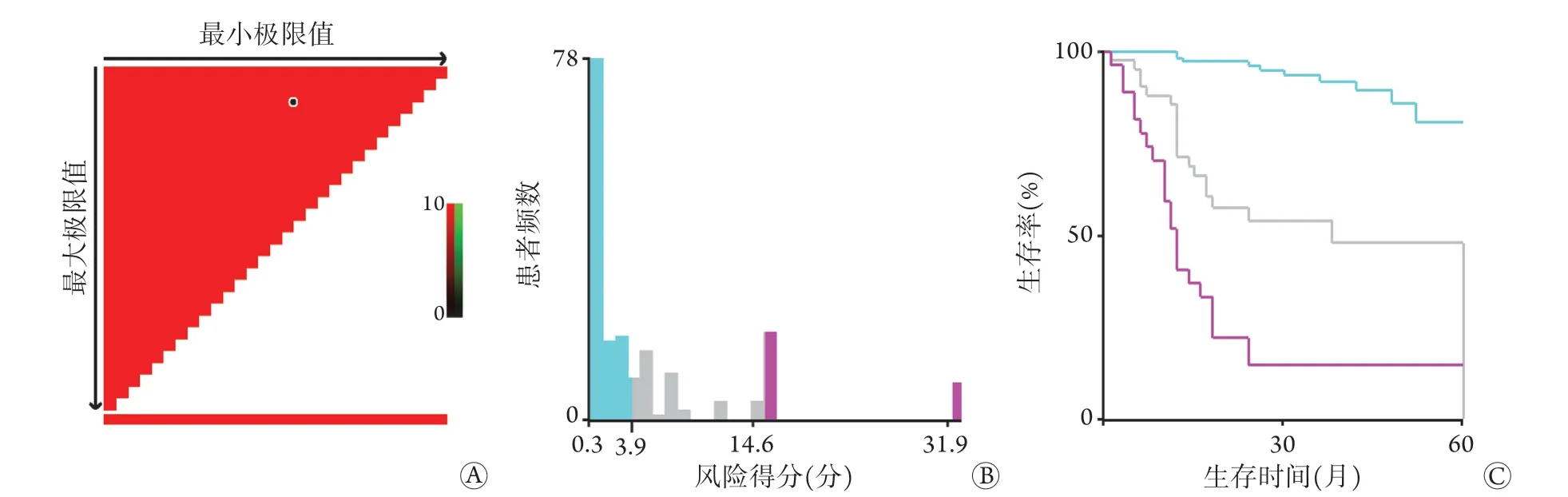
图5 X-tile软件风险分层列线图预测模型Fig.5 X-tile software risk stratification nomogram prediction model
3 讨 论
大量研究发现,炎症与肿瘤的发生发展关系密切[18],肿瘤相关炎症可诱导肿瘤本身或周围细胞表达各种分子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-17等,从而形成可能促进肿瘤进展的微环境[19-21]。Ostan等[22]发现,炎症反应触发了基因突变或表观遗传机制的改变,从而促进了癌症的转移和进展,而干预炎症反应能够降低癌症发生、进展的风险。目前有研究报道,多种炎症相关标志物与结直肠癌患者的预后相关,多种炎性因子联合应用可进一步提高对结直肠癌患者预后的预测效能,其中NLR、LMR是机体炎症反应的标志物,可作为评估结直肠癌患者预后的指标[23-25]。然而由于研究设计和样本量的差异,LMR与结直肠癌患者预后的关系尚存在争议[26]。NLR被证实与肺癌、胃癌、卵巢癌等多种恶性肿瘤的预后明显相关,可作为这些肿瘤的预后指标[27-29],而LMR可作为食管癌、胃癌、乳腺癌等恶性肿瘤的预后评估指标[30-32]。此外,有研究发现,术前血小板/淋巴细胞比值(platelet to lymphocyte ratio,PLR)、预后营养指数(prognostic nutritional index,PNI)和系统免疫炎症指数(systemic immune-inflammation index,SII)可作为结肠癌根治术后患者预后的预测指标,但相关研究结果不一致[33-35]。CEA是一种提取自结肠癌和胚胎组织中的多糖蛋白复合物,其中90%由结直肠癌产生,常与细胞黏附相关,术前CEA水平升高常被认为是预后不良的信号,与结肠癌根治术后总生存率降低存在相关性[36];CA19-9是一种黏蛋白型的糖类蛋白抗原,可介导肿瘤细胞与血管内皮细胞黏附而促使肿瘤发生远处转移,故其可能对转移性结肠癌有一定预测价值[37-38]。
本研究基于术前免疫炎症指标NLR、LMR与肿瘤标志物CEA、CA19-9,联合临床病理特征分析影响结肠癌根治术后患者生存的危险因素,结果显示,高NLR、CEA、CA19-9及低LMR的患者预后较差,与既往研究结果一致[23-24]。分析原因为,高NLR、低LMR提示淋巴细胞减少,中性粒细胞或单核细胞增多。淋巴细胞减少可能导致机体免疫系统对肿瘤的免疫反应降低[7];中性粒细胞可通过分泌细胞因子和趋化因子促进肿瘤微环境的形成,从而促进肿瘤细胞的增殖和转移[6],而来自外周单核细胞的肿瘤相关巨噬细胞可抑制获得性免疫反应并促进肿瘤细胞生长和肿瘤滋养层血管生成,进而引起肿瘤的侵袭和转移[9]。本研究分析NLR、LMR与结肠癌临床病理特征的关系发现,高NLR组与低NLR组患者在肿瘤浸润深度、肿瘤最大径和术前CEA水平等方面差异明显(P<0.05),而高LMR组与低LMR组患者在肿瘤浸润深度、肿瘤部位和肿瘤最大径等方面差异明显(P<0.05),提示高NLR和低LMR患者的肿瘤更具侵袭性,但导致该结果的具体机制目前尚不清楚。单因素分析发现,淋巴结转移、组织学类型、临床分期、NLR、LMR、CEA及CA19-9等与结肠癌根治术后患者的OS和DFS有关(P<0.05);进一步行多因素Cox回归分析发现,NLR、CEA及组织学类型为结肠癌根治术后患者OS的独立影响因素,而NLR、LMR、CEA、CA19-9及临床分期是结肠癌根治术后患者DFS的独立影响因素(P<0.05),其中LMR为保护性因素。
列线图可量化及预测某一临床事件发生的概率,从而指导临床决策和风险分层[39-40]。本研究纳入了Cox回归分析中影响结肠癌根治术后患者DFS的独立影响因素(NLR、LMR、CEA、CA19-9和临床分期),构建了基于这些因素的列线图预测模型(基于OS影响因素的列线图预测模型效能较低,且预测价值不高,结果未呈现),并进行了一致性分析和区分度评价,结果表明,该列线图模型具有良好的预测效能。通过X-tile软件根据Cox风险得分将该模型进行风险分层,以低(<3.9分)、中(3.9~14.6分)、高(>14.6分)风险三个水平分别对应患者预后良好、中等、差三个分组,显示出了良好的临床应用价值。
综上所述,本研究结果表明,NLR、LMR、CEA、CA19-9和临床分期可作为结肠癌根治术后患者预后的预测指标,包含这些指标的列线图预测模型可更好地预测预后,将该预测模型根据Cox风险得分进行风险分层后更方便临床应用,有助于推动个体化诊疗。但本研究为单中心回顾性研究,样本量较少,且存在选择偏倚,获得的NLR及LMR的截断值可能与其他同类研究有所不同,且随访达5年的患者较少,代表性差,因此构建的列线图模型未对5年无病生存率进行预测,后续须进行多中心、大样本、前瞻性的临床试验对该结果加以验证。
