长链非编码RNA COL11A1-208对口腔鳞癌细胞增殖及侵袭的影响
2022-10-16蒋英英陈曦石雨应济丞王笑笑丁刚
蒋英英,陈曦,石雨,应济丞,王笑笑,丁刚*
1潍坊医学院口腔医学院,山东 潍坊 261053;2潍坊医学院附属医院口腔科,山东 潍坊 261035
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC,简称口腔鳞癌)是头颈部表皮的常见恶性肿瘤之一[1],因其局部复发率和转移率高,预后差,严重影响患者的健康和生活质量[2-3]。对口腔鳞癌生长和转移机制的探究,有利于推动其预防和治疗的进步,具有重要的科学意义和应用价值。长链非编码RNA(long non-coding RNA,lncRNA)是长度大于200个核苷酸,但缺乏蛋白质编码潜能的RNA转录产物,可参与DNA复制、RNA转录、蛋白质翻译、细胞发育和分化等,是细胞生物学过程的重要调节因子[4-5]。以往研究显示,口腔鳞癌细胞和组织内高表达的lncRNA可促进口腔鳞癌细胞的增殖和转移,可能成为预测口腔鳞癌预后的候选分子标记物或靶向治疗的潜在靶标[6-8]。本研究前期利用基因芯片与生物信息学技术对6例口腔鳞癌与癌旁正常组织lncRNA表达谱的筛选结果显示,COL11A1-208(ENST00000470170)在口腔鳞癌组织内高表达,且与口腔鳞癌的不良预后相关[9];然而,COL11A1-208在口腔鳞癌细胞中的表达及作用尚不清楚。本研究旨在通过观察COL11A1-208在口腔鳞癌细胞内的表达、定位,及其表达改变对口腔鳞癌细胞增殖、迁移和侵袭的影响,分析COL11A1-208在口腔鳞癌发生发展中的作用。
1 材料与方法
1.1 主要试剂及仪器 达尔伯克改良伊格尔培养基(DMEM)、DMEM/F12(1:1)培养基、胎牛血清、0.25% EDTA胰蛋白酶溶液、青霉素-链霉素(100×)双抗溶液均购自美国Gibco公司;重组人表皮生长因子(rEGF)、角质细胞无血清培养基(KSF)、聚氰基丙烯酸正丁脂(BCA)试剂盒、RNA核质分离试剂盒(PARISTMKit)、脂质体3000转染试剂(LipofectamineTM3000)均购自美国Thermo Fisher Scientific公司;TRIzol试剂、PrimerScript-RT试剂盒、实时荧光定量PCR(qPCR)试剂盒(TB Green Premix Ex Taq reagent kit)购自日本TaKaRa公司;Cell Count Kit 8(CCK-8)试剂购自日本同仁化学研究所;脱脂奶粉、Matrigel基质胶购自美国BD Biosciences公司;ECL超敏发光液、Transwell小室购自美国Millipore公司;PBS缓冲液、TBST缓冲液购自北京索莱宝科技有限公司;无血清细胞冻存液购自苏州新赛美生物科技有限公司;聚凝胺(polybrene)基因转染增强剂购自上海翊圣生物科技有限公司;荧光原位杂交(FISH)试剂盒购自广州锐博生物科技有限公司;嘌呤霉素(puromycin)、5×SDS-PAGE蛋白上样缓冲液、DNase Ⅰ、4%多聚甲醛固定液、0.5%结晶紫均购自上海碧云天生物科技有限公司;Ⅺ型胶原α1链(collagen type Ⅺ alpha 1 chain,COL11A1)重组蛋白、上皮钙黏素(E-cadherin)、甘油醛-3-磷酸脱氢酶(GAPDH)、Ki-67抗体以及HRP-IgG H&L山羊抗兔多克隆抗体购自美国Abcam公司;波形蛋白(vimentin)抗体购自美国CST公司。6孔板、24孔板、96孔板、培养皿及离心管等耗材均购自美国康宁公司。qPCR 仪(ABI 7500 FAST)购自美国Life Technologies公司;激光共聚焦显微镜、倒置显微镜、正置显微镜购自德国Leica公司;台式离心机购自德国Eppendorf公司;多功能酶标仪(SpectraMax i3)购自美国Molecular Devices公司;电泳仪及凝胶成像仪购自美国Bio-Rad公司。本研究采用的引物、COL11A1-208Smart Silencer、动物实验用反义寡核苷酸(ASO)及其阴性对照(negative control,NC)、COL11A1-208的Cy3 FISH探针均由广州锐博生物科技有限公司设计合成;COL11A1-208及其NC质粒的构建及慢病毒包装均由汉尹生物科技(上海)有限公司完成。
1.2 细胞实验
1.2.1 细胞来源 采用的人口腔鳞癌细胞系(CAL27、HN4、HN6、HN30、SCC-4、SCC-9、SCC-25)均来自上海交通大学医学院附属第九人民医院口腔肿瘤生物学实验室,正常对照细胞为人口腔黏膜上皮细胞原代培养获得[4-5]。
1.2.2 细胞培养 细胞培养的方法参考以往研究[6-7]。HN4、HN6、HN30和CAL27细胞系在DMEM培养基中培养,SCC-4、SCC-9和SCC-25细胞系在DMEM/F12(1:1)培养基中培养。培养基均加入10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素。口腔黏膜上皮细胞原代培养在含0.2 ng/ml rEGF的角质细胞无血清培养基中进行,培养箱条件为37 ℃、湿度95%、5% CO2。密切观察细胞生长状态,根据细胞状态每隔2~3 d换液;细胞生长至约90%融合时,使用0.25%胰蛋白酶进行消化传代,用于后续实验或冻存后备用。
1.2.3 RNA提取、反转录及qPCR实验 采用TRIzol试剂分离培养细胞的总RNA。用PrimerScript-RT试剂盒进行cDNA反转录。使用qPCR试剂盒配制20 μl反应体系。使用ABI StepOne qPCR仪进行qPCR实验。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。PCR反应以GAPDH和(或)U6作为内参,相对表达量采用2–ΔΔCt法计算。引物序列见表1。

表1 qPCR所用引物序列Tab.1 Primer sequences for qPCR
1.2.4 RNA核质分离及FISH实验检测COL11A1-208的亚细胞定位 使用RNA核质分离试剂盒分离细胞核、质RNA,细胞核、质RNA和总RNA经过纯化和DNase Ⅰ处理后进行反转录,用COL11A1-208引物进行qPCR检测,根据以下公式:所占比例(%)=2(总RNA的Ct值-组分RNA的Ct值)×100%,判断COL11A1-208在细胞核、质RNA内的分布比例。U6作为细胞核的内源性对照,GAPDH作为细胞质的内源性对照,两者的分布比例用于判断RNA核质分离的效果。另外,使用RiboTMFISH试剂盒及Cy3荧光标记的COL11A1-208FISH探针进行FISH实验,采用激光共聚焦显微镜观察COL11A1-208在细胞中的定位情况。
1.2.5 细胞转染及COL11A1-208敲减效率验证将处于对数生长期的待转染CAL27、HN4细胞按每孔2×105个细胞接种于6孔板,摇匀后置培养箱内培养过夜;按照脂质体3000转染试剂说明书分别向CAL27、HN4细胞转染COL11A1-208 Smart Silencer(SS-COL11A1-208)或阴性对照片段Smart Silencer(SS-NC)。转染48 h后用qPCR法进行基因敲减效率检测,达到预定的基因敲减效果后进行后续实验。COL11A1-208沉默及动物实验用ASO的靶序列见表2。

表2 COL11A1-208沉默及动物实验用ASO的靶序列Tab.2 Target sequences of COL11A1-208 Smart Silencer and ASO for animal experiments
1.2.6COL11A1-208过表达慢病毒稳转株构建及效率验证COL11A1-208慢病毒载体构建信息如下:基因名称COL11A1-208(ENST00000470170);载体元件顺序CMV-MCS-PGK-Puro;克隆位点XhoⅠ/EcoR Ⅰ。慢病毒转染具体方法参照以往研究[4-5]。将处于对数生长期的HN4、HN6细胞计数后,按每孔2×105个细胞接种于6孔板,摇匀后置培养箱内培养过夜;使用polybrene基因转染增强剂(终浓度10 μg/ml)进行COL11A1-208过表达慢病毒细胞感染。经嘌呤霉素(终浓度10 μg/ml)筛选2或3次,3 μg/ml嘌呤霉素维持培养2周,建立COL11A1-208过表达慢病毒稳转株(LV-COL11A1-208)。阴性对照载体慢病毒稳转株(LV-NC)流程同上。提取LV-COL11A1-208组和LV-NC组细胞RNA后进行反转录,采用qPCR检测COL11A1-208稳转株的过表达效率。
1.2.7 CCK-8法检测细胞增殖能力 将COL11A1-208敲减或过表达细胞接种到96孔板,密度为每孔约1×103个细胞,每组设3个复孔,每日检测细胞活性。将10 μl CCK-8试剂加入100 μl培养基,细胞37 ℃持续孵育2 h后,使用多功能酶标仪检测450 nm波长处的吸光度(OD)。连续检测5 d,使用Graphpad Prism 7.0软件,以细胞生长时间为横坐标、OD值为纵坐标绘制生长曲线。
1.2.8 平板克隆形成实验检测细胞克隆形成能力将COL11A1-208敲减或过表达细胞接种到6孔板,每孔1×103个细胞,培养10~14 d形成细胞集落。将细胞集落用PBS洗涤2次,4%多聚甲醛固定液固定15 min,0.5%结晶紫染色30 min。对细胞数目>50的集落进行计数。
1.2.9 Transwell法检测细胞迁移及侵袭能力COL11A1-208敲减或过表达细胞消化后,采用无血清DMEM培养基重悬并计数,每上室接种2.5×104个/100 μl细胞,每组设置4个复孔。迁移实验直接使用未处理的Transwell小室,侵袭实验采用包被Matrigel基质胶的Transwell小室。下室加入600 μl含10%胎牛血清的DMEM培养基,37 ℃培养箱中培养24~48 h;4%多聚甲醛溶液固定、0.5%结晶紫染色后,用棉签擦去膜上表面的非侵入细胞;高倍镜下观察并进行穿膜细胞计数。随机取5个视野进行拍照,细胞计数取平均值,以计数所得细胞数的相对数代表癌细胞的迁移和侵袭能力。
1.2.10 Western blotting检测COL11A1蛋白和上皮-间充质转化(EMT)相关蛋白(上皮钙黏素、波形蛋白)的表达水平 Smart Silencer转染细胞72 h后或慢病毒稳转株细胞的密度达80%~90%时,PBS缓冲液洗涤细胞3次,加入适量全细胞裂解液裂解细胞;充分裂解后,蛋白裂解液105 ℃煮10 min,–80 ℃保存蛋白样品。使用BCA试剂盒测定蛋白浓度,加SDS-PAGE蛋白上样缓冲液,105 ℃煮10 min,冰上备用。配胶后上样,10% SDS-PAGE凝胶电泳,300 mA转膜2 h,5%脱脂奶粉室温封闭1 h。一抗[COL11A1(1:1000)、E-cadherin(1:500)、波形蛋白(1:1000)、GAPDH(1:1000)]4 ℃摇床孵育过夜。次日TBST洗3次,二抗室温孵育1 h;TBST洗3次后,用ECL超敏发光液进行显影。采用Image J软件测量Western blotting条带的灰度值,以GAPDH为内参分析蛋白的相对表达量。
1.3 动物实验
1.3.1 实验动物 5周龄的BALB/C-nu雄性裸鼠8只,购自北京维通利华实验动物技术有限公司[实验动物生产许可证号:SCXK(京)2021-0006]。本研究经潍坊医学院实验动物伦理委员会审批同意(批准文号:2019SDL008),实验过程符合国家和单位有关实验动物的管理和使用规定。
1.3.2COL11A1-208敲减的裸鼠皮下移植瘤实验5周龄的雄性裸鼠4只,随机分为ASO-COL11A1-208组和ASO-NC组,每组2只;每只裸鼠均做标记,备用。收集处于对数生长期的CAL27细胞,用无血清DMEM培养基将其重悬并计数,将密度调至2×107个/ml;用注射器将100 μl细胞悬液注射于裸鼠的上肢两侧背部皮下。裸鼠饲养约1周后可见瘤体形成,分别向两组瘤内注射5 nmol/50 μl胆固醇和甲基化修饰的ASO-COL11A1-208或ASO-NC,每4 d注射1次,共注射5次;定期观察瘤体生长情况。饲养28 d后结束观察,将裸鼠安乐死,取下完整瘤体,拍照并测量肿瘤重量和体积。
1.3.3COL11A1-208过表达的裸鼠皮下移植瘤实验
5周龄的雄性裸鼠4只备用。分别收集处于对数生长期的LV-COL11A1-208组及LV-NC组的HN6细胞,用无血清DMEM培养基重悬并计数,将细胞悬液密度调至2×107个/ml,用注射器分别注射100 μl细胞悬液于裸鼠下肢左、右两侧背部皮下(左侧为LV-NC组,右侧为LV-COL11A1-208组)。裸鼠饲养约1周后可见瘤体形成,定期观察移植瘤的生长情况。饲养至21 d结束观察,将裸鼠安乐死,取肿瘤组织拍照并测量肿瘤重量和体积。
1.3.4 组织学观察 将瘤体于4%多聚甲醛溶液中固定24 h,经脱水、石蜡包埋、切片后进行HE染色,并使用Ki-67抗体进行免疫组织化学(immunohistochemistry,IHC)染色,显微镜下观察并拍照。1.4 统计学处理 采用SPSS 16.0软件进行统计分析,以Graphpad Prism 7.0软件制图。计量资料以±s表示,符合正态分布并满足方差齐性时,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1COL11A1-208在7个口腔鳞癌细胞系中的表达情况 qPCR检测结果显示,口腔鳞癌细胞系中COL11A1-208相对表达水平均明显高于正常对照细胞(图1),其中,CAL27、HN30细胞中相对表达水平较高(P<0.05),HN4、SCC-9细胞中相对表达水平中等(P<0.01),HN6、SCC-4、SCC-25细胞中相对表达水平较低(P<0.05)。本研究选用CAL27、HN4和HN6共3个口腔鳞癌细胞系进行COL11A1-208的后续研究。
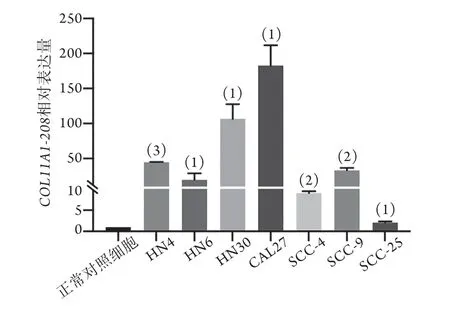
图1 qPCR检测COL11A1-208在7个口腔鳞癌细胞系中的表达Fig.1 Expression of COL11A1-208 in OSCC cell lines detected by qPCR
2.2COL11A1-208在口腔鳞癌细胞中的亚细胞定位 将CAL27、HN4、HN6细胞进行RNA核质分离(以U6、GAPDH作为内参验证分离效果)后行qPCR检测,结果显示,COL11A1-208主要定位于口腔鳞癌细胞核内(P<0.01,图2A)。FISH实验亦显示COL11A1-208定位于细胞核(图2B)。

图2 RNA核质分离和FISH实验检测COL11A1-208的亚细胞定位Fig.2 Subcellular localization of COL11A1-208 detected by nucleocytoplasmic RNA isolation and FISH assay
2.3COL11A1-208敲减对口腔鳞癌细胞增殖及克隆形成能力的影响 qPCR检测结果显示,SSCOL11A1-208组细胞COL11A1-208相对表达量均明显低于SS-NC组(P<0.01,图3A)。CCK-8法检测结果显示,SS-COL11A1-208组细胞增殖活性明显低于SS-NC组(P<0.05,图3B)。平板克隆形成实验结果显示,SS-COL11A1-208组细胞的克隆形成能力明显低于SS-NC组(P<0.0001,图3C)。
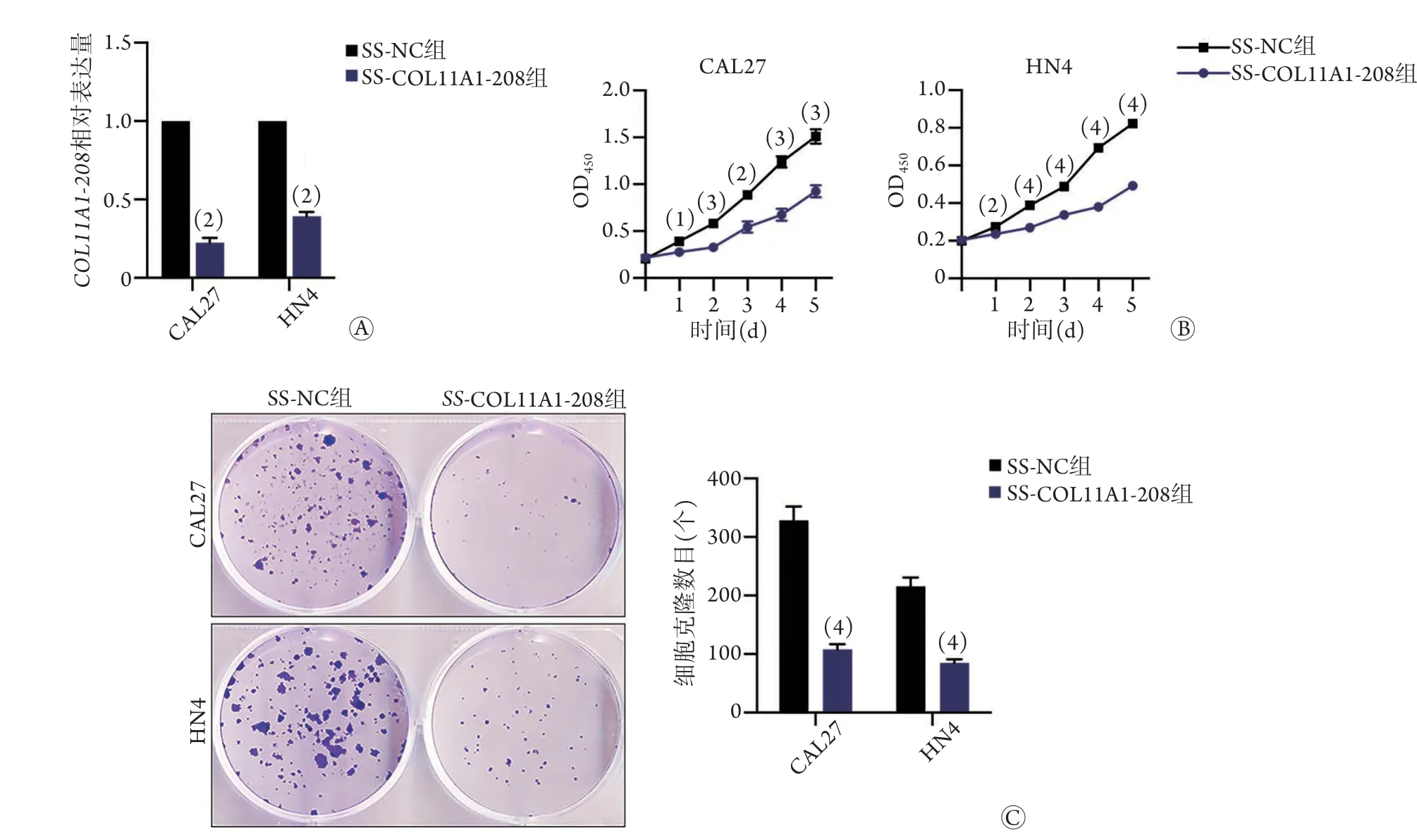
图3 COL11A1-208敲减对口腔鳞癌细胞增殖及克隆形成能力的影响Fig.3 Effect of COL11A1-208 downregulation on the proliferation and colony formation of OSCC cells
2.4COL11A1-208敲减对口腔鳞癌细胞迁移和侵袭能力的影响 Tanswell迁移实验结果显示,COL11A1-208敲减的CAL27、HN4细胞穿膜数均明显少于SS-NC组(P<0.05,图4A);Transwell侵袭实验呈现出一致的结果(P<0.01,图4B)。
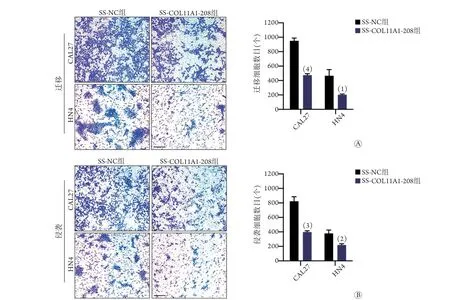
图4 COL11A1-208敲减对口腔鳞癌细胞迁移和侵袭能力的影响Fig.4 Effect of COL11A1-208 downregulation on the migration and invasion of OSCC cells
2.5COL11A1-208过表达对口腔鳞癌细胞增殖及克隆形成的影响 qPCR检测结果显示,LVCOL11A1-208组细胞COL11A1-208相对表达量均明显高于LV-NC组(HN6:6524.216±3395.926vs.1.000±0.000;HN4:3486.230±743.908vs.1.000±0.000;P<0.05,图5A)。CCK-8法检测结果显示,LV-COL11A1-208组细胞的增殖活性明显高于LV-NC组(HN6:OD2d值1.012±0.056vs.0.701±0.012,P<0.001;OD5d值2.345±0.095vs.1.476±0.114,P<0.05;HN4:OD2d值0.694±0.065vs.0.569±0.028,P<0.05;OD5d值2.150±0.131vs.1.229±0.131,P<0.01,图5B)。平板克隆形成实验结果显示,LV-COL11A1-208组细胞克隆形成能力明显高于LV-NC组(HN6细胞克隆数:177.667±23.587vs.86.667±12.583,P<0.01;HN4细胞克隆数:367.000±14.107vs.206.000±21.166,P<0.001,图5C)。
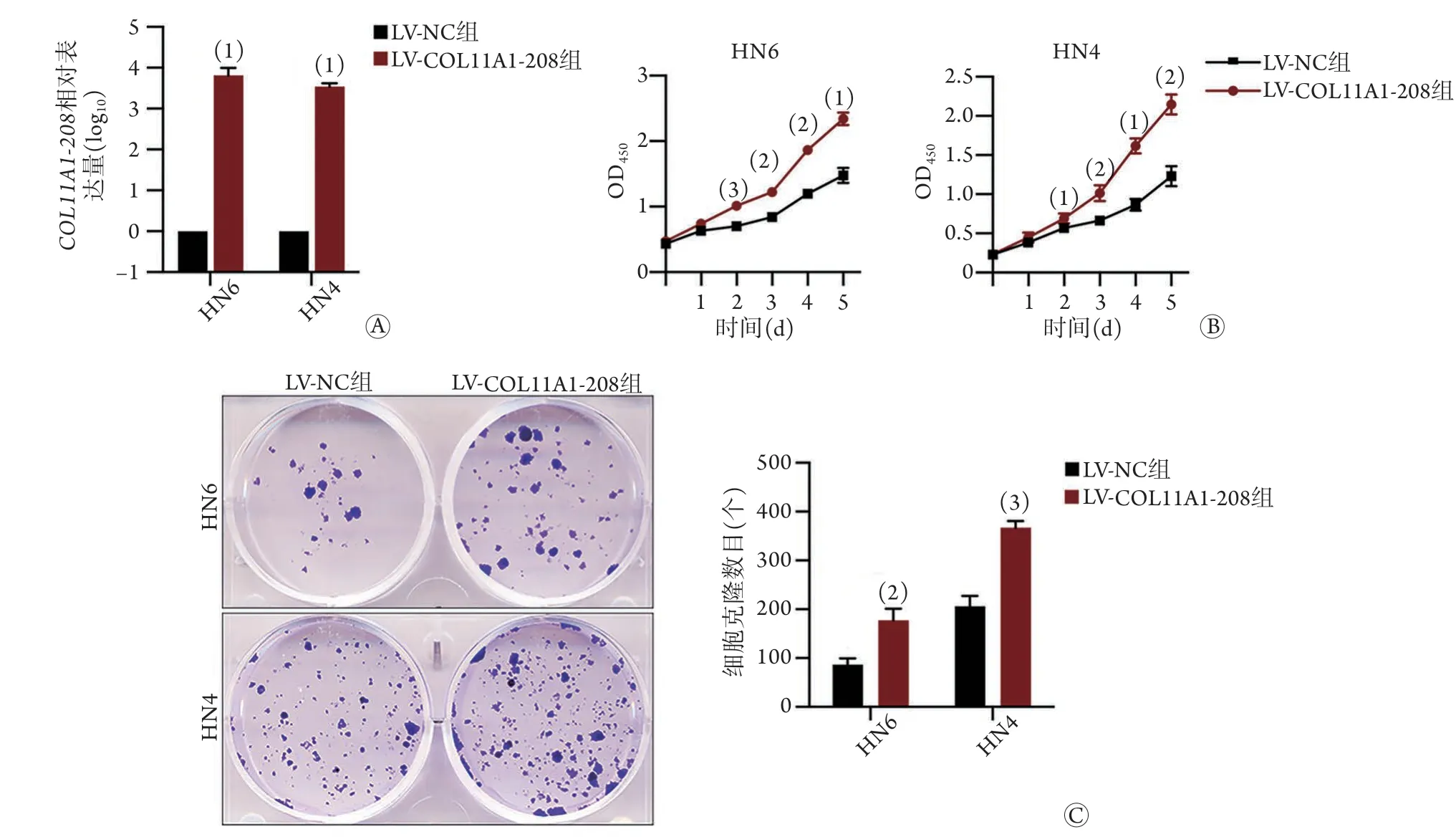
图5 COL11A1-208过表达对口腔鳞癌细胞增殖、克隆形成能力的影响Fig.5 Effect of COL11A1-208 upregulation on the proliferation and colony formation of OSCC cells
2.6CO L 1 1 A 1-2 0 8过表达对口腔鳞癌细胞迁移和侵袭能力的影响 Transwell迁移实验结果显示,COL11A1-208过表达的HN6、HN4细胞穿膜数明显多于LV-N C 组(H N 6 迁移细胞数:1045.349±58.072vs.600.195±18.259;HN4迁移细胞数:642.830±30.836vs.373.784±7.416;P<0.0001,图6A);Transwell侵袭实验结果与迁移实验结果一致(HN6侵袭细胞数:975.349±22.769vs.573.529±32.292;HN4侵袭细胞数:542.830±30.836vs.307.118±14.967;P<0.0001,图6B)。
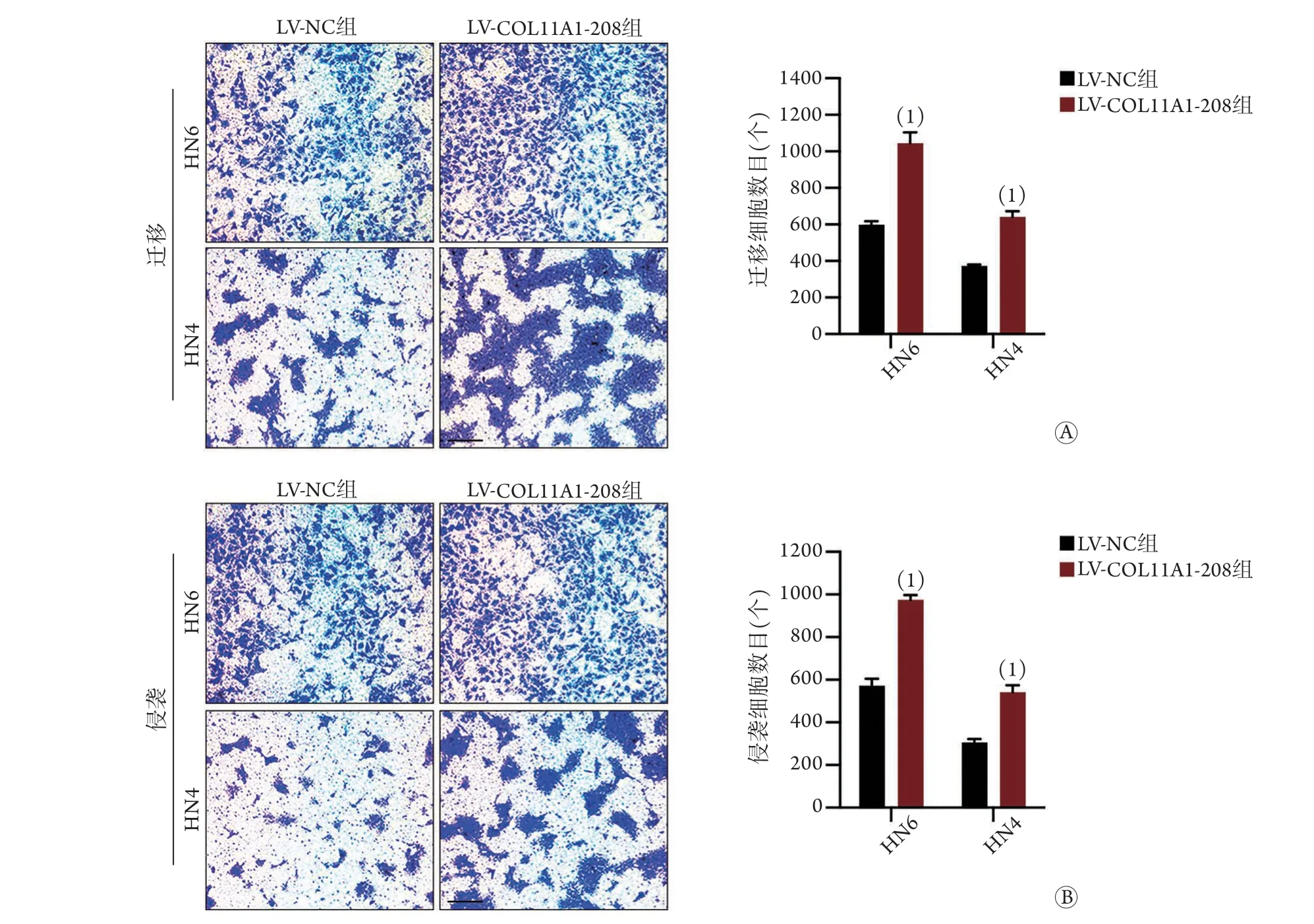
图6 COL11A1-208过表达对口腔鳞癌细胞迁移和侵袭能力的影响Fig.6 Effect of COL11A1-208 upregulation on the migration and invasion of OSCC cells
2.7COL11A1-208与COL11A1表达的相关性
qPCR和Western blotting检测结果显示,SSCO L 1 1 A 1-2 0 8 组 细 胞 内CO L 1 1 A 1相 对 表 达 量均明显低于SS-NC组(CAL27:0.540±0.090vs.1.000±0.000,P<0.05;HN4:0.434±0.119vs.1.000±0.000,P<0.01),COL11A1蛋白相对表达量均明显低于SS-NC组(CAL27:0.439±0.082vs.1.341±0.125,P<0.001;HN4:0.129±0.032vs.0.660±0.027,P<0.0001,图7A)。LV-COL11A1-208组细胞内COL11A1相对表达量均明显高于LV-NC组(HN6:6.098±0.962vs.1.000±0.000,P<0.001;HN4:30.172±8.242vs.1.000±0.000,P<0.01),COL11A1蛋白相对表达量均明显高于LV-NC组(HN6:0.679±0.018vs.0.330±0.011,P<0.0001;HN4:0.942±0.019vs.0.709±0.025,P<0.001,图7B)。
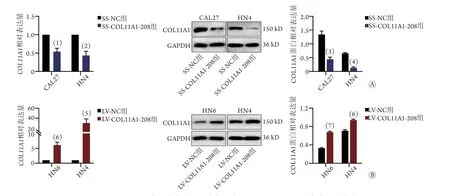
图7 COL11A1-208表达改变对口腔鳞癌细胞COL11A1 mRNA及蛋白表达的影响Fig.7 Effect on the mRNA and protein expression of COL11A1 in OSCC cells by change of COL11A1-208 expression
2.8CO L 1 1 A 1-2 0 8表达改变对口腔鳞癌细胞EMT相关蛋白(上皮钙黏素、波形蛋白)的影响Western blotting检测结果显示,SS-COL11A1-208组细胞的上皮钙黏素相对表达量明显增高(CAL27:0.782±0.077vs.0.618±0.051,P<0.05;HN4:1.164±0.048vs.0.768±0.103,P<0.01),而波形蛋白相对表达量明显降低(CAL27:0.131±0.028vs.0.527±0.158,P<0.05;HN4:0.240±0.021v s.0.4 9 3±0.0 2 9,P<0.0 0 1,图8 A)。而LVCOL11A1-208组细胞的上皮钙黏素相对表达量明显降低(P<0.05),而波形蛋白相对表达量明显增高(P<0.01,图8B)。
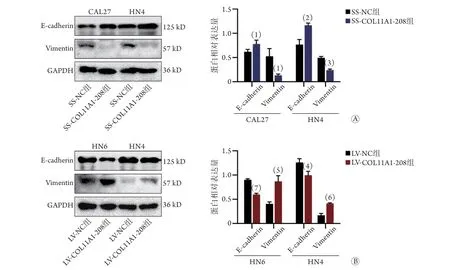
图8 COL11A1-208表达改变对口腔鳞癌细胞内上皮钙黏素和波形蛋白表达的影响Fig.8 Effect on expression of E-cadherin and Vimentin in OSCC cells by change of COL11A1-208 expression
2.9COL11A1-208表达改变对裸鼠皮下移植瘤生长的影响 CAL27细胞皮下移植瘤内定期注射ASOCOL11A1-208观察COL11A1-208敲减对裸鼠皮下移植瘤生长的影响,结果显示,COL11A1-208敲减的CAL27细胞形成的移植瘤重量、体积均明显小于ASONC组[重量:(0.070±0.026) gvs.(0.268±0.146) g,P<0.0 5;体积:(4 5.6 2 5±1 3.0 0 9) m m3v s.(119.000±31.528) mm3,P<0.01,图9A-B);瘤体组织HE和Ki-67染色后组织学形态观察结果显示,COL11A1-208敲减CAL27细胞形成的移植瘤较ASONC组生长减缓(图9C)。此外,COL11A1-208过表达的HN6细胞形成的裸鼠皮下移植瘤明显大于LV-NC组[重量:(0.485±0.140) gvs.(0.248±0.135) g,P<0.0 5;体积:(9 8.7 6 6±2 6.2 4 6) m m3v s.(48.313±24.435) mm3;P<0.05,图9D-E];瘤体组织HE和Ki-67染色后组织学形态观察结果显示,COL11A1-208过表达的HN6细胞形成的移植瘤较LV-NC组生长加快(图9F)。
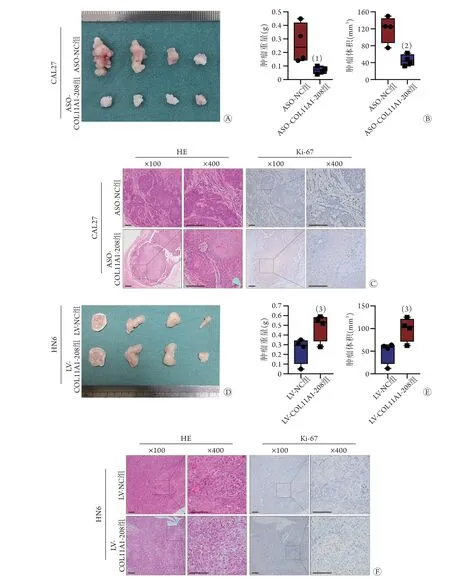
图9 COL11A1-208表达改变对口腔鳞癌细胞形成的裸鼠皮下移植瘤生长的影响Fig.9 Effect on growth of OSCC xenograft tumor in vivo by change of COL11A1-208 expression
3 讨 论
肿瘤发生发展涉及一系列复杂的过程,与表观遗传修饰、非编码RNA等多种因素有关[10]。近年来,lncRNA在恶性肿瘤中的作用及机制成为研究的热点。文献报道lncRNAs在恶性肿瘤中的异常表达往往与肿瘤的侵袭、转移相关,这些lncRNAs具有成为靶向治疗靶标和预后分子标记物的潜力[11]。
大量研究显示,多种lncRNAs在口腔鳞癌的肿瘤组织中表达异常,如CCAT2、AFAP1-AS1、meg3、HOTAIR和FAL1等,且与口腔鳞癌患者的临床病理特征相关,提示lncRNA可能成为口腔鳞癌的辅助诊断指标[12-17]。肿瘤转移是影响口腔鳞癌预后的危险因素,而lncRNA在口腔鳞癌侵袭、转移中的作用和机制越来越受关注[18]。已有研究显示,部分lncRNAs能够促进口腔鳞癌的侵袭与转移,但相关机制尚不明确[19-21]。本课题组前期研究发现,多种lncRNAs(如LINC00460、KTN1-AS1、lnc-H2AFV-1等)可通过与蛋白互作、吸附微小RNA(miRNA)或调控m6A RNA甲基化等机制影响口腔鳞癌细胞的增殖或转移,在口腔鳞癌的发生发展中发挥重要作用[6-8]。由此可见,与口腔鳞癌细胞增殖和侵袭相关的lncRNAs有望成为口腔鳞癌辅助诊断的分子标记物和靶向治疗的潜在靶点,对口腔鳞癌的诊治具有潜在的临床价值。
本课题前期研究显示,COL11A1-208在口腔鳞癌组织中高表达,且与患者的不良预后相关[9]。本研究结果显示,COL11A1-208在口腔鳞癌细胞中呈高表达,与在口腔鳞癌组织中的研究结果一致;体外实验和动物体内实验结果均显示其可促进口腔鳞癌的增殖和侵袭能力,为临床上筛选和鉴定诊治口腔鳞癌的分子标记物提供了实验依据。COL11A1-208定位于1号染色体102 877 717-102 880 018反链,由两个外显子组成,是COL11A1的转录本之一。近年有研究显示,COL11A1基因异常表达与多种肿瘤(如头颈鳞癌、卵巢癌、甲状腺癌等)的发生发展相关,在细胞增殖、侵袭和化疗耐药等生物学过程中起着重要作用,可能成为肿瘤预后预测和诊断治疗的潜在分子标记物[22]。以往研究发现,COL11A1在口腔鳞癌组织和细胞中呈高表达,且COL11A1基因表达下调后口腔鳞癌细胞的增殖和侵袭能力明显减弱[23],这与本研究中COL11A1-208在口腔鳞癌细胞的表达和功能表现一致。另外,本研究结果显示,COL11A1-208主要定位于口腔鳞癌细胞的细胞核,虽然不能编码蛋白,但其表达水平的改变可调控COL11A1的表达。这可能与胞核lncRNA的表观遗传调控机制有关,如lncRNAs与启动子或增强子等相关的不稳定转录本能够选择性结合在染色质上,参与调控染色质结构、转录和RNA加工等过程[24-25]。
本研究结果还显示,COL11A1-208敲减后口腔鳞癌细胞上皮标志物上皮钙黏素表达升高、间充质标志物波形蛋白表达降低,而COL11A1-208过表达细胞的上皮钙黏素表达降低、波形蛋白表达升高。这一系列结果提示,COL11A1-208可促进口腔鳞癌细胞EMT的发生。EMT作为一种可逆的细胞程序,可使上皮细胞瞬间进入准间充质细胞状态[26],与肿瘤的发生、进展和细胞迁移、侵袭等相关[27-28]。LncRNA在EMT过程中可发挥重要作用,因此常被认为是预测EMT发生和肿瘤转移的生物标志物及靶向治疗的潜在靶点[29]。因此,明确COL11A1-208对EMT的调控作用可为今后进一步深入探讨相关机制打下基础。
总之,本研究结果表明,COL11A1-208作为参与调控口腔鳞癌细胞增殖、侵袭、转移的lncRNA,可能成为口腔鳞癌诊断和治疗的分子靶标。
