咖啡因预防白内障发生的研究进展
2022-10-14谈媛张敏潘颖喆张亚琼刘慧刘元
谈媛 张敏 潘颖喆 张亚琼 刘慧 刘元
白内障是晶状体透明度下降或颜色变化导致光学质量下降的一种疾病。早期晶状体的轻微混浊并不影响视力,但后期视力会逐渐降低甚至失明。白内障是人类第一致盲性眼病[1],因此,白内障的防治极为重要。影响白内障发生的因素包括年龄、性别、遗传易感性、糖尿病、吸烟、药物摄入和紫外线暴露等。目前手术是根治白内障的唯一方法,同时,手术费用、术后并发症及预后等情况也制约了手术的广泛应用[2]。
咖啡因不仅是全球应用最广泛的精神类兴奋剂[3],还在心血管系统、呼吸系统、消化系统以及泌尿系统中被广泛研究[4-7]。近年来,眼科领域对咖啡因也有了新的认识[8],随着研究的深入,学者们发现咖啡因可能通过抗氧化、抑制细胞凋亡等机制来预防白内障的发生,现笔者对相关研究进展进行综述。
1 咖啡因的作用及药代动力学
咖啡因是咖啡豆、茶叶、可可豆和可乐果等植物中提炼出的一种味苦的白色结晶嘌呤。在众多饮品中,咖啡因是常用食品添加剂[9]。据估计,全球80%的人口每天都在摄入不同形式的咖啡因,其中咖啡和茶是其最主要的来源[10]。
咖啡因在机体中发挥多种作用。它可兴奋神经系统[11-12],增强骨骼肌的收缩[13],松弛支气管和血管平滑肌[14],利尿,促进肠蠕动等。此外,咖啡因还能预防肝硬化[5]和延缓某些肿瘤[15]的进展,对阿尔茨海默病、帕金森病也有一定的预防作用。咖啡因的分子结构类似于腺苷,能够与细胞表面的腺苷受体结合但不激活腺苷受体,从而充当腺苷的拮抗剂,可以清除羟自由基从而抑制氧化应激反应。因此,咖啡因也是一种抗氧化剂[16]。咖啡因具有较弱的水溶性和脂溶性,几乎可以通过所有的生物膜,包括血脑屏障、胎盘屏障等[17]。胃肠道在45 min内可吸收99%的咖啡因,通过一次脱甲基作用后在肝脏中代谢,在细胞色素P450氧化酶系统中CYP1A2同工酶的催化下,产生3种结构不同的二甲基黄嘌呤后,转化为黄嘌呤、尿嘧啶和尿酸衍生物,在肾脏中被清除[18]。口服和静脉给药在血浆中所到达的浓度峰值水平相当,一般在1~2 h内达峰。成人摄入量为2~7 mg·kg-1时,观察到的最高血药浓度为3~12 mg·kg-1[19]。中等剂量的咖啡因(100~300 mg或1.5~3.0 mg·kg-1)通常对机体有益,高剂量的咖啡因(400 mg或5.5 mg·kg-1以上)会抑制磷酸二酯酶,导致细胞内环磷酸腺苷的蓄积,引起交感神经系统过度兴奋或其他不良反应[20]。局部应用咖啡因滴眼液(浓度为0~70 mmol/L)时,其给药浓度与晶状体中的咖啡因浓度呈正相关。咖啡因进入晶状体后浓度很快升高,而后被缓慢代谢,局部应用72 mmol/L咖啡因滴眼液时,对晶状体无不良反应,且保护作用可持续2 h[21]。
2 晶状体自身的防御机制
晶状体是位于虹膜之后玻璃体之前的透明双凸结构,光线通过晶状体和角膜的折射聚焦在视网膜上,睫状肌通过改变晶状体表明曲率来调整焦距。晶状体代谢复杂,房水是其主要的营养来源。晶状体在体内所有组织中蛋白质含量最高,约占晶状体总质量的38%,在人晶状体中发现的主要蛋白类型包括α-、β-和γ-晶状体蛋白,其中α-晶状体蛋白分子量最高、含量最丰富,能调节细胞生长、增强基因组的稳定性以及保护细胞免受氧化应激诱导凋亡[22]。晶状体的能量来源主要是含量丰富的三磷酸腺苷(Adenosine triphosphate,ATP)。晶状体上皮细胞中Na+-K+-ATP酶的活性对于维持整个纤维细胞团稳态的离子循环流动是必需的[23]。晶状体可通过细胞膜中的某些化合物(如维生素E)和胞浆中的某些化合物和酶 [还原型谷胱甘肽(Glutathione,GSH)、抗坏血酸(Ascorbic acid,ASA)、半胱氨酸、蛋氨酸、谷胱甘肽还原酶(Glutathione reductase,GSR)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、硫氧还蛋白(Thioredoxin,TRX)和硫醇转移酶(Thioltransferase,TTase)]来修复或移除受损的蛋白质和核酸,并维持氧化还原的动态平衡[24]。有研究表明,随着年龄的增长,晶状体周围的氧浓度会增加,导致晶状体中的抗氧化能力会相应降低[25]。晶状体本身具有抗氧化防御系统,可一定程度减少氧化应激保护其免受伤害[26]。GSH和抗坏血酸是晶状体中的主要抗氧化剂,但这些物质的含量会随着年龄的增长而逐渐减少,氧化应激反应则会随着年龄的增长而逐步增强,进而导致混合的二硫化物形成,蛋白质聚集以及光散射现象的发生,这对于维持晶状体的透明度是极其不利的[27]。
3 咖啡因对白内障发生的预防作用
3.1 咖啡因能降低紫外线对晶状体的光氧化
多项研究已证实,大多数白内障高发国家都位于紫外线(Ultraviolet,UV)指数相对较高的地区[28]。这些地区的白内障患者比高纬度国家中的患者晶状体中所沉积的黄色或棕色的色素更丰富[29]。UV可分为紫外线A(Ultraviolet A,UVA)、紫外线B(Ultraviolet B,UVB)和紫外线C(Ultraviolet C,UVC)。晶状体吸收一定量的紫外线后,会发生晶状体蛋白变性和结构改变,随后晶状体变硬且颜色加深形成白内障。光辐射诱导的氧化应激在一定程度上受到晶状体内低氧水平的抑制,然而,长期受UV照射的晶状体光氧化性损伤会渐进性地加重。晶状体上皮细胞(Human lens epithelial cells,HLEC)对于保持晶状体的透明度是必不可少的。UV辐射可被晶状体上皮和晶状体纤维中的蛋白质所吸收,眼睛长期暴露在太阳紫外线下,会增加活性氧簇(Reactive oxygen species,ROS)和过氧化氢(H202)的含量,特别是UVB辐射能增加光氧化的损伤[28]。活性氧(主要存在于线粒体中)和H202具有破坏蛋白质和核酸的潜力。有研究发现,UVB照射后Caspase-3蛋白表达上调[30],而Caspase-3是细胞凋亡发生的关键蛋白,故推测UVB可能在诱导晶状体上皮细胞凋亡方面有特殊意义。
咖啡因作为ROS有效清除剂,可减少UV对晶状体的损伤。Kronschläger等[31]将正常成年SD大鼠暴露紫外线7 h后,晶状体中的Caspase-3活化达峰值,而使用咖啡因滴眼后可明显抑制晶状体上皮细胞的凋亡,减少晶状体内ROS的生成。该研究还发现,咖啡因对UVB辐射的防护作用明显[31]。局部使用的咖啡因的保护因子(Protection factor,PF)为1.23(相当于防晒霜的PF),口服维生素E的PF为1.14,口服抗坏血酸的PF为0,相较于维生素E,咖啡因的稳定性和防护作用更强。Varma等[32]指出,CD-1小鼠暴露于UVB时,咖啡因组(局部点眼)的晶状体中ATP和GSH的水平稳定,无咖啡因组中晶状体中的ATP和GSH的含量均下降。在UV的照射下,光敏剂能增强ROS的光化学诱导损害,Varma等[33]还证实,光敏剂犬尿氨酸体外培养CD-1小鼠晶状体,在UVA的照射下,咖啡因能抑制组织钠泵或钙泵失活,还能稳定维持组织中GSH和ATP(抑制磷酸二酯酶使c-AMP升高)的水平。用电子自旋共振(Electron spin resonance,ESR)光谱检测晶状体显示,咖啡因能显著减少UVA照射所产生的羟基加合物(DMPO-OH ·)基团的信号,减少的程度与咖啡因的浓度呈量效关系。该研究还指出,咖啡因与超氧化物的反应速率远低于超氧化物本身的自发歧化速率[34],因此咖啡因可能主要是与羟基自由基(OH ·)反应来保护晶状体,尿酸盐本身可以清除ROS,而咖啡因与OH ·反应恰好能生成尿酸N-三甲酯,所以咖啡因能有效清除ROS。
3.2 咖啡因能减轻代谢异常对晶状体造成的损伤
代谢异常与年龄相关性白内障的发生密切相关[35]。高血脂和高血糖均是代谢异常的表现,糖和脂类物质可以通过体内的循环到达房水,再从房水弥散入晶状体,增加晶状体内水分渗透,引发白内障。
氧化应激反应是糖尿病并发白内障的主要病因之一。MicroRNA(miRs)主要是通过与信使RNA(mRNA)3'非翻译区中互补的碱基序列杂交,使它们无法执行其蛋白质翻译功能实现其生物学作用。因此,成熟的microRNA是基因沉默的重要媒介。有研究通过半乳糖喂养诱导幼龄CD-1小鼠建立高糖动物模型,发现半乳糖+咖啡因组的miRs的相对表达水平明显低于不含咖啡因模型组[36]。咖啡因可以抑制毒性miRs的转录,保护组织免受miRNA诱导的重要抗氧化剂基因的沉默[36],该研究提示,在高半乳糖血症条件下咖啡因通过阻止有毒miRs的转录来抑制氧化应激反应,咖啡因还可能通过抑制某些上游途径,例如核因子(类胡萝卜素衍生物2)-类似物2/KELCH样ECH相关蛋白1途径,参与抗氧化基因的转录。另一项研究通过半乳糖喂养诱导幼龄SD大鼠建立白内障模型,咖啡因采用局部点眼的给药方式,半乳糖组可见晶状体中大量TUNEL染色阳性细胞,提示有大量凋亡细胞出现,且在正常饮食组和咖啡因+半乳糖组中未检测到凋亡细胞。由此推断,咖啡因可抑制与半乳糖性白内障形成相关的凋亡过程[37]。Kaczmarczyk-Sedlak等[38]利用链脲佐菌素建立1型糖尿病大鼠模型,发现与模型组相比,口服咖啡因+糖尿病组中的氧化应激生物标志物超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSHPx)的活性降低,丙二醛(Malondialdehyde,MDA)和晚期氧化蛋白产物(Advanced oxidation protein products,AOPP)浓度降低,而GSH浓度明显升高。
在肥胖人群中,晶状体中的氧化应激状态明显增强,GSH-Px、CAT等抗氧化酶活性升高,MDA、晚期氧化蛋白产物的含量增加[24-39]。Nakazawa等[40]采用高脂饮食(High fat diet,HFD)喂养的动物建立肥胖相关性白内障模型,发现HFD组中GSH浓度明显降低,HFD+咖啡因(喂养)组能有效避免GSH的降低。该研究还发现,GSH浓度在HFD烘焙咖啡豆组(0.90 μmol·g-1)中较HFD生咖啡豆组(0.78 μmol·g-1)更高。众所周知,咖啡因是咖啡豆的主要成分。烘焙过的咖啡豆,可以产生邻苯二酚,后者可通过激活红系衍生的核因子2相关因子2、血红素加氧酶-1(HO-1)和腺嘌呤二核苷酸醌氧化还原酶-1来发挥类似抗氧化的作用[41]。
4 咖啡因可以通过胎盘屏障作用于子代的晶状体
迄今,咖啡因对妊娠是否产生不利影响仍存在争议,但普遍认为咖啡因可以通过胎盘屏障对子代产生影响。先天性白内障约占儿童失明的40%,其病因尚不清楚[8]。在妊娠早期,母体对咖啡因的清除率较未怀孕时无明显变化,直到妊娠中期和晚期,孕妇对咖啡因的代谢和排出时间会大大延长,且此时胎儿代谢咖啡因所需的酶水平较低,咖啡因对胎儿的影响较大,会增加流产风险[42]。Evereklioglu等[43]研究发现,妊娠期雌性大鼠给予不同浓度的咖啡因直至妊娠结束,通过裂隙灯显微镜和组织病理切片分别观察出生30 d 后新生幼鼠晶状体,发现腹腔内注射咖啡因25 mg·kg-1·d-1组、腹腔注射咖啡因50 mg·kg-1·d-1组、腹腔注射咖啡因100 mg·kg-1·d-1组、咖啡因灌胃50 mg·kg-1·d-1组中,有34%的子代晶状体发现病理切片异常和(或)裂隙灯显微镜下晶状体混浊的表现,其中腹腔注射咖啡因100 mg·kg-1·d-1组中子代晶状体改变最明显,在裂隙灯显微镜下观察该组有未成熟的白内障形成;病理切片显示,晶状体纤维排列不规则,有大量肿胀的纤维细胞,并有伴随着晶状体皮质液化的情况,而对照组(腹腔注射0.9%氯化钠溶液)子代晶状体显示均为正常晶状体,腹腔内注射咖啡因25 mg·kg-1·d-1组的子代晶状体也未出现异常。因此,目前孕妇咖啡因的摄入量建议应低于最高摄入量(北欧国家和美国定为200 mg·d-1,WHO定为300 mg·d-1)[44],以减少对胎儿眼发育的不良影响。
5 小结与展望
综上,现有的研究提示咖啡因可从以下几个方面预防白内障的发生(见自绘图1):①咖啡因在体内形成一种稳定的抗氧化剂;②咖啡因可清除ROS产生的过氧化物,有效维持晶状体组织中GSH和ATP的水平,后者可与羟自由基反应,避免晶状体受光化学损伤;③咖啡因可通过抑制Caspase-3的表达水平来减少晶状体上皮细胞的凋亡和减少氧化应激引起的microRNA转录异常,抑制与糖尿病相关性晶状体的凋亡过程;④咖啡因可降低血糖、血脂[45],抑制代谢异常所引起的氧化应激标志物SOD、GSH-Px、CAT的活性和减少MDA、AOPP的含量,进而延缓或逆转白内障的发生,增加晶状体的透明度;⑤咖啡豆烘焙后产生的邻苯二酚或与咖啡因协同激活Nrf2、HO-1以及NQO-1来提高抗氧化作用。但对于孕妇和哺乳期妇女,摄入咖啡因时应谨慎,以避免对胎儿或新生儿产生不利的影响。总之,咖啡因可通过多种机制来预防或延缓晶状体混浊,但其在眼科疾病中的更多机制亟待我们进一步去发掘。
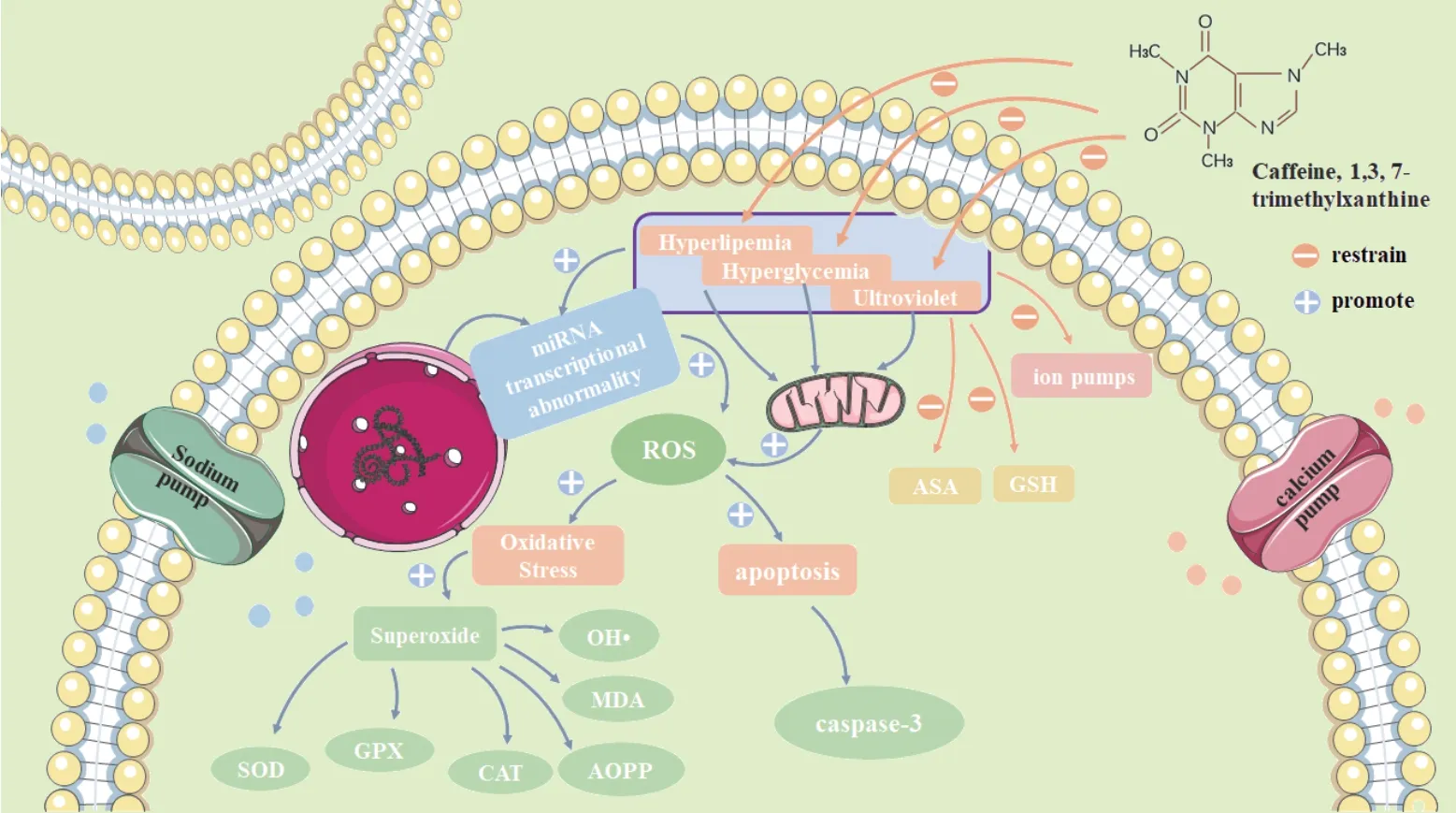
图1.咖啡因预防白内障发生的可能机制高脂、高糖及紫外线等因素均能激活ROS,降低ASA、GSH的水平,抑制离子泵的活性,咖啡因通过抑制这一系列的反应发挥作用。ROS:活性氧;SOD:超氧化物歧化酶;CAT:过氧化氢酶;GPx:谷胱甘肽过氧化物酶;MDA:丙二醛;AOPP:晚期氧化蛋白产物;OH ·:羟基自由基;GSH:还原型谷胱甘肽;ASA:抗坏血酸Figure 1.Possible mechanism of caffeine prevention of cataract.Factors such as hyperlipemia,hyperglycemia and ultroviolet can activate ROS,reduce the level of ASA and GSH,and inhibit the activity of ion pump.Caffeine plays a role through inhibiting these responses.ROS,reactive oxygen species;SOD,superoxide dismutase;CAT,catalase;GPx,glutathione peroxidase;MDA,malondialdehyde;AOPP,advanced oxidation protein products;OH ·,hydroxyl radical;GSH,reduced glutathione;ASA,ascorbic acid.
利益冲突申明本研究无任何利益冲突
作者贡献声明谈媛:参与选题、设计及资料的分析和解释;收集数据;撰写论文及绘图;根据编辑部的修改意见进行修改及核修。张敏:根据编辑部的修改意见进行修改。潘颖喆、张亚琼、刘慧、刘元:收集数据
