小鼠视神经损伤后视神经小胶质细胞数目和形态变化
2022-10-14季媛飞杨陈王敏吴文灿余波
季媛飞 杨陈 王敏 吴文灿 余波
外伤性视神经病变(Traumatic optic neuropathy,TON)是一种少见的疾病,常常由于头部钝器损伤后引起,可造成永久性的视力丧失[1-2]。早期患者通常表现为部分或完全的视力丧失、相对瞳孔传入障碍、视盘正常和视野缺损[2],后期出现视神经萎缩。目前,尚无有效的循证医学治疗方法,因为单纯随访、糖皮质激素治疗和视神经管减压术都被证实对改善视力效果欠佳[3-5]。视神经损伤后,在免疫细胞和炎症介质的相互作用下,组织病理学发生改变,包括轴突变性和视网膜神经节细胞凋亡[3]。小胶质细胞作为中枢神经系统的主要常驻免疫细胞,参与神经稳态的维持和发展、损伤的应答和修复[6-7],被认为是治疗视神经疾病的重要细胞靶点[8]。在生理条件下,小胶质细胞数量较少,形态呈分枝状,当受到炎症、损伤或缺血时其可被激活,转变为阿米巴样,数量增多,并做出迅速应答[9]。本研究通过建立视神经夹持模型来观察不同时间点小鼠视神经小胶质细胞数目与形态的变化,了解视神经损伤后小胶质细胞的活化情况,为将来通过调控小胶质细胞激活状态进行视神经损伤修复提供基础。
1 材料与方法
1.1 实验动物及分组
采用由CX3CR1+/GFP小鼠(订购于美国Jackson实验室)和C57BL/6J WT小鼠杂交配得到的清洁级健康成年CX3CR1-/GFP转基因杂交雄性小鼠32 只,8~16周龄,体质量18~25 g,其小胶质细胞均表现为GFP(+)。实验期间饲养于温州医科大学眼视光学院清洁级动物实验室,自由饮水摄食,22 ℃室内温度、湿度恒定,照明为12 h/12 h明暗交替。眼部检查:双眼角膜透明,屈光介质清,瞳孔等大等圆,对光反应灵敏,眼底无异常。应用随机数字表法将小鼠随机分为4组:正常对照组,视神经损伤1、7、14 d组,每组8只。正常对照组不做任何处理,视神经损伤组均在左眼行视神经夹伤模型,右眼不予处理。本实验严格按照温州医科大学动物伦理要求进行,并遵循温州医科大学批准的动物护理和使用方案(批号:wydw2019-0161)。
1.2 视神经损伤模型建立
盐酸丙美卡因滴眼液表面麻醉小鼠眼表,并用水合氯醛和乌拉坦麻醉药(0.5 g乌拉坦,2.5 ml 10 %水合氯醛,7 ml蒸馏水混合)按0.15 ml/10 g进行腹腔注射麻醉。侧卧固定,聚维酮碘消毒左眼结膜囊及眼周皮肤。在显微镜下,沿角膜缘剪开颞侧球结膜,弯镊将眼球轻推向鼻侧,直颞钝性分离充分暴露视神经,用恒定压力的反向镊夹持球后端视神经5 s,可见伤眼瞳孔散大固定、直接对光反射消失,眼内无出血。缝合结膜,将眼球恢复正常生理位置,眼表涂凡士林和氧氟沙星滴眼液,放置于37 ℃加热板至苏醒。
1.3 标本取材
在相应的时间点,水合氯醛和乌拉坦麻醉药0.15 ml/10 g腹腔麻醉后,四肢固定于手术台,开胸暴露心脏。止血钳阻断肺动脉和降主动脉,注射针插入左心室,右心耳开口放血。1.5 ml/min速度匀速灌注2 ml 37 ℃ 0.01 mmol/L PBS,预冷10 ml 4%PFA溶液。沿小鼠颈部剪下头颅,去除颅骨和大脑,分离视神经与周围组织,取出左眼视神经,避光固定于4% PFA溶液。
1.4 视神经冰冻切片
视神经避光置于4% PFA溶液,在4 ℃冰箱中固定4 h,再在30%蔗糖溶液中脱水过夜。用包埋剂包埋视神经后进行冰冻切片,切片厚30 μm,间隔1片贴于载玻片上,清洗包埋剂并封片。
1.5 激光共聚焦显微镜拍摄及小胶质细胞分析
由于CX3CR1-/GFP转基因杂交小鼠的小胶质细胞自带绿色荧光,因此无需染色,直接用Zeiss LSM880激光共聚焦显微镜进行图像采集即可观察细胞数目和形态。每根视神经选取3片冰冻切片标本,在每片视神经切片距离眼球端500 μm处拍摄1张图像。用共聚焦显微镜20×拍摄,截取200 μm×300 μm视野面积,用Image J软件计数小胶质细胞数目,并计算单位面积的细胞密度(细胞个数/mm2)。用共聚焦显微镜63×拍摄,观察小胶质细胞形态。
1.6 统计学方法
实验研究。采用GraphPad Prism 7.04软件进行统计分析。数据符合正态分布,满足方差齐性,以表示,4组间的小胶质细胞数目比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 视神经小胶质细胞数目变化
正常对照组视神经小胶质细胞的数目为(438±16)个/mm2。视神经损伤1 d组小胶质细胞数目为(323±15)个/mm2,视神经损伤7 d组为(1 252±107)个/mm2,视神经损伤14 d组为(1 474±113)个/mm2。视神经损伤7 d组和14 d组的小胶质细胞数目与对照组和视神经损伤1 d组差异均有统计学意义(P<0.001),但是对照组和损伤1 d组比较以及损伤7 d组和损伤14 d组比较差异均无统计学意义(P>0.05)。
2.2 视神经小胶质细胞形态变化
正常对照组的视神经小胶质细胞处于静息状态,胞体较小,分枝较多且细长、向四周伸展(见图1A、E)。视神经损伤1 d后,小胶质细胞分枝数量减少,部分分枝朝向损伤部位,远离损伤部位的分枝减少,细胞核形态变化不明显(见图1B、F)。损伤7 d组的视神经小胶质细胞大量激活,排列较紊乱,存在少量细胞聚集现象,分枝由长而细转变成短而粗,且越靠近细胞核分枝越粗,分枝方向与视神经长轴方向平行,细胞核体积明显增大(见图1 C、G)。视神经损伤14 d组,视神经小胶质细胞排列杂乱,细胞聚集现象明显,细胞核较大,突起数目较少,伸展范围较短,与损伤7 d组类似(见图1 D、H)。
3 讨论
视神经是中枢神经系统的一部分,受到损伤后将不能再生。TON是一种由眼眶外伤引起的较少见但可造成永久视力丧失的疾病。TON的发生率占所有闭合性头部外伤的0.5%~5%,占颌面部骨折的2.5%[1]。急性TON的临床表现为部分或完全失明,相对瞳孔传入障碍,视野缺损。疾病初期,视盘外观无变化,但随着时间的推移,视盘会呈现苍白色。TON可导致轴突的变性和视网膜神经节细胞(Retinal ganglion cells,RGCs)的凋亡,因此视神经损伤再生需要具备以下几个条件:最大化RGCs内在再生能力;克服抑制视神经再生的外部环境;优化再生轴突到达中枢。目前对于TON的病理生理和分子机制的了解仍然有限,尚无有效的治疗方法[10-11]。
神经胶质细胞是视神经的重要组成部分,包括小胶质细胞、星形胶质细胞和少突胶质细胞,它们之间不断地相互作用,形成一个强大而高效的网络,对于维持神经元活性和结构稳定发挥着关键作用[12]。小胶质细胞是中枢神经系统的主要常驻免疫细胞,占所有胶质细胞的10%~15%,在中枢神经系统生理和病理条件下都参与了各种保护和损伤作用。在生理条件下,小胶质细胞处于静息状态,胞体较小,分枝细长,动态伸缩的突起不断地扫描周围环境,同时释放神经保护因子和抗炎因子,为神经元提供支持,参与程序性细胞凋亡,维持微环境的稳态。有研究发现,小胶质细胞在静息状态下高度活跃,其胞体一般保持固定,而突起不断伸缩,清除积累的代谢产物和衰竭的组织成分,当相邻的突起相互碰撞时,末端相互排斥[13]。急性损伤后,分枝状小胶质细胞迅速被激活,形态变为阿米巴样,胞体增大,分枝缩短变粗,向损伤部位迁移[14],并释放各种因子,一方面清除受损凋亡的细胞,限制进一步损伤,另一方面引发持续激活,影响组织修复[15-16]。在神经退行性病变中,小胶质细胞释放的线粒体碎片可调节反应性星形胶质细胞增生,进而加速神经元的损伤和死亡[17],同时星形胶质细胞的功能丧失,也可引起中枢神经系统病理改变和神经退行性病变[18]。包绕轴突的髓鞘由少突胶质细胞形成,小胶质细胞的激活和星形胶质细胞的活化,可直接引起脱髓鞘/髓鞘再生[19]。相反,少突胶质细胞也能影响小胶质细胞的激活和存活,如少突胶质细胞表达的CD200可抑制小胶质细胞激活,SEMA3A可促进小胶质细胞凋亡[20]。
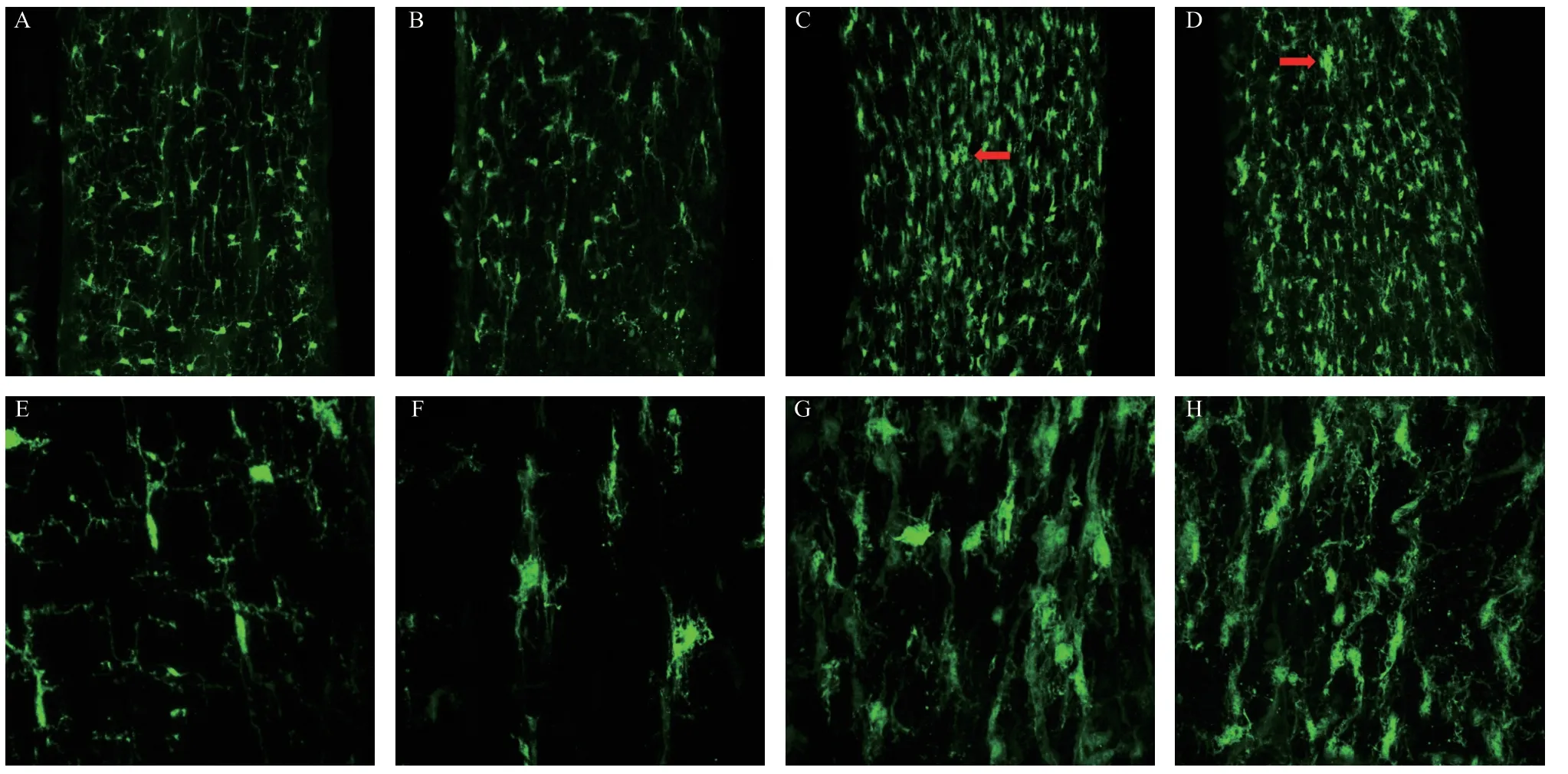
图1.小鼠视神经损伤后不同时间点视神经小胶质细胞的分布与形态变化A-D:分别为正常对照组及ONC 1、7、14 d组小鼠视神经小胶质细胞(×20),红色箭头所示为小胶质细胞聚集;E-H:分别为正常对照组及ONC 1、7、14 d组小鼠视神经小胶质细胞(×63)Figure 1. Distributed and morphological changes of microglia in optic nerve of mice at different time points after optic nerve crush.A-D: control group,ONC 1 d group,ONC 7 d group and ONC 14 d group (×20).The red arrow shows the aggregation of microglia.E-H: control group,ONC 1 d group,ONC 7 d group and ONC 14 d group (×63).ONC,optic nerve crush.
本实验通过视神经夹伤模型模拟外伤性视神经病变,这是一种用于研究视神经损伤后小胶质细胞功能的常用模型[21-22]。我们利用CX3CR1-/GFP转基因杂交小鼠,其通过同源重组将CX3CR1基因替换为编码增强绿色荧光蛋白(EGFP)的基因后,所有小胶质细胞都被荧光标记[23],因此视神经冰冻切片后,用共聚焦显微镜可直接观察小胶质细胞的形态与分布。
本研究观察了小鼠视神经损伤后不同时间点视神经小胶质细胞数目及形态变化。我们发现正常对照组视神经小胶质细胞数量较少,形态为分枝状的静息状态,分布均匀且稀疏,在视神经损伤1 d后小胶质细胞数目轻度减少,其胞体变化不明显,部分细胞的分枝增粗,且分枝在损伤对侧缩短,而在损伤侧较长,说明视神经损伤急性期,可能部分小胶质细胞受损凋亡,存活的小胶质细胞处于激活初期,正在转变为阿米巴样。视神经损伤7 d后,大部分小胶质细胞处于激活状态,细胞数急剧增加,胞体直径增大,分枝缩短增粗,呈现阿米巴样,部分细胞出现聚集现象。视神经损伤后14 d,小胶质细胞数目仍然较多,形态与损伤7 d组相比变化不大,提示其仍处于激活状态。这些表现与既往的研究[14]相一致。
本研究存在进一步的提升空间,首先,可以设置更多时间点观察视神经损伤后小胶质细胞激活和失活的变化;其次,可以观察视神经不同部位小胶质细胞的激活状态;最后,通过调控小胶质细胞的激活状态进行视神经修复可能是值得进一步研究的方向。
利益冲突申明本研究无任何利益冲突
作者贡献声明季媛飞:实施研究,收集数据,参与选题、设计及资料的分析和解释;撰写论文;修改论文中关键性结果、结论;根据编辑部的修改意见进行修改。杨陈:实施研究,收集数据,参与资料的分析和解释,根据编辑部的修改意见进行修改。王敏:参与选题、设计;指导相关实验工作和修改论文的结果、结论。吴文灿:参与选题、设计;指导相关实验工作。余波:参与选题、设计及资料的分析和解释;修改论文中关键性结果、结论;根据编辑部的修改意见进行修改
