基于转录组数据分析地下水污染对ICR小鼠肝脏遗传损伤的分子机制
2022-10-12戴铭睿董雪纯罗宇航戴金伯郭丽颖李俊芳贺小英
杨 慧,戴铭睿,于 洋,董雪纯,罗宇航,戴金伯,曲 静,郭丽颖,李俊芳,贺小英*
(1.内蒙古科技大学生命科学与技术学院,内蒙古包头 014010;2.内蒙古科技大学矿业与煤炭学院,内蒙古包头 014010)
稀土金属矿业的开发和利用给人类带来了巨大的经济效益,同时对矿区周边的生态环境以及人类健康造成了严重威胁[1]。以北方某稀土金属冶选尾矿库为例,其建造目的是用于存放大量的选矿废水,由于早期建造时未考虑防渗漏装置,导致库内污染物浓度逐年升高,且向地下不断渗漏,污染了当地的地下水,引发了许多环境污染问题[2]。ICR小鼠是当今评估人类疾病健康的最佳模式动物之一,由于它和人类的同源性较高,被广泛应用于毒理学、肿瘤学及发育生物学等生命科学领域。我们前期研究发现尾矿库渗漏导致地下水的污染会对SD大鼠的肝和肾细胞存在一定程度的毒理损伤[3]。因此,为进一步评估尾矿库渗透导致地下水污染对生物遗传损伤的程度以及可能的分子机制。本文首先调查尾矿库污染严重样点地下水核心污染成分,其次系统研究受污染地下水对ICR小鼠在器官水平、细胞水平和基因水平的遗传损伤效应。本研究旨在为生物遗传损伤手段能否科学有效地评价尾矿库周边地下水环境质量提供新依据,同时为揭示尾矿库周边地下水污染对生物体遗传损伤的机制提供理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 ICR雌性小鼠,购自斯贝福(北京)生物技术有限公司,在内蒙古科技大学生命科学与技术学院动物实验室饲养,通风良好,温度20℃~25℃,湿度50%~60%,自由采食。本实验动物来源和使用严格遵循动物伦理要求。
1.1.2 主要试剂 DMEM基础培养液、胎牛血清(FBS)购自Gibco公司;胰酶购自索莱宝公司;链霉素和青霉素购自美国HyClone公司;磷酸缓冲液(PBS)、无水乙醇和二甲苯等购自国药公司;福尔马林、HE染液等购自索莱宝公司。
1.1.3 主要仪器 二氧化碳培养箱(Galaxy S型),RS BIOTECH公司产品;荧光倒置显微镜(AE30/31+型),日本尼康株式会社产品;电泳仪(Tanon EPS 300型),上海天能科技有限公司;制冰机(XD-100 kg型),华豫兄弟(深圳)制冰系统智能科技有限公司产品;水浴锅(Thermo Scientific型),莱恩德智能科技有限公司产品;分析天平(MP6001型),上海精密科学仪器有限公司产品;切片机(HistoCore MULGTICUT型),徕卡仪器有限公司产品;琼脂糖水平电泳槽(DYCP-1型),南京驰顺科技发展有限公司产品;激光共聚焦显微镜,尼康仪器(上海)有限公司产品。
1.2 方法
1.2.1 水样采集和水质指标测定 本研究的水样采集点为中国北方某尾矿库,该尾矿库于1965年投产,东西约3.0 km,南北约3.5 km,总体占地面积约11 km2,是中国最大的尾矿库之一。根据距尾矿库远近距离不同,选取具有代表性的尾矿库渗漏水3个样点,样品的检测指标为:(1)离子:F,Cl,N,SO,Na,K,Mg,Ca;(2)稀土元素:La,Ce,Sc,Y,Nb,Pr,Nd,Sm,Dy;(3)金属:Cu,Zn,Pb,Cd,Cr,Mn,Co,Ni及微量元素。根据中国国家标准局制定的地表水环境质量标准(GB 3838-2002)和地下水环境质量标准(GB/T 14848-2017)作为检测标准进行水样分析。所有分析均有效重复3次,所有样品的测量误差均≤5%。水样由核工业北京地质研究院分析测试研究中心(NexION 300D型ICP-电感耦合离子体质谱仪)测定完成。
1.2.2 ICR小鼠的水处理 选取6周龄~8周龄ICR小鼠,适应性喂养7 d后,随机分组,每组5只~6只,采用3个采样点S1组、S2组和S3组作为实验组,以本市标准生活饮用自来水作为对照组(S组)。ICR小鼠每4 h灌胃一次水样,每次0.4 mL;饲养周期为30 d,各组的饲养食物及生长环境均一致。
1.2.3 解剖处理ICR小鼠肝脏 试剂、容器、器械提前4 ℃预冷,采用颈椎脱臼法处死ICR小鼠后,立即放入装有750 mL/L酒精的烧杯中,浸泡3 min后转移到细胞无菌室,将小鼠放在预先灭菌的玻璃培养皿中,先剖开小鼠腹部皮肤,然后更换剪刀和镊子剪开小鼠腹壁,换用全新的镊子和剪刀取出肝脏,以免造成交叉感染,于一次性无菌培养皿多次清洗,用于后续实验。
1.2.4 脏器系数统计学分析 ICR小鼠饲养30 d后,各组随机取出3只,测量ICR小鼠体重后颈椎脱臼处死,获得ICR小鼠肝脏后用生理盐水冲洗,滤纸吸干水分后称重肝组织重量,参照[4]计算肝脏脏器系数。采用单因素方差分析进行组间差异性比较,显著性表示为*P<0.05,**P<0.01,***P<0.001,当P<0.05时认为有统计学意义。
1.2.5 异常组织病理学分析 ICR小鼠在喂养30 d时,颈椎脱臼处死,解剖ICR小鼠后对肝脏病理学切片的分析采取采用苏木精-伊红(HE)染色的方法进行[5]。
1.2.6 单细胞凝胶电泳 取上述获得的S3,S1和S组ICR小鼠肝组织放入5 mL盛不含Ca2+、Mg2+的PBS的小烧杯中,采用无菌型眼科剪刀,将组织切碎至1 mm3,将细胞悬浮物用200目筛网过滤,然后在离心管中以1 000 r/min的速度进行离心,5 min后,将上清液丢弃,如此反复3次。显微镜下计数,将细胞的浓度调节到每毫升1×106~1×107个,采用单细胞凝胶电泳试验判断不同组织的DNA损伤程度。通过制胶、裂解及电泳,进行染色及观察。使用100 W汞灯作为荧光光源,在荧光显微镜(激发波长为549 nm,发射波长为590 nm)下,损伤的细胞DNA呈现由圆形、致密红色核心(彗头)和朝向阳极的尾端DNA碎片(彗尾)构成的“彗星”。进行统计分析尾矿库周边水(样点S1、样点S2、样点S3、和对照组样点S)对ICR小鼠在各细胞水平的损伤影响。
1.2.7 透射电镜观察ICR小鼠肝细胞 将矿区污染样点水S3,S1和对照组S组处理ICR小鼠获得的肝组织切碎至切成1 mm3的小块,1 min内固定于组织及细胞电镜专用25 mL/L戊二醛固定液。采用透射电镜检测肝组织,通过分析肝细胞内细胞器的损伤程度来判断实验水样对细胞内部组份的影响程度。本试验由武汉迈斯普生物科技有限公司完成。
1.2.8 转录组测序分析 将矿区污染最严重的样点水S3组与对照组S组处理30 d的ICR小鼠,提取肝细胞总RNA,利用IlluGmina测序平台进行了DNA文库的建立和序列分析,分析基因表达谱变化,通过KEGG富集分析对差异表达基因进行富集分析,进一步研究ICR小鼠肝细胞在基因水平的损伤影响,本试验由南京派森诺基因科技有限公司完成。
2 结果
2.1 水样采集和水质指标测定
本研究采用地表水环境质量标准(GB 3838-2002)和地下水环境质量标准(GB/T 14848-2017)评估采集样本的质量,结果表明在送检的实验组水样中F,Cl,N,SO,Na,K,Mg,Ca等离子的含量明显高于对照组S组(P<0.05),尤其是F,Cl离子的含量远远超过标准(表1)。
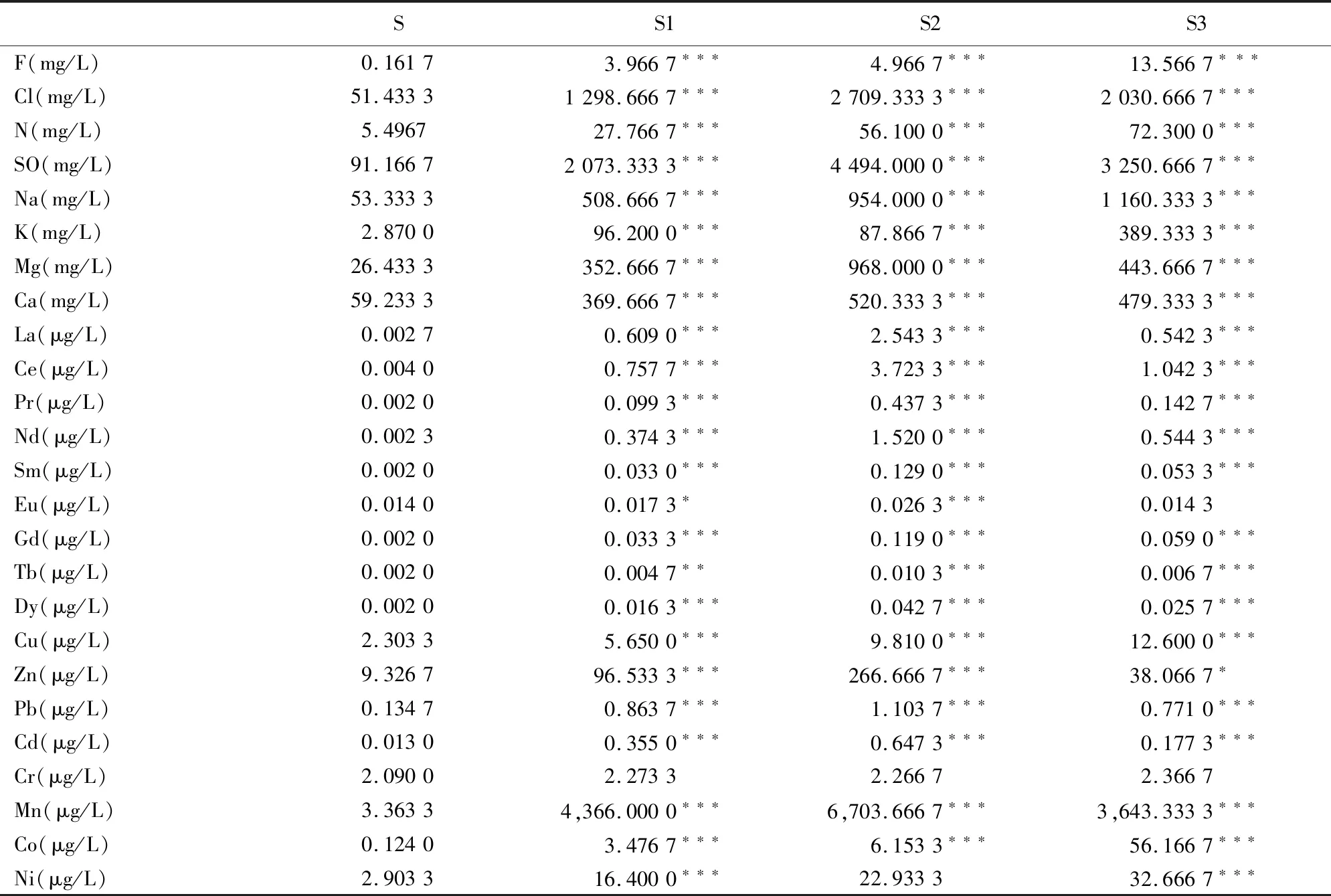
表1 稀土尾矿库附近样品中水质指标的测定Table 1 Determination of water quality index in samples near rare earth tailings pond
2.2 脏器系数分析
为了进一步确定实验过程对ICR小鼠的肝器官损伤效应的影响,实验处理30 d后正常称量ICR小鼠体重后解剖,将获得的肝组织称重并统计数据,计算脏器系数,使用SPSS软件采用单因素方差分析进行组间差异性比较。结果如图1所示,根据统计处理,肝体比总体呈先上升后降的趋势,且S1组肝体比呈显著升高。

图1 地下水污染对ICR小鼠肝体比的影响Fig.1 Effect of groundwater pollution on liver body ratio of ICR mice
2.3 肝组织HE染色观察
肝脏组织HE染色结果如下图2所示,S组ICR小鼠肝结构正常,细胞排列整齐呈索状且形态清晰、核膜完整,中央静脉、肝小叶、肝窦、肝索结构清晰、着色均匀。与对照组相比,S3组肝脏出现铁血黄素沉积(图2中1);出现组织间隙(图2中2)和细胞损伤(图2中3)明显比对照组大。这一结果提示尾矿库周边地下水对ICR小鼠的肝脏在组织水平存在一定程度的损伤效应。
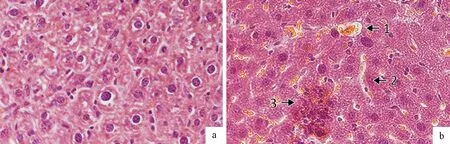
a.S组ICR小鼠肝脏HE染色观察;b.S3组ICR小鼠肝脏HE染色观察a.HE staining of liver in ICR mice in group S;b.S3 group ICR mice liver HE staining observation图2 地下水污染ICR小鼠肝HE染色观察Fig.2 Observation of HE staining liver sections of ICR mice polluted by groundwater
2.4 单细胞凝胶电泳检测DNA损伤
由图3可知,S组ICR小鼠肝细胞DNA为圆形,没有产生拖尾现象,而S3组ICR小鼠肝细胞DNA产生了不同程度拖尾现象,即彗星状。随着污染程度加重,肝细胞的DNA拖尾程度越严重,且尾部DNA %增大。统计分析表明,与S组相比,S1和S3组彗星数量显著性升高(P<0.01),且随着污染程度加重,说明DNA损伤率同样也呈递增趋势。

图3 单细胞凝胶电泳检测DNA损伤Fig.3 Single cell gel electrophoresis for detection of DNA damage
2.5 透射电镜观察ICR小鼠肝细胞
为研究受污染地下水对ICR小鼠肝脏细胞器的影响,选取S3、S1和S组利用透射电镜观察细胞超微结构的变化。如图5所示,S组肝组织结构正常,内质网正常,线粒体结构完整无空泡化现象。与S组相比,S1组肝脏线粒体脊线边界不清晰(图5中a、b),S3组肝脏出现自噬溶酶体(图5中c),线粒体肿胀且脊线紊乱(图5中d、e)。结果证明,尾矿库周边地下水会ICR小鼠的肝脏在线粒体等超微结果中存在一定程度的生物损伤效应。

图4 透射电镜观察ICR小鼠肝细胞Fig.4 The hepatocytes of ICR mice were observed by transmission electron microscope
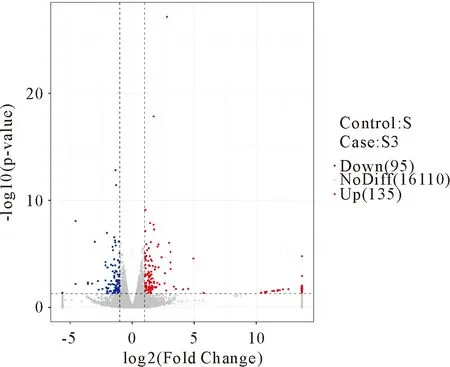
图5 ICR小鼠肝脏基因差异表达Fig.5 Differential gene expressions in liver of ICR mice
2.6 ICR小鼠肝脏转录组测序
2.6.1 基因差异表达情况 为进一步系统分析矿区周边渗漏地下水对ICR小鼠肝脏损伤的分子机制,选取尾矿库受污染最严重库内水S3组水样喂养ICR小鼠30 d后,处死小鼠后将肝组织送转录组测序,如火山图6所示,30 d时S3组肝脏组织中有135个上调基因,95个下调基因。
2.6.2 KEGG富集分析 对差异基因进行KEGG富集分析,结果如图7所示,饲喂S3组水样的ICR小鼠肝脏差异基因主要富集在:MAPK信号通路、AMPK信号通路,内质网中的蛋白质加工,癌症中的转录失调、FoxO信号通路、以及多种癌变通路等方面。

a.S3组处理30 d时ICR 小鼠肝脏 KEGG 气泡图;b.S3组处理30 d时ICR 小鼠肝脏 KEGG 柱状图a.KEGG bubble plot of liver in ICR mice treated with S3 for 30 d;b.Bar graph of KEGG columns in liver of ICR mice treated with S3 for 30 d图6 ICR小鼠肝脏KEGG富集分析Fig.6 Enrichment analysis of KEGG in liver of ICR mice
3 讨论
肝脏是脊椎动物身体内主要的新陈代谢器官,发挥着脱氧、储存肝糖和分泌蛋白的合成等身体必须的功能[6],并且在多种复杂生化过程中如维生素的活化和储存,胚胎期的造血功能中承担重要角色[7]。由于肝脏内含有一种活性的金属硫蛋白,导致有毒物质最容易积累于肝脏[8],有毒物质能影响肝脏中的酶活力[9],同时也能引起肝细胞内线粒体损伤[10]。张娜等报道可通过抵抗线粒体损伤保护肝细胞[11],有研究表明铁血红素沉积会使器官功能受损[12],张晓莉等报道发现中老年犬肝脏间隙增大[13]。有研究表明,一些稀土金属矿区泄漏造成的地下水污染的核心污染成分不是重金属,而是大量的盐离子[3]。因此,评估有毒污染物对生物体肝脏的损伤具有重要的意义。
综上所述,本研究发现尾矿库污染地下水中主要的污染因子仍是之前报道的盐离子,如F-、Cl-等。结果发现,矿区周边渗漏导致的地下水污染能够导致肝脏的结构不完整,随着污染程度加重肝体比呈先升后降的趋势。组织水平HE鉴定结果表明,试验组出现铁血红素沉积、细胞损伤和间质间隙增大。从肝组织制备单细胞悬液进行彗星实验检测DNA损伤率,发现S3组ICR小鼠肝细胞DNA产生了不同程度拖尾现象,即彗星状。随着污染程度加重,肝细胞的DNA拖尾数目增多程度越大,说明DNA损伤率同样也呈递增趋势。通过透射电镜观察肝细胞发现与S组相比,S3组处理之后肝细胞出现线粒体脊线不连贯且出现线粒体空泡化的现象。
转录组测序结果显示,样点S3喂养30 d的ICR小鼠,肝组织中有135个上调基因,95个下调基因。差异基因进行KEGG富集分析发现饲喂S3组水样的ICR小鼠肝脏差异基因主要富集在MAPK信号通路、AMPK信号通路,内质网中的蛋白质加工,癌症中的转录失调、FoxO信号通路以及多种癌变通路等方面。因此,本研究初步证实ICR小鼠肝功能遗传损伤研究的分子机制,后续有待进一步建立肝细胞模型深入研究。
