7株羊源大肠埃希氏菌的分离鉴定及相关耐药基因的研究
2022-10-12崔羽茜丹雨晴武慧敏陈海霞任玉鹏朱江江
崔羽茜,丹雨晴,武慧敏,陈海霞,向 华*,任玉鹏,朱江江
(1.西南民族大学畜牧兽医学院,四川成都 610041;2.青藏高原动物遗传资源保护与利用,四川省重点实验室,四川成都 610041)
大肠埃希氏菌(Escherichiacoli)俗称大肠杆菌,是一种常见的致病菌,不仅可以感染多种动物,还可以通过食物链或直接接触传播给人类,给人类带来潜在威胁[1]。大肠埃希氏菌主要侵害6周龄内的羔羊,以消化道为主要传播途径,以腹泻和败血症为主要特征,感染率与病死率较高,给养羊业造成了很大的危害[2]。目前随着养殖业的集约化、规模化发展,抗生素作为治疗大肠埃希氏菌感染的一类有效药物,广泛使用于畜禽的养殖过程中,但由于抗生素的不规范使用,造成大肠埃希氏菌耐药性较为严重,耐药谱增宽,甚至产生了多重耐药的情况。近年来,研究者们对国内外的不同大肠埃希氏菌分离菌株进行药敏试验,结果显示大肠埃希氏菌的耐药率较高,其中包括人和动物常用的抗生素卡那霉素、四环素、环丙沙星、恩诺沙星等药物[3-5]。
细菌耐药性的来源有两个途径,分别是自身基因突变和耐药基因的获得。自身基因突变是一种自发性随机事件,机率小,且不稳定,无论抗菌药物是否存在都有可能发生。但如果有抗菌药物选择压力的存在,敏感细菌繁殖受到抑制甚至杀死,而携带有耐药基因的突变菌株却具有生存优势,最终留下耐药亚群,是造成目前如此严峻耐药局面的主要原因[6]。然而,目前关于大肠埃希氏菌耐药基因的研究主要围绕禽类和仔猪,对羊源大肠埃希氏菌的研究比较少,羊大肠埃希氏菌病的临床治疗和用药资料不足。
因此,本试验选取了11种抗生素对7株大肠埃希氏菌进行药物敏感性试验,结合PCR方法,对β-内酰胺类、氨基糖苷类、四环素类、喹诺酮类共24种耐药基因进行检测分析,探索羊源大肠埃希氏菌的耐药表型及耐药基因的携带情况,以期为临床中羊大肠埃希氏菌病的防控和治疗提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品 四川省某规模化羊场,2021年存栏2 000只,采集50份小肠段,将采集样品立即置于无菌采样袋内,冰盒内保存,立即带回实验室进行细菌学分析。
1.1.2 主要试剂 麦康凯培养基、胰酪大豆琼脂培养基(Tryptic sony agar,TSA)、胰酪大豆胨液体培养基(Tryptic sony broth,TSB)、革兰氏染色液、肠杆菌科生化鉴定管、药敏纸片,杭州微生物试剂有限公司产品;伊红美蓝培养基,北京奥博星生物技术有限责任公司产品;PremixTaq成都市蓉为基因生物科技有限公司产品;DNA Ladder Marker DL 2 000,US ERVRBRIGHT®INC公司产品。
1.1.3 主要仪器 TC-96/G/H(b)C基因扩增仪,杭州博日科技有限公司产品;Legend Micro 21高速离心机,Thermo Fisher公司产品;电热恒温水浴锅,北京市永光明医疗仪器有限公司产品;SW-CJ-2FD洁净工作台,苏州安泰空气技术有限公司产品;ZWY-240恒温培养振荡器,上海智城分析仪器制造有限公司产品;隔水式恒温培养箱,上海齐欣科学仪器有限公司产品;LDZF-50KB立式压力蒸汽灭菌锅,上海申安医疗器械厂产品;DHG-9203A电热恒温鼓风干燥箱,上海一恒科技有限公司产品;凝胶成像仪,上海天能科技有限公司产品。
1.2 方法
1.2.1 细菌的分离纯化 在超净工作台内,使用接种环将采集的50份小肠段,采用连续划线法将其样本分别接种于高压灭菌后的麦康凯培养基和伊红美蓝培养基上,37℃恒温培养18 h,观察细菌的生长情况及菌落特征。选取在麦康凯培养基上培养18 h后的单个粉红色菌落进行革兰氏染色。染色镜检观察到符合大肠埃希氏菌形态特征的细菌后,将菌落的剩余部分接种于TSB液体培养基当中,置于37℃摇床培养16 h。挑取菌液在无菌条件下划线接种于新的麦康凯培养基上,如此连续进行3次纯培养。对纯化后的细菌再次进行革兰氏染色镜检。
1.2.2 大肠埃希氏菌的鉴定
1.2.2.1 生化鉴定 在超净工作台中,从纯培养的麦康凯培养基上长出的粉红色菌落或者伊红美蓝琼脂培养基上长出的黑色带有金属光泽的菌落,用接种针挑取纯化的待检菌单菌落垂直接种到肠杆菌科生化鉴定管内,置于37℃恒温培养箱培养24 h~48 h。
1.2.2.2 分子生物学鉴定 参考董映辉[7]等人的研究,用16S rRNA引物进行PCR鉴定,引物的序列及扩增片段长度见表1,引物由上海生工生物工程有限公司合成。PCR扩增体系(25 μL)∶Taq酶12.5 μL,模板DNA 1 μL,上、下游引物各1 μL,其余用ddH2O补足。PCR扩增程序:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min 30 s,共35个循环;72℃再延伸5 min。PCR扩增产物经20 g/L琼脂糖凝胶电泳检测,检测阳性的PCR产物送上海生工生物工程有限公司进行测序。将测序结果与GenBank中登录参考株进行同源性分析,鉴定标准按照同源性≥99%判定。
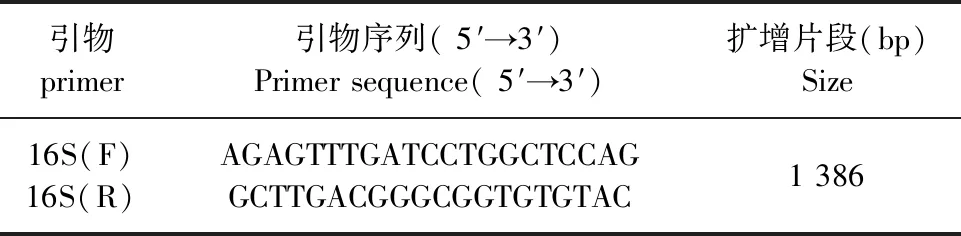
表1 16S rRNA引物信息Table 1 16S rRNA primer information
1.2.3 大肠埃希氏菌的增菌及保种 在超净工作台中,从纯培养的麦康凯培养基上挑取单个菌落,加入准备好的TSB液体培养基,封口,放入37℃恒温摇床进行培养,待细菌到对数生长期,将菌液和甘油按照3∶2进行混匀,置-20℃保存备用。
1.2.4 药敏试验 本试验采用K-B纸片法。从培养17 h平板上的菌落上挑取数个单个菌落,直接接种9 g/L生理盐水制成菌悬液,使用比浊仪调整悬液的浊度使其达到0.5麦氏单位。用移液枪将150 μL菌悬液接种于营养琼脂培养基上,并用无菌涂布棒涂抹均匀,使细菌密布于培养基的每个角落,药物敏感纸片贴于培养基内,保证每个药敏片之间距离相等。放置37℃温箱培养18 h后观察有无抑菌圈及抑菌圈大小。用直尺测量肉眼观察到的抑菌圈,抑菌圈的边缘以肉眼看不到细菌生长为限,每个菌环测量3次取其平均值。按照世界临床实验室标准委员会推荐的标准(见http://www.hangweimedia.com/support/t_doc/2018-03-09/6.html),对7株大肠埃希氏菌进行了15种抗菌药物的耐药性检测,结果可分为敏感、中介、耐药3种。
1.2.5 耐药基因检测 根据相关参考文献合成四大类共24对耐药基因引物,引物信息见表2,引物由上海生工生物工程有限公司合成。分别提取7株大肠埃希氏菌的DNA作为模板,进行耐药基因的PCR检测,耐药基因包括β-内酰胺类blaTEM-1基因、氨基糖苷类rmtA、rmtB、rmtC、rmtD、rmtE、npmA、armA基因、四环素类Tet(A)、Tet(C)、Tet(D)、Tet(E)、Tet(L)、Tet(W)、Tet(O)、Tet(M)、Tet(K)基因,喹诺酮类qnrA、qnrB、qnrC、qnrD、qnrS、oqxA、qepA基因。PCR扩增体系:2×TaqPCR MasterMix 12.5 μL,上、下游引物各1 μL,DNA模板1 μL,加ddH2O补足至25 μL。扩增程序为:94℃预变性5 min;94℃变性5 s,退火温度见表2,72℃延伸1 min,72℃再次延伸10 min,共35个循环。扩增后的PCR产物经20 g/L琼脂糖凝胶电泳进行分析。

表2 耐药基因引物信息Table 2 Primer information for drug resistance genes
2 结果
2.1 细菌分离及镜检
从所有样品中分离出7株疑似大肠埃希氏菌,分离率为14%(7/50)。纯培养后的细菌在普通琼脂培养基上形成圆形、湿润、半透明、隆起的乳白色中等大小菌落(图1A);在伊红美蓝培养基形成黑色的带金属光泽的菌落(图1B);在麦康凯培养基上长出粉红色菌落(图1C),符合大肠埃希氏菌的形态学特征。经革兰氏染色镜检,细菌为散在排列的革兰氏阴性短杆菌(图1D)。
2.2 大肠埃希氏菌的生化鉴定结果
生化鉴定结果见表3,7株经过纯培养的菌株均符合大肠埃希氏菌生化特征。
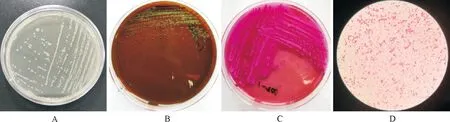
A.普通琼脂培养基上的菌落形态;B.伊红美蓝培养基上的菌落形态;C.麦康凯培养基上的菌落形态;D.革兰氏染色镜检结果A.Colony morphology on common agar medium;B.Colony morphology on eosinmeilan medium;C.Colony morphology on McConkey's culture medium;D.Results of Gram stain microscopic examination图1 疑似大肠埃希氏菌的菌落形态及镜检结果Fig.1 Colony morphology and microscopic examination results of suspected Escherichia coli
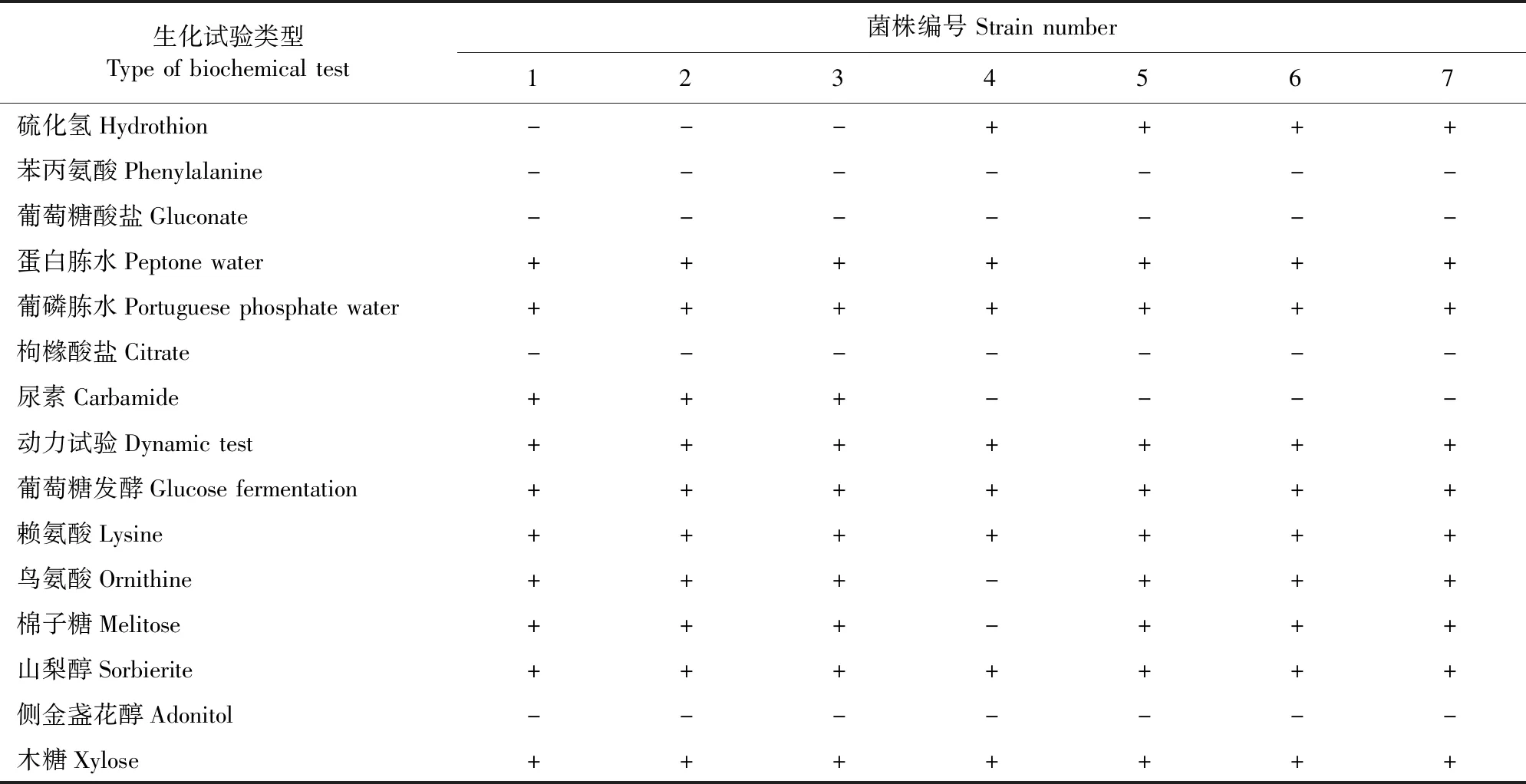
表3 肠杆菌科GYZ-15e编码鉴定结果Table 3 Identification of coding results of Enterobacteriaceae GYZ-15e
2.3 16S rRNA鉴定结果
16S rRNA PCR扩增产物经琼脂糖凝胶电泳,在1 500 bp左右出现与预期大小相符的条带(图2)。进一步测序分析结果显示,7个基因序列与GenBank中登录的大肠埃希氏菌参考株序列同源性均高于99%,表明所分离的菌株为7株不同的大肠埃希氏菌。经MegAlign分析,7株大肠埃希氏菌之间同源性为95.5%~99.0%(图3)。
2.4 药敏试验结果
药物敏感性的结果显示,7株大肠埃希氏菌对多西环素、庆大霉素、大观霉素、丁胺卡那、氧氟沙星、左氧氟沙星和恩诺沙星等高度敏感;对阿莫西林全部耐药;对氨苄西林、四环素、链霉素的耐药率分别为42.86%(3/7)、71.42%(5/7)、28.57%(2/7)(表4)。
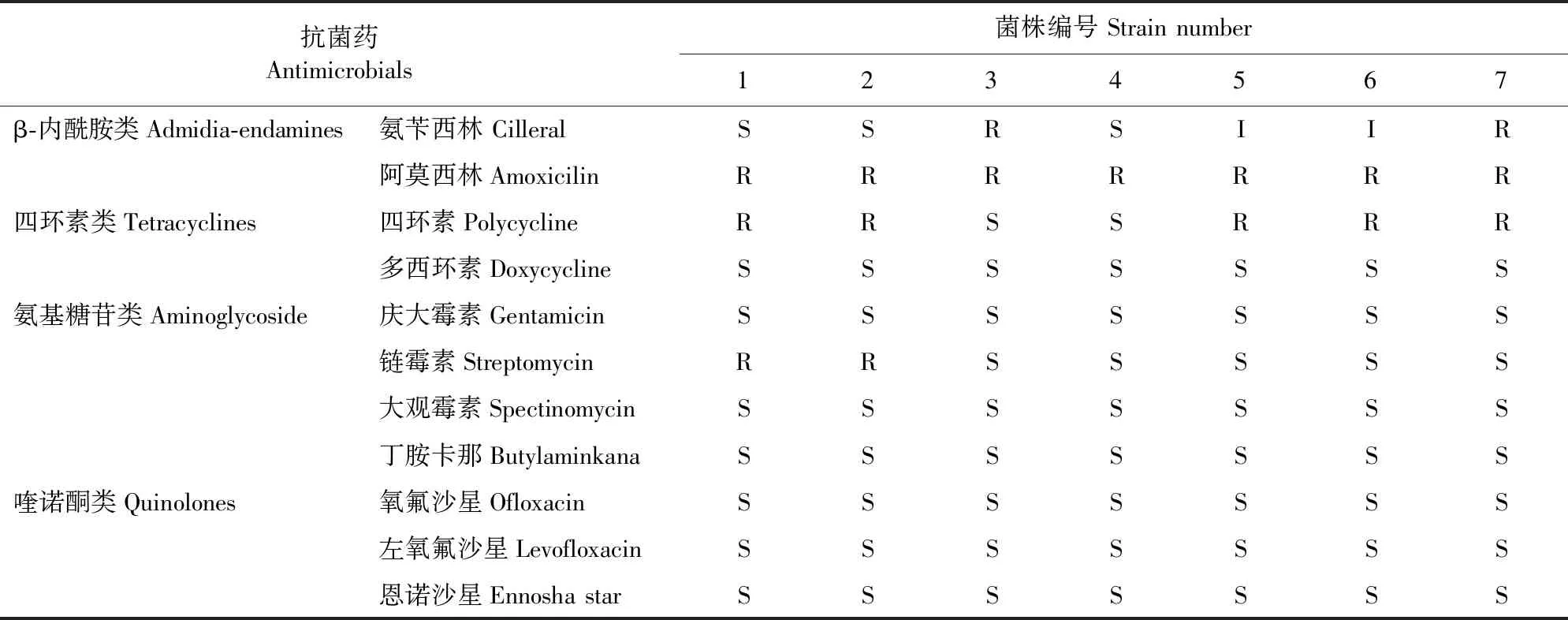
表4 药敏试验结果Table 4 Results of drug sensitivity test
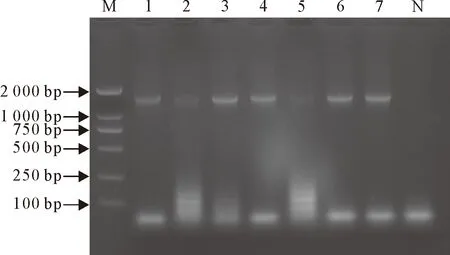
M.DNA Marker DL 2 000;1~7.依次为7株大肠埃希氏菌编号;N.阴性对照M.DNA Marker DL 2 000;1-7.7 strains of Escherichia coli;N.Negative control图2 16S rRNA PCR扩增产物凝胶电泳图Fig.2 Gel electrophoresis of 16S rRNA PCR amplification products
2.5 大肠埃希氏菌多重耐药结果分析
多重耐药试验结果显示,并无对所选的抗生素全部耐药的大肠埃希氏菌,且存在单独耐药的大肠埃希氏菌,7株菌株表现出一定的多重耐药性,其中对3种抗菌药物耐药的菌株占42.86%(3/7)。
2.6 大肠埃希氏菌的耐药基因检测结果
耐药基因检测结果显示(表5),7株分离菌株中,β-内酰胺类blaTEM-1基因检测的携带率为100.00%;氨基糖苷类rmtB、rmtC、rmtD基因检测的携带率均为14.29%;四环素类耐药基因携带率为0~71.43%,其中Tet(A)基因携带率最高,为71.43%;喹诺酮类耐药基因携带率为0~71.43%,其中qnrS、oqxA基因携带率最高,均为71.43%;其余耐药基因携带情况见表5。

表5 耐药基因检测结果Table 5 Drug resistance gene test results
3 讨论
大肠埃希氏菌主要引起羊的出血性胃肠炎及急性败血症,也会引起羊肺炎、成年羊流产、脑膜炎等的并发症或混合感染[16]。检测耐药基因对防止产生细菌耐药性、探索细菌耐药机制具有重要意义[17]。本研究从四川地区分离的7株大肠埃希氏菌对阿莫西林表现出全部耐药,对氨苄西林、四环素、链霉素的耐药率分别为42.86%(3/7)、71.42%(5/7)、28.57%(2/7),其中耐3种药物菌株占分离菌株的42.86%(3/7),说明从四川地区分离的羊源大肠埃希氏菌对常用的抗菌药产生了较强的耐药性,且呈现了一定的多重耐药性。提示在发生该病时和日常防控中应该合理使用抗生素,穿梭用药以减少耐药性产生。
大肠埃希氏菌耐药性的产生不仅与使用抗菌药物的频率有关,还与携带的耐药基因有关。β-内酰胺酶的产生是细菌对β-内酰胺类抗生素产生耐药性的主要机制,它通过水解β-内酰胺环从而灭活β-内酰胺类抗生素[18]。其中TEM型酶是目前数量最多的一类β-内酰胺酶,我国所分布的TEM酶以TEM-1型最常见[19]。本试验中,β-内酰胺类耐药基因blaTEM-1的携带率高达100%,与舒刚[20]等人的研究中84.09%的检出率相似,结合该养殖场的用药情况,这可能与阿莫西林等抗菌药物的长期使用有关。
氨基糖苷类药物的耐药机制之一是16S rRNA甲基化酶(16S RNA methylase,Rmt)的介导,它是通过改变氨基糖苷类抗生素的作用靶位,将甲基集团添加到16S rRNA的特定核苷酸上,从而干扰氨基糖苷类抗生素与核糖体的结合[21]。现阶段研究表明,甲基化位点主要有2个,分别是核苷酸G1405的N7位和核苷酸A1408的N1位[22]。本研究检测的7种氨基糖苷类耐药基因中,rmtB、rmtC、rmtD的检出率均为14.29%(1/7),据研究发现,rmtC主要在日本流行[23],rmtD主要在巴西流行[24],中国主要流行armA和rmtB[25]。本试验首次在我国西南地区发现rmtC和rmtD耐药基因,提示氨基糖苷类耐药基因可由流行的armA和rmtB向不常见的rmtC和rmtD进行转变演化。
Tet属于6个外排泵家族中的MFS家族(主要协助转运蛋白超家族)外排泵,MFS家族是一种交替开放模型,转运蛋白能够在向胞外开放和向胞内开放的构象之间变化,转运蛋白上的底物结合位点暴露在细胞膜的不同侧,底物从细胞膜的一侧结合到蛋白上,而从另一侧被释放[26]。Tet主要与细菌对四环素耐药性有关,有研究发现,Tet外排泵突变可介导细菌对部分四环素类药物产生耐药。大多数四环素外排泵对四环素具有抗药性,但对第二代多西环素的抗药性较差[27],这与本试验的结果相符。Tet(A)是革兰阴性菌中最常见的四环素抗性决定簇[28],近年来的国内外研究都表明,Tet(A)这一外排基因都在检测样本中大量检出,根据其主动外排的耐药特性,提示可以通过研究外排泵的抑制剂或者导致外排泵突变的药物来使其主动外排系统表达的活跃度降低,以此达到使耐药菌的耐药性能下降的目的。
喹诺酮类药物的耐药机制主要有作用靶点DNA促旋酶和拓扑异构酶Ⅳ的突变、介导喹诺酮类耐药质粒的获得和染色体的突变[15]。介导喹诺酮类耐药质粒的获得,是近年来主要研究的一种耐药机制,如已发现介导喹诺酮类低水平耐药的qnrA、qnrS、qnrB、qnrD和qnrC基因,多药转运泵出系统家族中外排泵qepA和oqxA等,这些基因位于质粒上,故被称为质粒介导喹诺酮耐药(plasmid-mediated quinolone resistance,PMQR)因子[29]。本试验检测的7种喹诺酮类耐药基因中,qnrS、oqxA基因的携带率达到71.43%(5/7),qnrD的携带率达到57.14%(4/7),但是7株分离株对3种喹诺酮类药物均不表现耐药性。这3种基因属于介导质粒的获得这一种机制,但并没有引起7株大肠埃希氏菌产生耐药性,这与王婧[30]等人的研究中提到的,质粒的获得一般只引起低水平耐药这一观点相符。尽管PMQR基因仅引起细菌对喹诺酮类药物低水平耐药,但其可使细菌突变频率增高﹐诱发细菌产生高水平的耐药,可对染色体介导的喹诺酮耐药起重要的辅助作用,或促进编码DNA促旋酶的基因的突变和编码拓扑异构酶IV的基因的突变,从而引起高水平的耐药[26,31]。此外,PMQR基因位于质粒上,导致喹诺酮耐药性在人畜病原菌间的迅速扩散成为可能﹐存在引发公共安全事件的风险,需在生产实践中密切关注和跟踪监测,严控PMQR因子向多样化扩展。
本研究通过了解四川某规模化养殖场羊源大肠埃希氏菌的耐药表型及耐药基因的携带情况,可为该羊场的大肠埃希氏菌病的防治提供科学依据。
