抗PD-1免疫治疗联合放疗在鼻咽癌患者中的应用效果及对肿瘤标志物的影响
2022-10-12蓝清华曾庆芳詹涛钟建明
蓝清华 曾庆芳 詹涛 钟建明
鼻咽癌(NPC)主要来自鼻咽部上皮细胞,多位于头颈部,是常见的恶性肿瘤之一。放疗是鼻咽癌的主要治疗方法,能改善鼻咽癌局部控制和患者的总生存期(OS)[1-2]。T 细胞免疫疗法和免疫检查点抑制为临床治疗肿瘤提供新的思路,免疫治疗已经成为治疗肿瘤的新兴方式[3]。程序性死亡受体1(PD-1)/程序性死亡受体配体1(PD-L1)单抗是免疫检查点抑制剂中的关键,具有显著的抗肿瘤作用,且在临床中已经得到广泛的使用[4-6]。Zeng 等[7]发现PD-1 免疫检查点抑制剂治疗肿瘤方面取得新的突破。本研究探讨抗PD-1 免疫治疗联合放疗在鼻咽癌患者的临床疗效及对肿瘤标志物的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2018 年1 月-2022 年1 月赣州市肿瘤医院内科三区收治的鼻咽癌患者113 例患者为研究对象,纳入标准:(1)经过CT、MRI、血清中EB 病毒相关抗体检测,参照文献[8]《中医耳鼻喉科学》确诊;(2)愿意接受放疗;(3)思维清晰。排除标准:(1)精神障碍或者依从性较差;(2)近1 个月内接受化疗或者其他治疗方法;(3)严重肝肾功能障碍;(4)慢性病处于发作期;(5)拒绝接受抗PD-1 治疗或者终末期。依据治疗方式的不同分为观察组(n=57)和对照组(n=56),本研究经过医院伦理委员会批准。患者签署知情同意书。
1.2 方法 所有患者均给予单抗PD-1 治疗,方法:静滴特瑞普利单抗注射液[生产厂家:苏州众合生物医药科技有限公司,批准文号:国药准字S20180015,规 格:240 mg(6 mL)/ 瓶] 用 法:240 mg/次,21 d 为一疗程。对照组单用PD-1 抑制剂,连续用药一直到肿瘤进展或者患者出现不可耐受的现象。观察组在此基础上均给予放疗。患者取仰卧位,热塑面罩固定头颈部位,然后进行CT 检查。然后将扫描的资料上传到三维治疗系统,由专业医师画出靶区,鼻咽肿瘤体积(GTVnx)为70.06 Gy、颈部淋巴体积(GTVnd)为65.28 Gy,原发肿瘤2~2.3 Gy,分割次数为33 次,5 次/周,依据患者治疗协作组(RTOG)0615 和RTOG0225 的情况评估危及器官限制剂量和计划。
1.3 观察指标及评价标准 1 个月后进行指标评价。(1)客观缓解率:经过CT 影像学检测,采用面积软件确定肿瘤的大小,取其平均值。依据患者肿瘤大小确定临床疗效。完全缓解(CR):1 个月后经过影像CT 检查,所有肿瘤目标已经消失。部分缓解(PR):1 个月后经过影像CT 检查,所有目标肿瘤消失50%以上。稳定(SD):1 个月后经过影像CT 检查肿瘤无任何变化;进展(PD):1 个月后经过影像CT 检查肿瘤增加25%以上,且出现新的肿瘤。客观缓解率(ORR)=(CR+PR)例数/总例数×100%。(2)肿瘤标志物:分别采用治疗前后清晨空腹血4 mL,以3 500r/min 离心5 min,置于4~5 ℃冰箱保存,采用免疫化学夹心法检测鳞状细胞癌相关抗原(SCC),以SCC 大于等于2.5 ng/mL 为阳性标准。CEA 测定结果以0~10 ng/mL 为标准,采用CEA 定量检测试剂盒进行检测,试剂盒由新产业生物医学工程有限股份公司提供,具体操作参照说明书。(3)外周血T 细胞表面PD-1、CD8+、自然杀伤(NK 细胞)表达水平:分别于治疗前后清晨空腹肘部静脉采血4 mL,采用流式细胞仪检测患者CD8+、NK 细胞、PD-1。(4)生活质量:分别于治疗前后采用鼻腔鼻窦结局测试-20(SNOT-20)量表中文版和癌症患者生命质量测定量表(QLQ-C30)对患者的生活质量进行评估。SNOT-20 中文版:包括鼻腔部症状、鼻窦炎症状、睡眠障碍和情感障碍4 个领域,包含有20 个项目。每个项目0~3 分,分数越低,则表示患者的生活质量越好[9]。QLQ-C30量表:包含躯体、心理、社会功能、认知方面及角色5 个方面,分数为0~100 分,分数越高则表示生活质量越好[10]。
1.4 统计学处理 采用SPSS 27.0 软件进行统计学分析,定性资料采用率(%)表示,计量资料以()表示,以χ2进行非连续性变量检验,以t检验进行连续性数据组间比较,P<0.05 表示差异有统计学意义。
2 结果
2.1 两组一般资料比较 观察组男29 例,女28 例;年龄31~75 岁,平均(46.58±10.26)岁;临床分期:Ⅰ期10 例,Ⅱ期12 例,Ⅲ期16 例,Ⅳ期19 例。对照组男28 例,女28 例;年龄30~76 岁,平均(46.63±10.52)岁;临床分期:Ⅰ期12 例,Ⅱ期15 例,Ⅲ期14 例,Ⅳ期15 例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组客观缓解率比较 治疗后观察组ORR 为80.70%,明显高于对照组的64.29%(χ2=4.345,P=0.037),见表1。

表1 两组客观缓解率比较[例(%)]
2.3 两组肿瘤标志物比较 治疗前,两组SCC、CEA 水平比较,差异均无统计学意义(P>0.05);治疗后两组SCC、CEA 水平均降低,且观察组均低于对照组(P<0.05)。见表2。
表2 两组肿瘤标志物比较[ng/mL,()]

表2 两组肿瘤标志物比较[ng/mL,()]
2.4 两组外周血T 细胞表面PD-1、CD8+、NK 细胞表达水平比较 治疗前,两组PD-1、CD8+、NK细胞表达水平比较,差异均无统计学意义(P>0.05);治疗后,两组PD-1、CD8+表达水平均明显升高(P<0.05),观察组PD-1、CD8+均高于对照组(P<0.05),两组治疗后NK 细胞与治疗前比较,差异均无统计学意义(P>0.05);两组治疗后NK 细胞比较,差异无统计学意义(P>0.05)。见表3。
表3 外周血T细胞表面PD-1、CD8+、NK细胞表达水平比较[%,()]

表3 外周血T细胞表面PD-1、CD8+、NK细胞表达水平比较[%,()]
2.5 两组生活质量比较 治疗前,两组SNOT-20、QLQ-C30 评分比较,差异均无统计学意义(P>0.05);治疗后,两组SNOT-20 评分均降低,观察组低于对照组(P<0.05),两组QLQ-C30 评分均升高,且观察组高于对照组(P<0.05)。见表4。
表4 两组生活质量比较[分,()]
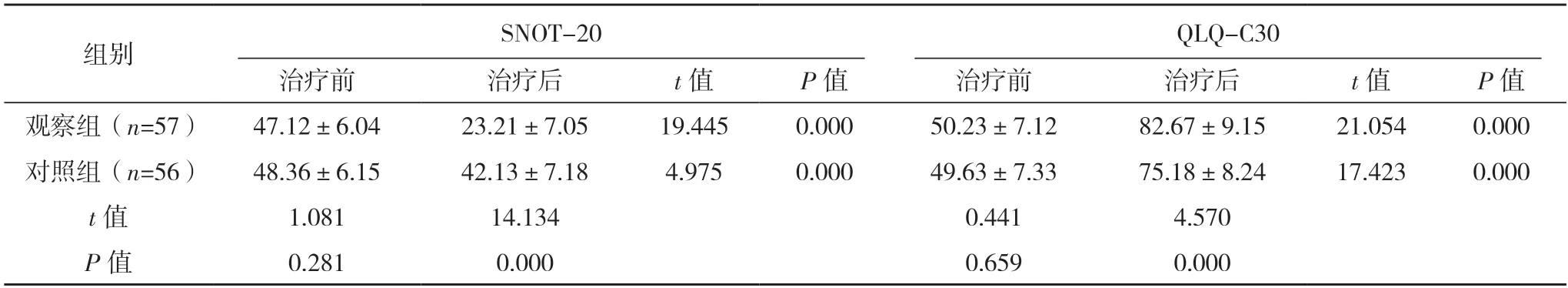
表4 两组生活质量比较[分,()]
3 讨论
鼻咽癌是多发生于头颈部的恶性肿瘤,经过调查显示,我国每年鼻咽癌的发病率占全球的80%~85%[11]。鼻咽癌早期患者无明显的症状,一旦确诊则为中晚期,给临床治疗带来严重的困难,且鼻咽癌是一种低分化鳞癌,大部分患者对放疗较为敏感,还会损伤正常组织细胞,并且治疗后患者还容易出现皮肤溃烂、疼痛、口腔黏膜炎等并发症。目前,抗PD-1 免疫治疗联合放疗是临床治疗鼻咽癌的首选方式。肿瘤组织中PD-1 表达、微卫星不稳定(MSI)及肿瘤组织的突变负荷(TMB)均已经成为预测免疫治疗的指标,但是其预测效果尚未明确。PD-1 主要表达在T/B 淋巴细胞、单核细胞、间充至细胞及NK 细胞。其主要配体是PD-L1,人类重组蛋白(APCs)、造血细胞和上皮细胞均有表达,但是在肿瘤细胞存在过表达的现象[12]。肿瘤细胞杀伤机制是肿瘤细胞和免疫效应细胞的相互表达过程中,其肿瘤细胞表面PD-L1 结合免疫效应细胞表面的PD-1,表达出免疫抑制信号[13]。PD-1 抑制剂是隔断PD-1/PDL1 通路,使肿瘤细胞产生免疫作用,进而对肿瘤细胞起到杀伤作用。若免疫治疗产生作用,则抗PD-1 治疗可以活化免疫细胞和效应T 细胞下游细胞会产生相应的变化[14]。
本研究结果显示,观察组患者的客观缓解率高于对照组,治疗后两组SCC、CEA 水平均降低,且观察组均低于对照组,表明抗PD-1 免疫治疗联合放疗可改善鼻咽癌患者临床疗效,抑制肿瘤细胞,改善预后。夏念等[15]研究表明,化疗药物用于肿瘤细胞的亚致死损伤时,对细胞DNA 的修复起到抑制作用,且同步肿瘤细胞,提高放射治疗的敏感性。肿瘤标志物是临床治疗鼻咽癌患者常用的辅助检查手段[16]。CEA 是人胚胎特异性抗原,肿瘤的疗效、进展和转移与CEA 的动态变化密切相关。邓伟明等[17]研究发现,鼻咽癌组织中大量存在CEA,其细胞的凋亡与脱落,均可以检测到。SCC 指标也是临床常检测的肿瘤标物,且与多种肿瘤存在一定的相关性[18]。PD-1 属于CD28 类的一种,其中主要表达位于表面CD4+细胞和CD28+细胞。Miyake等[19]发现PD-1 表达水平越高,则表明PD-1 抑制作用越好。CD8+细胞是一种具有细胞毒T 细胞,其主要效应抗肿瘤免疫[20]。NK 细胞具有直接杀伤靶细胞效应,在抗肿瘤免疫和阻止病毒感染中起着重要的作用[21]。本研究发现,观察组临床治疗后PD-1、CD8+表达水平与治疗前比较均升高,提示抗PD-1 免疫治疗联合放疗能改善鼻咽癌患者的免疫功能[22]。PD-1 抗体阻断PD-1 的识别过程且恢复部分T 淋巴细胞的功能和数量,进而使肿瘤细胞具有免疫耐受能力[23-24]。本研究结果显示,治疗后两组SNOT-20 评分、QLQ-C30 评分均明显改善,观察组改善程度更加明显,表明抗体PD-1 免疫治疗联合放疗在鼻咽癌患者中临床效果更加显著,改善患者的生活质量[25]。
综上所述,抗PD-1 免疫治疗联合放疗治疗鼻咽癌患者临床效果显著,降低肿瘤标志物水平,改善机体免疫功能和生活质量,在临床有良好的应用价值。
