福建省冠状动脉定量血流分数临床应用专家共识
2022-10-11陈良龙罗育坤范林蔡炜郭延松吴志勇陈威柴大军苏津自王焱谢强熊尚全张彦陈金灶王耀国许朝祥黄小洪0罗顺祥郑元琦林施峰陈平林清飞
陈良龙, 罗育坤, 范林, 蔡炜, 郭延松, 吴志勇, 陈威, 柴大军, 苏津自, 王焱, 谢强, 熊尚全,张彦, 陈金灶, 王耀国, 许朝祥, 黄小洪0, 罗顺祥, 郑元琦, 林施峰, 陈平, 林清飞
我国冠状动脉(冠脉)粥样硬化性心脏病(冠心病)的发病率和死亡率高且呈快速上升趋势,由此带来的社会和医疗负担日益严重。经皮冠脉介入治疗(percutaneous coronary intervention, PCI)引导的血运重建是目前治疗冠心病的主要手段。越来越多的临床证据[1-2]表明,只有解除由冠脉狭窄导致血流动力学意义的心肌缺血,患者才能从PCI的血运重建中获得远期收益。鉴于使用压力导丝测量的血流储备分数(fractional flow reserve, FFR)技术临床应用不足,计算冠脉生理学技术应运而生。其中,定量血流分数(quantitative flow ratio, QFR)测定是一种基于冠脉造影(coronary angiography, CAG)的计算FFR技术,可在导管室中实时评估冠脉病变导致有生理学意义的心肌缺血及其严重程度。为了更好地规范QFR的临床应用,让该技术尽快在各类医疗机构中普及使用,特制订福建省冠脉QFR临床应用专家共识。
1 冠脉生理学评估背景
PCI是目前冠心病的主要治疗手段,2020年全国实施例数已达96.8万余例。心肌缺血程度是制定冠心病治疗策略的重要因素,而目前介入导管室中最常用的心肌缺血评价方法是通过冠脉影像,包括CAG、血管内超声(intravascular ultrasound, IVUS)和光学相干断层成像(optical coherence tomography, OCT),观察冠脉狭窄,推测狭窄是否导致下游心肌缺血。研究[3]表明,以影像学观察的冠脉狭窄程度推测患者心肌是否存在缺血,不能客观准确地评价病变与心肌缺血程度的关系。
近年来,冠心病的精准诊疗日益受到重视,而冠脉生理学评估则成为研究热点。冠脉生理学评估是指评估冠脉狭窄病变的生理功能学意义,以精准确定是否需要血运重建及血运重建的方式。大量临床试验结果表明,冠脉生理学评估指导的PCI可显著降低患者的死亡率和主要不良心血管事件(major adverse cardiovascular event, MACE)的发生率,其中基于压力导丝的FFR已成为评估冠心病患者冠脉狭窄是否导致严重心肌缺血的“金标准”,其指导的治疗策略已被证实可改善患者预后[1-2]。中国、欧洲的PCI指南均以I,A证据等级将FFR推荐用于指导无明确缺血证据的中度狭窄病变的血运重建策略[4-5]。然而,FFR测量存在着较多的局限:(1)需使用有创压力导丝,价格昂贵。(2)需使用腺苷等血管扩张药物,部分患者不耐受或有副作用。(3)操作复杂,有血管并发症风险。(4)检查耗时,影响手术时间与效率。因此,FFR在国内使用率不到1%、国外最高使用率也不足30%,极大限制了冠脉生理学评估的临床普及和应用,大量冠心病患者未能获得规范精准的治疗。近年来,临床上出现了无需使用血管扩张药物的非充血态技术,如瞬时无波比值(instantaneous wave-free ratio, iFR)、冠脉远端压力与主动脉根部压力的比值(distal coronary pressure to aortic pressure ratio,Pd/Pa)、静息态舒张期压力比值(diastolic hyperemia-free ratio, DFR)等,但这些技术仍需要昂贵且有创的压力导丝,故其临床使用率不高。
2 QFR的定义与原理
鉴于使用压力导丝测量的FFR类技术临床应用不足,计算冠脉生理学技术应运而生。计算冠脉生理学技术是指无需使用压力导丝和血管扩张药物,基于医学影像进行计算以评估冠脉病变生理功能学意义的一种新技术,有望大幅拓展冠脉生理学的临床应用渗透率,进而提升冠心病诊治精准度,改善患者预后。其中,QFR测定是一种基于CAG的计算FFR技术,可在导管室中实时评估冠脉病变导致心肌缺血的严重程度。QFR测量仅需在常规CAG影像学数据的病变基础上,通过管腔分割与重建、边界条件定义和血流动力学计算等主要步骤,实现介入术中的快速生理学评估[6-7]。
与FFR的测量原理类似,QFR计算的是目标冠脉能为下游心肌提供的最大血流量(Qmax,S)与假设目标冠脉完全健康时能提供的最大血流量(Qmax,N)之比。由于心肌血流量与灌注压的线性关系,当使用腺苷或三磷酸腺苷(adenosine triphosphate, ATP)等血管扩张药物使患者达到最大充血态时,冠脉微循环阻力达到最小值,此时血流量的比值可使用Pd/Pa表示,即:
QFR=(Qmax,S)/(Qmax,N)≈Pd/Pa=(Pa-ΔP)/Pa
QFR测定通过CAG过程中显示的造影剂充盈速度,计算出模拟最大充血态下血流量,结合重建的血管管腔尺寸及形态变化,计算出冠脉病变血管段的下降(ΔP),从而计算得到Pd与Pa的比值,即QFR数值。导致QFR下降的主要因素是狭窄病变处血流与管壁的摩擦增大引起的能量损失,同时扩张段血流紊乱也会导致能量损失。偏心病变、弥漫性病变均会导致压差增加,进一步降低QFR数值。
3 QFR测定操作规范
3.1 用于QFR测定的CAG影像数据规范要求
3.1.1 导管要求 常规造影或其他方法确定目标血管后,调整或更换造影导管或指引导管(至少≥5 F,优选≥6 F),并保证与目标冠脉同轴且稳定。
3.1.2 扩张血管 经导管向冠脉内注射硝酸甘油,以消除冠脉痉挛。
3.1.3 采集要求 造影采集速度设置为至少15帧/s,待造影剂预充盈导管且冠脉内造影剂完全排空后,选择至少1个投照体位采集造影图像,整个采集过程须至少包括:(1)注射造影剂前采集至少1 s 的“空白电影”。(2)采集造影剂在冠脉内完全充盈的全过程,直至末梢血管充盈显影。若造影剂充盈不佳导致显影不清晰,需重新采集。
3.1.4 推注要求 应保持稳定的造影剂推注速度,推荐的推注速度为 4 mL/s、造影剂充盈时间超过1个心动周期。
3.1.5 靶血管段 靶血管段重叠少,短缩少。
3.1.6 图像稳定 造影时不可移床。
3.1.7 造影体位 如需采集多个体位的造影影像,需在上个体位采集完毕至少15 s后,待造影剂完全排空,再选择另一个投照体位进行采集。推荐的造影投照体位见表1,可根据患者实际情况调整5°~10°,采集新的造影体位。

表1 推荐的造影投照体位
3.2 QFR测定标准操作流程
3.2.1 靶病变 选择1幅造影影像序列,应满足病变血管,尤其是靶病变部位显影清晰、重叠且短缩较少。
3.2.2 血管和血流 自动识别或选择正确的血管类型进行分析,检查自动计算的血流速度是否正确,如有需要可手动校正。
3.2.3 关键帧 判断系统自动选择的关键帧是否合适,如有需要可手动更改。优先选择整支血管显影最清晰、运动伪影较小,且病变部位暴露最狭窄、无重叠的1 帧。
3.2.4 感兴趣血管 判断系统自动选择的感兴趣血管段是否合适,如有需要可手动更改。起点优先选择清晰无短缩、无重叠且靠近主动脉的正常段,远端优先选择有明显标志点的正常段,且感兴趣血管段需包括所有病变,长度≥20 mm。
3.2.5 分支检测 系统自动检测冠脉主支和分支轮廓,如有需要可进行适当调整,增加或删减分支。
3.2.6 参考管腔 检查系统自动重建的参考管腔是否合理,保证正常段参考管腔与实际管腔贴合。
3.2.7 二维QFR(2-dimensional QFR, 2D QFR) 完成主支和分支的2D QFR计算,可生成报告。
3.2.8 三维重建 导入第2幅造影进行三维重建,保证两幅影像关键帧位于心动周期同一期相,则选择靶病变部位显影清晰、重叠且短缩较少的帧。对两幅影像进行配准,第2幅造影和第1幅造影的空间夹角不能<25°。
3.2.9 三维QFR(3-dimensional QFR, 3D QFR) 完成主支和分支的3D QFR计算,检查血管三维重建形态、压力回撤曲线、直径变化率曲线和参考管腔。生成QFR测定报告。
4 QFR技术的发展
QFR技术发展至今已经历了3次迭代。初代QFR技术名称为FFRQCA,于2014年完成临床验证,是在最大充血态下采集CAG图像,通过2幅投照体位角度差≥25°的造影序列进行三维重建得到血管几何形态,同时通过心肌梗死溶栓治疗(thrombolysis in myocardial infarction, TIMI)数帧法计算得到患者个体化的血流速度,从而进行QFR的测定。以FFR为参考标准,FFRQCA技术诊断中度狭窄病变的准确度为88%[6],同时还可以得到分支压力回撤曲线,但是冠脉主支和主要分支血管三维管腔模型重建对造影图像的要求极高,同时需要注射血管扩张药物使患者达到最大充血态,临床应用受到限制。另外,需要采用计算流体力学网格化及血流仿真技术,对血管重建的建模要求高,难以推广。
第二代QFR技术简化了计算流程(图1),无需注射血管扩张药物,仅使用2幅体位差≥25°的常规CAG进行QFR测定,同时采用流体力学方程进行压力差的计算,大大简化了计算复杂度。2016—2017年先后完成FAVOR Pilot[7]和FAVOR Ⅱ China[8]临床验证。二代QFR技术仅需要重建冠脉主支血管即可准确评估主支血管的生理学功能,简化操作分析流程,测定速度大幅度提升,临床适用性提高,FAVOR Ⅱ China研究[8]结果显示以FFR为参考标准,QFR诊断准确度为92.7%,且与FFR具有高度一致性和相关性。
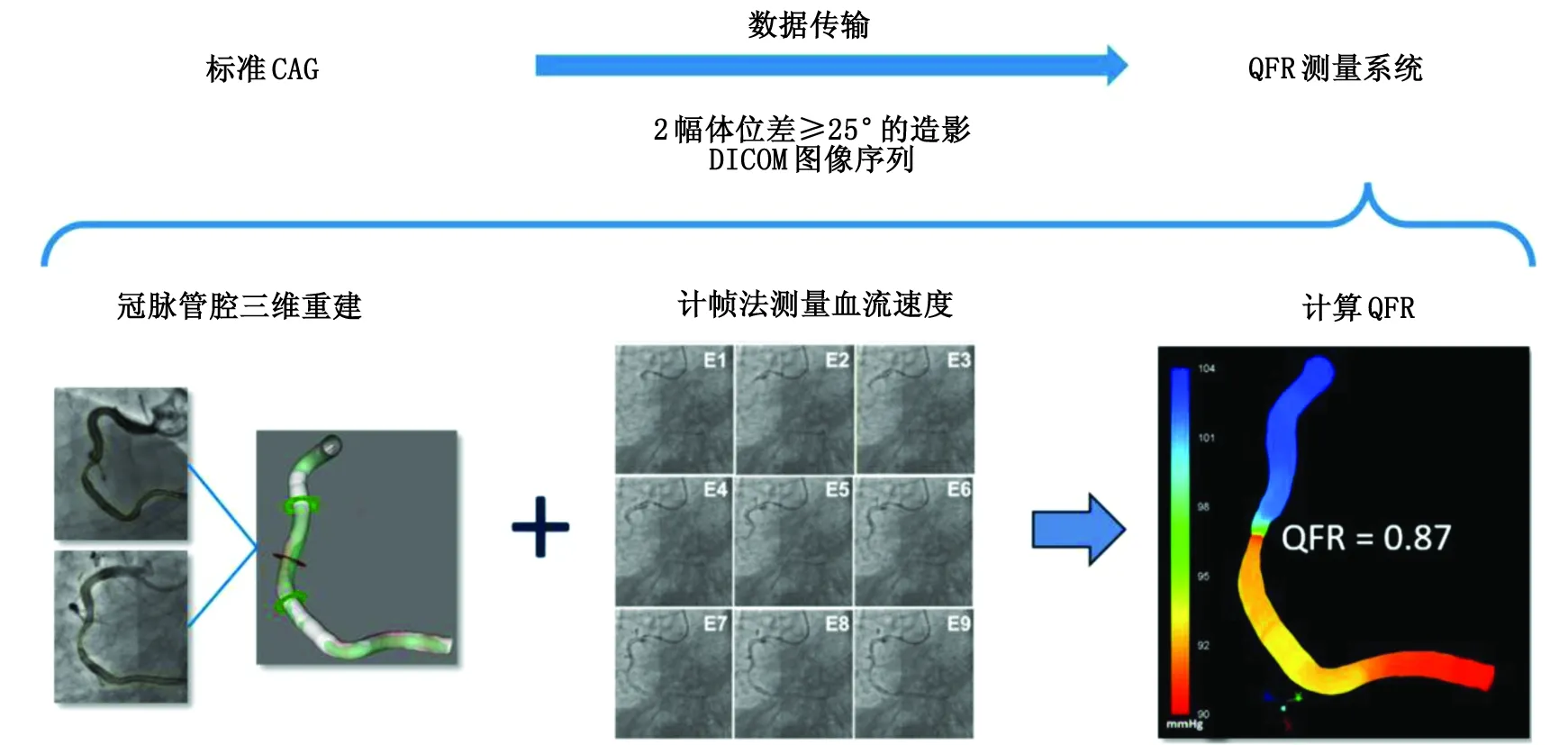
CAG:冠脉造影;DICOM:医学数字成像和通信;QFR:定量血流分数;冠脉:冠状动脉。图1 第二代QFR技术的测定方法Fig.1 Determination method of second generation QFR
第三代QFR技术于2020年完成临床验证,其基于Murray分叉定律,通过1幅常规CAG影像重建出直径梯度下降的参考管腔模型,更符合冠脉血流与管腔的真实关联。同时结合血流动力学分析,可快速同时完成冠脉主支和分支的2D QFR测定。对于复杂病变,还可通过2幅造影图像实现冠脉主支与分支的三维重建,完成3D QFR测定,对病变进行更详细更精准地评估(图2),诊断精度为93%[9]。同时还具有PCI手术规划和虚拟支架功能,可用于辅助指导精准介入治疗手术策略的制定和优化。
根据血流速度的计算方法不同,QFR测定有3种模型,分别是固定血流模型QFR(fixed-flow QFR, fQFR)、造影剂血流模型QFR(contrast-flow QFR, cQFR)和诱导最大充血态模型QFR(adenosine-flow QFR, aQFR)。其中,fQFR是通过大量临床数据统计推测获得的最大充血态下血流速度的经验值作为边界条件计算QFR,无需测量患者实际最大充血态下血流速度;cQFR是根据CAG影像序列中造影剂流动速度计算得到的患者个体化血流速度,以此作为边界条件模拟获得最大充血态下的血流速度,从而计算QFR;aQFR是基于注射腺苷后得到的个体化最大充血态的血流速度来计算QFR。FAVOR Pilot研究[7]证实,以FFR作为“金标准”,cQFR诊断精度优于fQFR,且cQFR与aQFR差别无统计学意义(P>0.05)。鉴于cQFR无需达到最大充血态,推荐临床上采用cQFR。
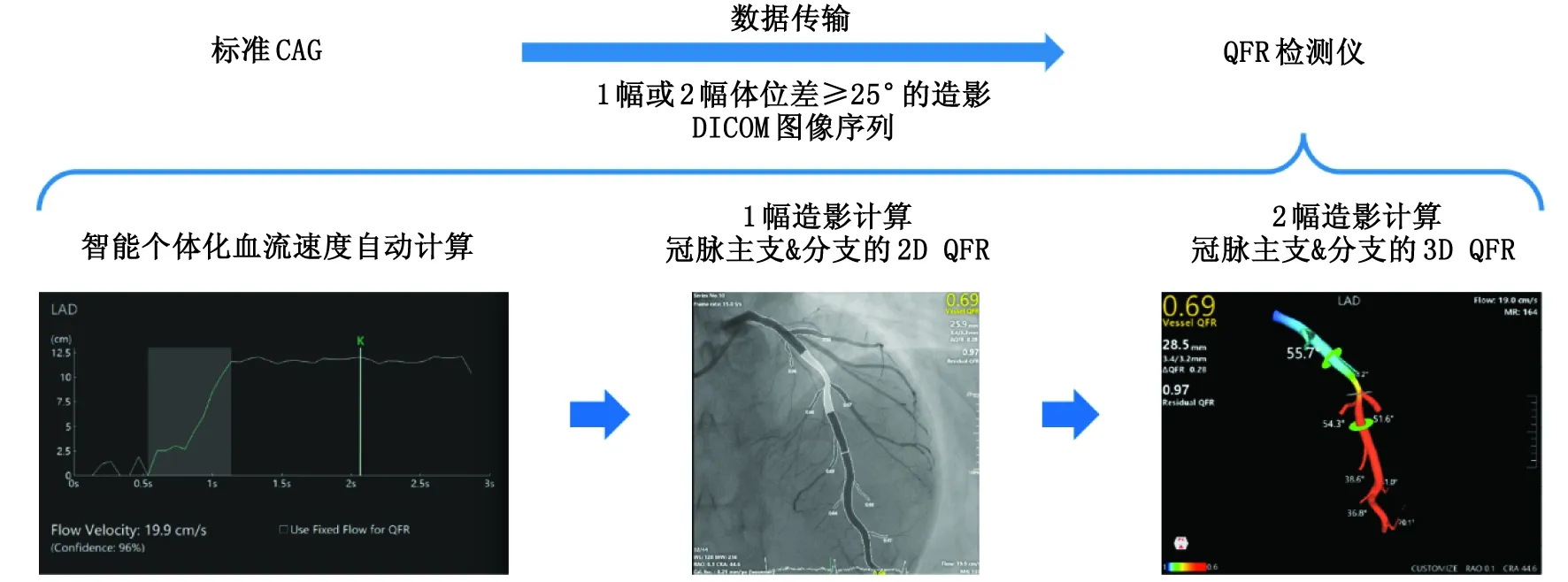
CAG:冠脉造影;DICOM:医学数字成像和通信;QFR:定量血流分数;冠脉:冠状动脉。图2 第三代QFR技术的测定方法Fig.2 Determination method of third generation QFR
5 QFR与FFR对比
FFR能特异性地反映心外膜下冠脉狭窄引发心肌缺血的严重程度,对治疗开口病变、分叉病变、多支病变和弥漫病变均有一定的指导意义,从而辅助PCI治疗决策的制定;QFR与FFR功能相似,也可指导治疗临界病变、开口病变、分叉病变、多支病变和弥漫病变,并对介入手术的疗效进行确认。相比于FFR,QFR具有以下优势:(1)QFR无需注射腺苷或ATP等诱发充血的药物即可进行评估。(2)QFR 评估过程无需使用压力导丝耗材,有利于减小并发症风险,降低患者的经济负担。(3)QFR测定过程简单快捷,更易在手术全程中多次反复测量。(4)QFR 测定可同时获取到血管2D和3D结构定量信息。(5)QFR具有虚拟支架技术,可辅助术者选择合适的支架长度、直径和位置等。
但是QFR也存在缺陷和不足。作为基于造影影像的计算冠脉生理学技术,造影图像质量不佳、血管严重扭曲重叠、造影剂不充盈导致血管边界模糊、血管短缩等均会影响QFR测定。
6 QFR的循证医学证据
FAVOR Ⅲ China (NCT03656848)是一项大型随机对照临床试验[10]。该研究共纳入3 847例患者,33.9%患者患有糖尿病,63.5%患者患有急性冠脉综合征(acute coronary syndrome, ACS)。所有受试者按照1∶1随机分配至QFR指导组和造影指导组,其中QFR指导组对所有QFR≤0.80的病变行血运重建。结果显示:与CAG指导进行PCI相比,QFR指导的PCI可显著改善患者1 a临床终点。MACE定义为全因死亡、心肌梗死或缺血驱动的血运重建的复合事件,其发生率为5.8%。与造影指导组(8.8%)比较,QFR指导组的相对风险下降35%[HR=0.65(95% CI:0.51~0.83),P=0.000 4]。临床终点主要获益源于QFR指导组具有更低的心肌梗死(3.4%vs5.7%,P=0.000 8)和缺血驱动的血运重建(2.0%vs3.1%,P=0.031)发生率。同时,与CAG指导比较,QFR推迟了375例(19.6%)患者造影目测狭窄严重但无血流动力学意义血管的介入治疗,同时发现了85例(4.4%)患者造影目测狭窄不严重但显著缺血和有干预意义的病变,从而改变了445例(23.3%)患者的整体干预策略。另外,QFR指导组医疗资源消耗更低,包括支架植入数量、对比剂用量、辐射剂量和手术时间均显著低于造影指导组。因此,QFR指导的PCI治疗,可显著改善患者预后、优化介入治疗策略、节省医疗开支,具有重要的卫生经济学价值。
目前,还有一项正在进行中的大型随机对照临床研究FAVOR Ⅲ Europe-Japan[11](NCT03729739),该研究将评估QFR指导PCI的患者临床预后是否优于FFR指导的PCI,验证QFR作为生理学评估工具指导稳定型冠心病患者介入治疗是否能使患者远期获益。
7 QFR其他临床证据
7.1 QFR准确度的验证 迄今,QFR技术已完成40余项临床验证性研究。根据2020年发表在欧洲心脏杂志的临床综述[12]汇总,已发表的16项单/多中心临床验证性研究(表2),汇总了亚欧美11个国家共3 299例患者(3 918条血管)的研究,QFR在诊断冠脉狭窄是否导致严重缺血方面有较高的准确度,以“金标准”FFR为参考标准,QFR的诊断准确度为86.0%~94.0%,且与FFR具有高度相关性和一致性。其中,FAVOR Ⅱ China研究[8]是一项前瞻性多中心随机对照研究,证明QFR在患者水平和血管水平的诊断准确度分别为92.4%和92.7%,均显著高于预设目标值75.0%,具有良好的诊断表现,为QFR在介入导管室的普遍使用奠定了良好基础。
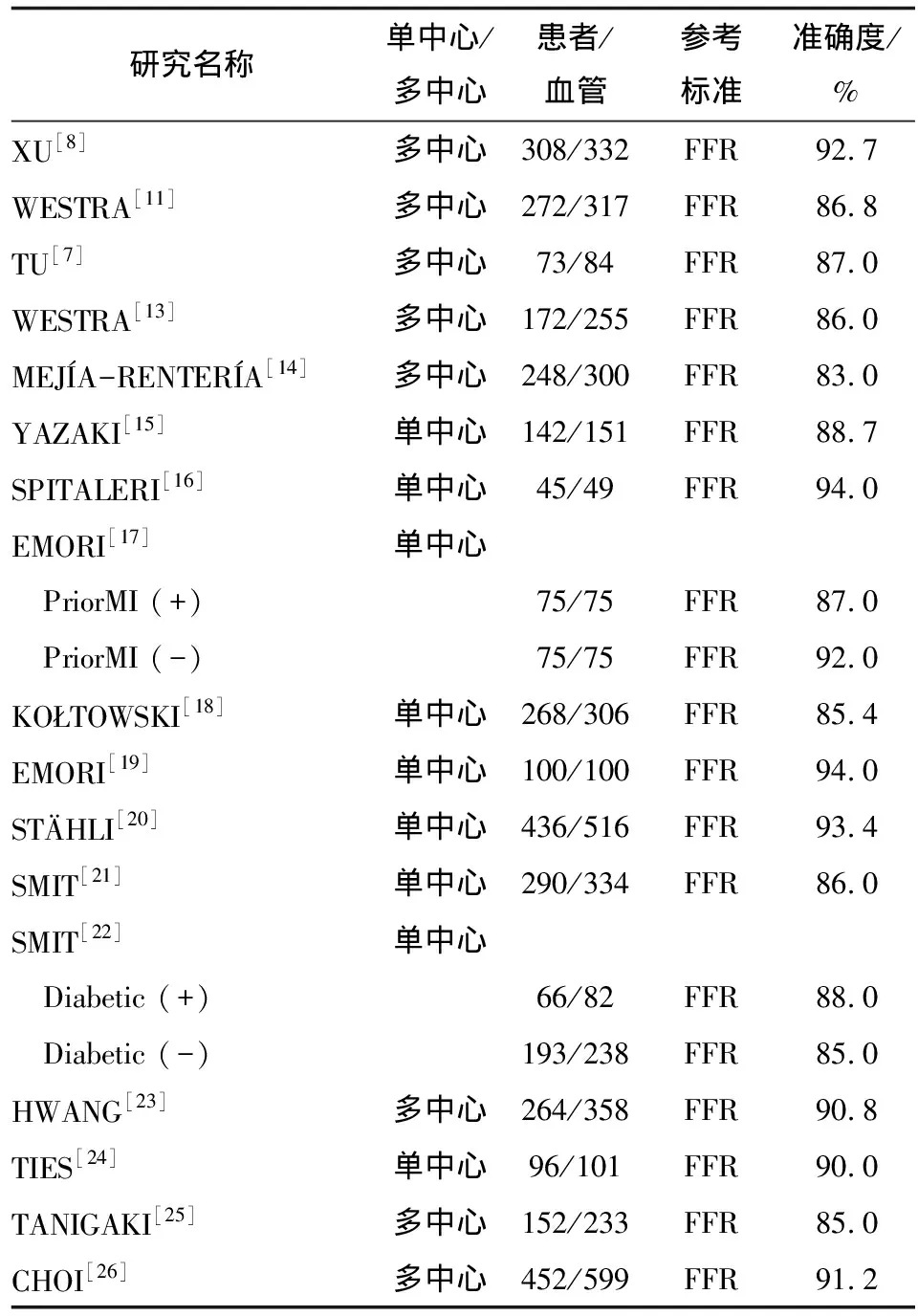
表2 部分QFR临床验证研究结果
7.2 QFR可重复性验证 QFR的诊断准确度依赖于冠脉管腔分割和血流速度的自动计算,若造影影像欠佳,QFR系统自动检测的血管边界可能需分析员手动调整。已有研究[27]表明,不同分析人员的分析结果、同一分析人员多次分析结果均与FFR有较好的一致性。此外,QFR在组内(同一个分析人员多次分析)和组间(不同分析人员多次分析)的结果仍有较高的可重复性[28]。
7.3 QFR评估患者预后的研究 QFR可有效评估患者预后,预测不良事件发生。HAMAYA等[29]共纳入549例患者,研究患者3支血管QFR的总和(3v-QFR)对于评估稳定型冠心病的价值,结果显示,以2.75为阈值,3v-QFR可作为患者术后2 a MACE的独立预测因素。CHOI等[26]共纳入韩国5个中心452例患者599条血管,QFR可有效预测患者2 a 预后,血管QFR≤0.80的患者的2 a 血管相关复合终点(vessel-oriented composite endpoint, VOCE)显著高于QFR>0.80的患者(4.2%vs0.9%, HR:4.650)。ZHANG等[30]基于QFR的功能性SYNTAX评分可提升传统SYNTAX评分方法对冠脉左主干(左主干)或多支病变冠心病患者风险分层和预后预测的能力,预测患者2 a内MACE发生率的ROC曲线下面积显著提升(0.62vs0.65,P=0.000 9)。TANG等[31]也发现,基于QFR的SYNTAX评分与ST段抬高型心肌梗死(ST-segment elevated myocardial infarction, STEMI)患者功能性不完全血运重建及MACE相关,具有良好的预测能力。
发表于EurHearJ的临床综述[32]汇总了5项临床研究(共包括亚欧7国1 368例临床数据),总结了术后即刻QFR预测患者远期临床结果的价值。术后QFR≤0.89的患者在2 a随访期内血管诱发的不良事件的发生率明显高于术后QFR>0.89的患者(25.0%vs3.5%,P<0.001)[33];对于原发性3支病变患者,术后QFR<0.91的血管2 a内发生血管不良事件的概率显著性大于PCI术后QFR≥0.91的血管(12.0%vs3.7%,HR=3.370,P<0.001)[34]。
8 QFR临床应用推荐
QFR适用于狭窄程度≥30%的病变血管功能学评估。QFR可对稳定型冠心病进行功能学评估,可用于ACS非罪犯血管病变的功能学评价,还可结合虚拟支架技术指导PCI治疗策略的制订与优化。
8.1 慢性冠脉综合征
8.1.1 QFR在单支冠脉孤立性病变的应用 对于单支冠脉孤立性病变而非慢性完全闭塞病变或慢性次全闭塞病变,若没有心肌缺血的客观证据,推荐对该病变血管进行QFR测定,决定病变的治疗策略。对QFR≤0.80的病变行血运重建,对QFR>0.80的病变血管采用最优药物治疗。慢性冠脉综合征PCI术中QFR推荐的测定路径见图3。
8.1.2 QFR在左主干病变中的应用 左主干病变的严重程度常常被CAG低估,建议对左主干病变进行QFR测定,辅助术者制订最优治疗策略。对于左主干病变合并前降支和回旋支病变,应当选择合适的体位和造影图像,保证病变充分暴露。
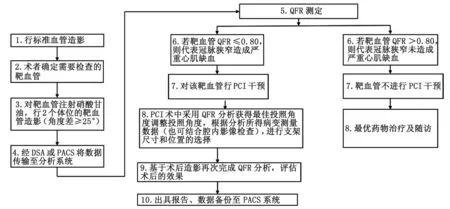
DSA:数字减影血管造影;PACS:影像归档和通信系统;QFR:定量血流分数;冠脉:冠状动脉;PCI:经皮冠脉介入治疗;CCS:慢性冠脉综合征。图3 CCS患者PCI术中建议的QFR测定路径Fig.3 Recommended QFR measurement path during PCI in patients with CCS
8.1.3 QFR在多支冠脉病变中的应用 当多支冠脉病变与患者心肌缺血的关系难以从检查中明确时,QFR可帮助判断诱发心肌缺血的罪犯血管和罪犯病变,为血运重建提供决策依据。因此,对于多支冠脉病变,应采用QFR评估指导完全功能性血运重建,即对QFR≤0.80的病变行血运重建,对QFR>0.80的病变血管采用最优药物治疗。
8.1.4 QFR在串联病变或弥漫性病变中的应用 对于单支串联或弥漫性病变,造影检查常常难以区分罪犯病变,而QFR对于此类病变具有独特的优势。首先可以通过QFR测定决定病变血管是否需要血运重建,其次可通过病变QFR值和回撤曲线明确需要处理的靶病变位置。方法学上,QFR测定为该感兴趣血管区域内所有病变的累加,通过压力回撤曲线可以观测到每一处病变导致压力下降的压力数值,压力数值下降最大的管段即为病变最严重位置,由此可确定靶病变位置。对于串联病变、弥漫病变,可应用QFR虚拟支架技术确定支架落脚点、数量及尺寸,通过术前模拟多种支架的放置手段提前预测术后疗效,实现精准治疗,从而改善预后,提升患者术后生活质量。
8.1.5 QFR在分叉病变中的应用 在分叉病变处理过程中,分支保护十分重要,是降低围手术期心肌梗死和手术并发症的关键。目前公认的观点是简化手术处理流程。QFR测定过程无导丝介入,无损伤病变血管的风险;可同时对主支和分支进行功能学的评估,准确判断分支开口解剖学异常与缺血的关系,对分叉病变治疗策略制订和术中策略更改具有指导作用。
8.2 ACS
8.2.1 非ST段抬高型急性心肌梗死(non-ST-segment elevated myocardial infarction, NSTEMI) 若根据心电图改变和/或CAG特征不能明确引起缺血的罪犯血管时,QFR可辅助判定罪犯血管。
8.2.2 STEMI 因抢救的及时性,不推荐STEMI患者急性期使用QFR评价梗死相关血管病变和指导决定治疗策略。但QFR对于评价发病≥3 d 的梗死相关血管临界病变具有一定的借鉴意义。需要注意的是,QFR在ACS患者群体中的临床证据尚不充分,仍需更多的临床证据验证其诊断效能。目前正在进行的STEMI合并多支血管病变患者分次手术策略的前瞻性、多中心和随机对照研究(STAGED研究)正在探索对于STEMI患者,运用QFR作为判断非梗死相关病变是否有功能学意义的工具,指导后续的择期PCI干预治疗策略的临床意义和价值。
8.3 辅助引导精准介入治疗 多项临床证据证明,基于CAG图像的QFR技术可准确评估冠脉狭窄导致的心肌缺血严重程度;结合病变血管参考管腔的定量结构分析以及生理学评估,虚拟支架技术能预测某一病变完全血运重建后的QFR值(即残余QFR值),可在术前预测支架植入术后生理学恢复程度[35]。术后即刻QFR与残余QFR若存在差异,提示存在支架贴壁不良的风险,可指导术者进行支架后扩张以优化治疗效果。
8.4 解读QFR值的注意事项 QFR测定也存在不足之处,并非所有病变都能通过QFR指导干预策略。对以下情况,QFR的使用及QFR值的解读应注意:(1)造影质量不佳,血管显影不清晰,发生严重重叠或短缩、血管边界模糊等,均会影响QFR检测的准确度。(2)冠脉痉挛会导致血管形态结构发生非功能性改变,需提前注射硝酸甘油消除痉挛。(3)QFR不适用评估慢性完全闭塞病变或慢性次全闭塞病变血管。(4)血管严重扭曲,若病变在扭曲的近端,未累及扭曲段,尚可进行QFR评估;但若病变在扭曲段或扭曲段之后,QFR无法评估。
9 结语和展望
在过去数年中,基于冠脉影像的计算生理学技术已得到全面发展。除了基于冠脉CT血管造影(coronary computed tomography angiography, CCTA)的FFR-CT类技术[36-37]和基于CAG的QFR技术之外,基于OCT或IVUS的计算冠脉生理学技术,利用腔内影像对管腔结构和斑块成分的精准显示,可以改善冠脉生理学的临床评估的效果,有助于提高诊断准确度[38-39]、评估斑块成分及稳定性[40]、识别支架植入效果[41]。冠脉生理学评估已经成为冠心病临床治疗决策的基石之一。
中国原创的QFR技术走在了国际的前列,临床证据已证明QFR可在介入术前、术中和术后全程多环节指导制订精准诊疗方案、优化治疗效果、改善患者预后,带来增量的临床价值。
