AIB1、PGRMC1蛋白在子宫内膜癌中的表达及与Bcl-2蛋白的关系
2022-10-11魏家彬
魏家彬
河南省周口市中心医院病理科 466000
子宫内膜癌(EC)约占中国女性癌症的7%和宫颈癌的20%~30%[1],是威胁女性健康的恶性肿瘤。在许多发达国家,子宫内膜癌的发病率高于宫颈癌,有文献报道其为第一大子宫肿瘤[2]。子宫内膜癌可分为雌激素依赖性组织Ⅰ型和雌激素非依赖性组织Ⅱ型,如子宫内膜腺癌、浆液性癌和良性细胞癌。Ⅰ型子宫内膜癌是最常见的癌症类型,占比为70%~80%,且发病率呈上升趋势。Ⅱ型子宫内膜癌是一种罕见的未确诊疾病,占比为20%~30%。乳腺癌扩增基因1(AIB1)是其核受体的核心,是第1个在遗传性乳腺癌中发现和研究的癌基因。大量研究表明,AIB1基因的增殖和高表达与乳腺癌的病因和发病机制有关[3-4]。而孕激素膜受体1(PGRMC1)作为 MAPR 家族的一员,存在于所有真核生物中[5]。 B细胞淋巴瘤2(Bcl-2)是研究细胞凋亡的最重要基因之一[6]。因此,本文旨在探讨子宫内膜癌中AIB1、PGRMC1蛋白的表达及与Bcl-2蛋白关系。报道如下。
1 资料与方法
1.1 一般资料 选取2019年6月—2021年6月我院收治的58例子宫内膜癌患者为观察组,另选取同期来我院体检的42例健康女性为对照组。其中对照组年龄33~60岁,平均年龄(42.67±10.65)岁。观察组年龄32~65岁,平均年龄(45.37±12.44)岁;分型:Ⅰ型48例,Ⅱ型10例;ER(+)40例,ER(-)18例;组织学分化:低分化19例,中分化19例,高分化20例;分期:Ⅰ~Ⅱ期44例,Ⅲ~Ⅳ期14例;淋巴结转移:有8例,无50例;肌层浸润:≥1/2肌层15例,<1/2肌层43例。两组数据总量差异无统计学意义(P>0.05),具有可比性。所有观察对象家属均知情同意,本研究经医院伦理委员会批准。
1.2 选择标准 (1)纳入标准:①满足子宫内膜癌的诊断标准;②临床资料完整;③均为原发肿瘤;④均未进行术前处理。(2)排除标准:①合并其他肿瘤患者;②妊娠期、哺乳期妇女;③合并其他主要器官功能不全患者。
1.3 方法 免疫组化检测:在5μm处连续解剖所有子宫内膜组织,用SP免疫组化检测AIB1、PGRMC1和Bcl-2的表达。实验中,阳性对照组为乳腺癌组织,阴性对照组为PBS代替一抗。组织切片用二甲苯脱盐,用浓乙醇脱水,室温孵育10min,电烤箱煮沸,抗原固定,PBS洗涤,3% BSA封闭,室温放置10min。滴加一抗,冰箱培养4d,PBS洗涤。加载第二个抗原,在室温下孵育30min,然后用PBS洗涤。DAB染色、水洗、苏木精染色、酒精梯度干燥、二甲苯清漆、中性橡胶密封。
1.4 观察指标 细胞核或细胞质棕黄色颗粒被认为是阳性细胞,在没有染色的情况下被认为是阴性的。使用改进的Sinicrope方法来确定阳性信号所占面积的百分比。<5%为(-),5%~25%为(+),25%~50%为(++),>50%(+++)。由我院病理科的2名专家独立阅读影片,结果不同时,由第3名专家做出决定。

2 结果
2.1 两组AIB1和PGRMC1蛋白阳性率比较 AIB1蛋白在子宫内膜癌中的阳性率为51.72%,显著高于在正常子宫内膜中的4.76%;PGRMC1蛋白在子宫内膜癌中的阳性率为77.59%,显著高于在正常子宫内膜中的4.76%,差异有统计学意义(P<0.05)。见表1。

表1 两组AIB1和PGRMC1蛋白阳性率比较
2.2 AIB1蛋白表达与子宫内膜癌临床病理特征的关系 AIB1蛋白在子宫内膜癌的阳性表达与组织分化程度和肌层浸润深度相关(P<0.05),与组织学类型、ER阳性表达、临床分期、淋巴结是否转移不相关(P>0.05)。见表2。
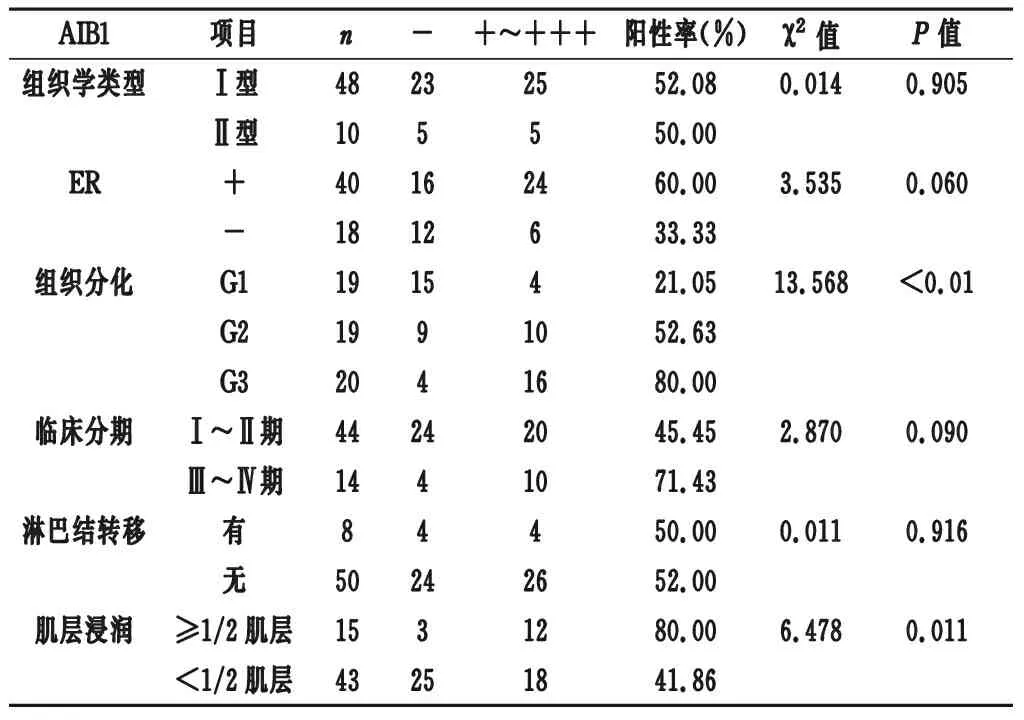
表2 AIB1蛋白表达与子宫内膜癌病理特征的关系
2.3 PGRMC1蛋白表达与子宫内膜癌临床病理特征的关系 PGRMC1蛋白在子宫内膜癌的阳性表达与ER阳性表达相关(P<0.05),与组织学类型、组织分化程度、临床分期、淋巴结是否转移和肌层浸润不相关(P>0.05)。见表3。

表3 PGRMC1蛋白表达与子宫内膜癌临床病理特征的关系
2.4 AIB1、PGRMC1与 Bcl-2 在子宫内膜癌表达的相关性分析 子宫内膜癌患者AIB1蛋白、PGRMC1蛋白与Bcl-2蛋白表达量呈正相关(P<0.05),相关系数分别为0.786、0.737。见表4、表5。

表4 AIB1与 Bcl-2 在子宫内膜癌表达的相关性分析
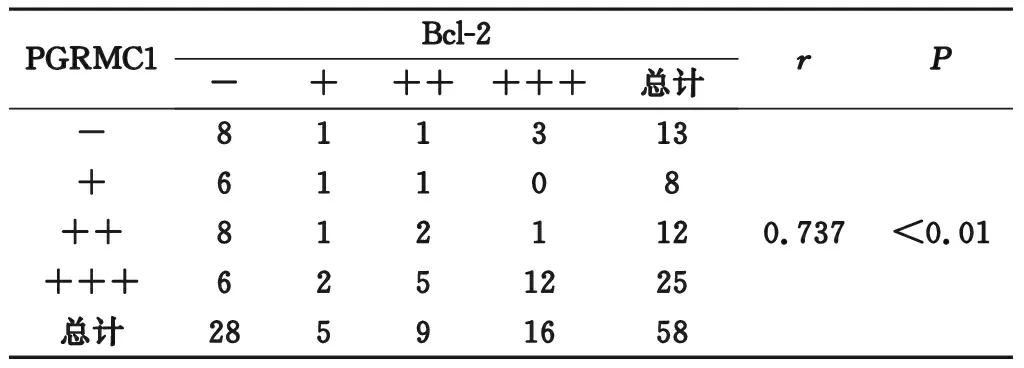
表5 PGRMC1与 Bcl-2 在子宫内膜癌表达的相关性分析
3 讨论
根据生物学行为的病因和类型,EC可分为Ⅰ型和Ⅱ型。Ⅰ型最为常见,占80%~90%。Ⅱ型较少见,但通常预后较差[7]。阴道异常出血是EC的主要症状,常见于绝经后妇女,子宫内膜活检是子宫内膜癌的重要诊断工具。手术是早期(Ⅰ~Ⅱ期)子宫内膜癌患者的首选治疗方案,通常预后良好。 接受放疗、化疗或激素治疗等复杂辅助治疗的患者5年生存率可高达95%,适用于术后复发或晚期(Ⅲ~Ⅳ期)患者[8]。
AIB1属于p160家族,是一种多功能蛋白,在乳腺癌、卵巢癌、宫颈癌等多种肿瘤中均有发现,并已被证实与肿瘤的发生、进展和转移有关[9]。其他科学家认为,AIB1 是索拉非尼和藤黄酸等药物癌症治疗的重要靶点,并且与肿瘤激素治疗的敏感性有关[10]。研究表明,AIB1高表达可以提高ER效率,诱导子宫内膜生长,促进肿瘤发生[11]。此外,AIB1表达与子宫内膜癌的不良预后相关,并可能影响对激素治疗的敏感性[12]。本文结果表明,AIB1在子宫内膜癌组织中的表达高于健康子宫内膜组织,且AIB1表达的阳性率与组织分化程度和有无肌层浸润有关。许多研究表明,AIB1通过ErbB和Wnt/β-catenin信号通路促进癌细胞增殖、存活和侵袭。在乳腺癌、子宫内膜癌和卵巢癌等雌激素敏感性肿瘤中,ER信号传导在癌变过程中发挥重要作用[13]。
PGRMC1属于与膜孕酮受体 (MAPR) 相关的蛋白质家族,MAPR常见于细胞膜、微粒体膜和突触组织膜中。PGRMC1是一种与肿瘤密切相关的小分子蛋白,是第1个从猪身上分离纯化的跨膜结构域,分子量为22~26kDa。其化学结构包括1个N端跨膜结构域和1个C端血红素或细胞色素b5,已知PGRMC1的生化功能可结合来自同一细胞色素b5来源的血红素,也就是说,它们都具有高度的同源性[14]。PGRMC1可能参与怀孕相关的几个过程以及各种肿瘤的起源、发展和进展。PGRMC1存在于人体的各个器官中,其在肝脏或肾脏中高度表达,而在大脑、肺、心脏、胰腺和骨骼肌中表达可能较差。 研究表明,PGRMC1在各种肿瘤组织和相关细胞系(乳腺癌、肺癌、甲状腺癌、结肠癌等)中呈高表达,且在宫颈癌细胞系和卵巢癌组织中均有表达,在晚期卵巢癌中也有高表达。PGRMC1参与子宫内膜癌细胞的生长过程,增加PGRMC1的表达已被证明可以降低癌细胞对化疗的敏感性。研究表明PGRMC1在子宫内膜癌组织中表达最为强烈[15]。细胞增殖活性可以通过PGRMC1表达来调节。
本文结果表明,PGRMC1的阳性表达与子宫内膜癌的病理形态有关;进一步分析表明,PGRMC1蛋白在子宫内膜癌中的阳性表达与ER水平相关。ER和PR均与子宫内膜癌的发病和发作密不可分。雌激素可以刺激子宫内膜的生长,但孕酮通常会抑制子宫内膜的生长,两者有拮抗作用,但雌、孕激素对子宫内膜的作用会影响肿瘤细胞,容易发生浸润[16]。 本文还发现子宫内膜组织中AIB1、PGRMC1和Bcl-2的表达存在相关性,三者可以协同作用,促进子宫内膜癌的发展和进展,但具体机制仍有待进一步研究。
综上所述,AIB1、PGRMC1蛋白与子宫内膜癌的发生相关。AIB1蛋白的过表达在子宫内膜癌分化程度、浸润过程中可能起一定的作用,PGRMC1蛋白的过表达与ER表达水平相关。AIB1、PGRMC1蛋白有可能协同Bcl-2促进子宫内膜癌的发生、发展。
