伯氏疟原虫Pb22截短蛋白免疫血清的传播阻断能力的研究
2022-10-10于鑫鑫赵碧宁吴宇迪原千舒曹雅明
于鑫鑫,赵碧宁,吴宇迪,原千舒,刘 珊,曹雅明,刘 飞
(中国医科大学 基础医学院,辽宁 沈阳 110021)
2020年世界卫生组织(WHO)报告的数据显示,2019年全球87个疟疾流行国家共出现约2.29亿例疟疾病例,因疟疾死亡人数约达40.9 万人[1]。《2016-2030年全球疟疾技术战略(GTS)》预估了实现2020年、2025年和2030年里程碑所需的资金,2016年所需资金总额估计为41亿美元,2020年增至68亿美元,预计每年还需要7.2亿美元用于全球疟疾防治研究和新药开发。疟疾的流行无疑对世界的健康水平提升和经济水平发展造成了不小的阻碍。尽管在人类“抗疟”战役的几百年间,人们已经掌握了一定的手段控制疟疾的发病和传播,但是随着时间的推进,很多问题也逐渐浮出水面。最早用于治疗和预防的常用抗疟药氯喹(CQ)的疗效正在迅速下降,导致疟疾死亡率进一步上升[2]。为了应对CQ耐药性迅速演变的威胁,许多国家采用磺胺多辛-乙胺嘧啶(SP)作为无并发症疟疾的一线治疗方法。然而,这种方法在许多疟疾流行国家也很快出现了治疗临床疟疾失败的证据[3]。2000年,为应对CQ和SP治疗临床疟疾的疗效下降,世卫组织发布了使用以青蒿素为基础的联合疗法的建议[4]。为了预防大规模耐药情况再度出现,疫苗研究势在必行。传播阻断疫苗 (Transmission Blocking Vaccine,TBV) 主要是筛选有性阶段或蚊阶段的疟原虫的表面抗原,免疫人类诱导相应的抗体,以阻止疟原虫的有性发育,从而阻断疟疾的传播[5]。以往的研究显示,有多种疟原虫蛋白符合TBVs 候选抗原的要求,但仅有极少数抗原明显表现出良好的传播阻断效应,如P230[6]、P48/45[7]、HAP2[8]、P25[9]和 P28[10]。迄今为止,唯一发表了现场研究结果的恶性疟原虫TBV (Pfs25-EPA)在体外试验中显示了良好的结果,但用美国的疫苗接种志愿者的血清饲喂感染疟原虫的蚊子后,却未能在蚊子体内显现出显著的传播阻断活性[11]。另外,经试验发现,P25/28、P230、P48/45 和 HAP2 诱导的抗体虽有明显的传播阻断活性,但尚未达到预期的完全阻断效果[12]。因此,提升已知抗原在传播阻断过程中的作用效果,同时寻找新的、具有传播阻断能力的抗原成为TBV疫苗研发工作最亟待解决的问题。本研究根据TBVs候选抗原的三个特点,即表达在有性阶段,含有信号肽或跨膜区,在疟原虫种属中保守[13],在PlasmoDB中检索到基因PBANKA_0305900在配子体阶段表达量较高,分子量22 kDa。因此将其选定为研究对象并命名为Pb22[14],同时比较Pb22全长蛋白Fu-Pb22(19~218 aa)及其截短蛋白Tr-Pb22(34~149 aa)的抗体效价、表达阶段和传播阻断效果,进一步验证Pb22蛋白具有成为传播阻断疫苗候选抗原的潜能,从而为研发疟疾疫苗提供新的参考。
1 材料与方法
1.1 材料
1.1.1 虫株及实验动物PlasmodiumbergheiANKA株,由中国医科大学免疫教研室(本实验室)保存;雌性BABL/c小鼠,购自北京维通利华。
1.1.2 载体与菌株 原核蛋白表达载体 pET32a (由本实验室保存);大肠埃希菌DE3菌株(由本实验室保存)。
1.1.3 培养基 RPMI 1640培养基;配子体出丝培养基(75% PRMI1640,25% 胎牛血清,500 μL青链霉素,50 μL肝素钠);动合子培养液[15](RPMI 1640含20%(体积比)胎牛血清,50 mg/L青霉素,50 mg/L链霉素,pH 8.3)。
1.1.4 主要试剂与仪器设备 PCR-Plus-Neo 酶(购自日本TOYOBO);限制酶BamHⅠ、NotⅠ及其缓冲液 (购自美国NEB);Ni-NTA His BindSuperflow琼脂糖柱 (购自德国Merck-Novagen);经DAPI或HRP标记的羊抗鼠 IgG 抗体(购自美国Thermo);FBS胎牛血清 (购自美国HyClone);青链霉素(购自美国GENEVIEW);ECL发光试剂盒(购自中国碧云天生物技术公司)。各量程移液器 (美国Thermo);垂直电泳槽(VE-180,上海天能科技有限公司);电转槽(mini-Trans Blot,美国BioPad);分析天平(L-1660 DTP,日本 Shimadzu);电热恒温培养箱(HH-B11-420,上海跃进医疗器械厂);OLYMPUS 显微镜及成像系统(BX53,日本 OLYMPUS);涡旋振荡器(VORTEX-5,海门其林贝仪器制造有限公司)。
1.2 方法
1.2.1 生物信息学分析 应用疟原虫数据库PlasmoDB下载P.bergheiprotein 22 (Pb22) 基因序列,筛选其同源基因及上下游基因并应用 BLAST 进行基因比对,应用 SMART预测蛋白的信号肽和结构域。
1.2.2pET32a-Tr-Pb22表达载体的构建 ①引物设计:为表达Tr-Pb22蛋白,排除蛋白的信号肽、跨膜域和低度复杂区设计引物。具体信息:Tr-F:cgcGGATCCTCAGCTAATAATGATAATATAC(BamHⅠ),Tr-R:cgGCGGCCGCAACCTTGATTGCAAATAAATC(NotⅠ)。②目的基因扩增与PCR产物的回收:以P.berghei基因组DNA为模板,扩增目的片段后,将PCR产物回收。③原核表达载体构建与鉴定:将回收得到的产物经BamHⅠ和NotⅠ双酶切后连接到pET32a质粒上,再转化到DH5α感受态中,挑取经菌体PCR方法鉴定的阳性菌落扩大培养并送检测序。选择测序结果正确的菌液提取质粒,将其转化到宿主菌RGB中,选择鉴定正确的菌落待进行蛋白表达。
1.2.3 蛋白的表达与纯化 挑取经鉴定正确的菌落,将其接种于3 mL新鲜的LB培养基,37 ℃ 摇菌过夜,次日以1∶100(体积比)的比例转接到新鲜的 LB 培养基中,37 ℃ 摇菌3 h,当OD值达到0.6~0.8时,加入IPTG 直至终浓度达到1.0 mmol/L,25 ℃诱导8 h,4 ℃、4 000 r/min 离心5 min收菌[16]。弃上清,菌体加入1×Ni-NTA结合缓冲液,超声裂解菌体(超声 2 s,间隔 3 s,全程时间 30 min,冰上进行),4 ℃条件下10 000 r/min 离心10 min后收集上清液,经Ni-NTA琼脂糖柱分离纯化。纯化的蛋白在4 ℃的PBS缓冲液中透析过夜后,进行10% SDS-PAGE凝胶电泳,电泳结束后凝胶经考马斯亮蓝染色并脱色,凝胶成像分析仪观察,鉴定重组蛋白的纯化情况。
1.2.4 小鼠的免疫 6~8 周龄BALB/c 雌性小鼠共15只,分为对照组、Fu-Pb22免疫实验组和Tr-Pb22免疫实验组三组,每组5只。用His标签蛋白、Fu-Pb22蛋白 (全长蛋白来自本课题组前期发表的英文文章中的蛋白)[14]和纯化的Tr-Pb22蛋白(50 μg/小鼠)分别与完全弗氏佐剂混合至200 μL,经皮下注射分别对对照组和实验组小鼠进行免疫。初次免疫后第14、35天再分别用弗氏不完全佐剂乳化50 μg 的His标签蛋白、Fu-Pb22蛋白和纯化的Tr-Pb22蛋白进行加强免疫。
1.2.5 ELISA检测抗体滴度 将96孔板在4 ℃条件下,用5 μg/mL的Fu-Pb22蛋白或Tr-Pb22蛋白包被过夜,经200 μL TBST(1.5 mol/L NaCl,1 mol/L tris-HCl,pH 8.0,0.05% Tween-20)洗涤3次后使用200 μL PBS封闭液(含1%的BSA)封闭1 h。用TBST洗涤3次后,将抗Fu-Pb22或Tr-Pb22血清分别在含1%牛血清白蛋白(BSA)的PBS中进行系列稀释(稀释倍数从1∶1 000到1∶512 000),每孔100 μL,37 ℃孵育2 h,用PBST (0.1 mol/L PBS,pH 7.4,0.02% Tween-20)清洗3次。加入200 μL稀释的羊抗鼠的IgG-HRP(1∶5 000),37 ℃孵育2 h后用PBST清洗7次。加入底物显色10 min,每孔加入100 μL H2SO4终止反应,490 nm 波长处测OD值。
1.2.6P.berghei配子体/配子/合子/动合子培养与纯化 ①配子体:经苯肼处理的BABL/c小鼠尾静脉注射感染P.berghei,感染第4天、第5天,给小鼠饮用磺胺嘧啶(Sigma,20 mg/L 饮用水)。通过小鼠眼球取血的方式收集配子体(收集的血液需置于 37 ℃预热的 RPMI 1640 中以防配子体活化)。血液经 55%的Nycodenz 密度梯度离心分离,收集中间灰白层配子体。②配子:上述分离的配子体放入配子体出丝培养基中,25 ℃培养15 min。③合子:经苯肼处理过的BABL/c小鼠尾静脉注射感染P.berghei,感染第3天,通过小鼠眼球取血收集合子。1 mL肝素抗凝血置于9 mL动合子培养液中,19~20 ℃培养2 h,培养物经 60%的 Nycodenz 密度梯度离心分离,收集中间灰白层动合子[17]。④动合子:经苯肼处理过的BABL/c小鼠尾静脉注射感染P.berghei,光学显微镜下计数感染率达20%~30%时,取10 μL/鼠的鼠尾血与40 μL动合子培养基混合进行出丝实验,显微镜下观察出丝情况。筛选出丝良好的小鼠喂饮含磺胺嘧啶饮用水,饮用48 h内,鼠尾血涂片观察小鼠体内疟原虫所处的时期,以无性阶段疟原虫全部被杀灭为标准,取小鼠眼球血收集动合子。将1 mL血液置于9 mL动合子培养液中,19~20 ℃培养24 h,培养液经62%的Nycodenz密度梯度离心分离,收集中间灰白层动合子。
1.2.7 间接免疫荧光试验( Indirect Immunofluorescence Assay) 在室温条件下将分离纯化的各阶段疟原虫分别在固定液(4%多聚甲醛+0.007 5%戊二醛)中固定30 min,2 500 r/min 离心3 min,PBS洗涤3次,弃上清,用 0.1% TritonX-100透膜10 min,再用PBS溶液洗涤3次。用封闭液(含3% BSA/PBS溶液)在室温下封闭30 min。加入抗Tr-Pb22鼠血清(1∶200),室温下孵育1 h,洗涤后加入FITC标记的抗鼠IgG(1∶1 000稀释),37 ℃孵育1 h。DAPI染色15 min后经抗淬灭封片剂封片,荧光显微镜下观察结果。
1.2.8 传播阻断能力的验证 已免疫的对照组、Fu-Pb22免疫实验组和Tr-Pb22免疫实验组小鼠在第3次增强剂注射后10 d,经腹腔注射1×107个P.berghei感染的红细胞,感染后第3天在显微镜下分别计数红细胞疟原虫感染率、配子细胞率和配子细胞性别比率。取10 μL/鼠的鼠尾血分别与40 μL出丝培养基混合,取1.5 μL充满计数板8个孔,于显微镜下计数出丝中心数量,每个孔随机计数10个视野。取10 μL/鼠的鼠尾血分别置于90 μL动合子培养液中,19 ℃培养24 h,取1 μL培养物涂片,用抗Pbs21抗体固定和标记培养物,在荧光显微镜下观察动合子形成情况。
2 结果与分析
2.1 生物信息学分析
根据生物信息学分析显示,Pb22蛋白全长218 aa,存在一个信号肽和两个低度复杂区(图1a),在疟原虫种属中较为保守(图1b),且共有7个抗原决定簇(图1c)。本研究中截短蛋白表达区域为34~149 aa,含有一个低度复杂区及5个抗原决定簇。
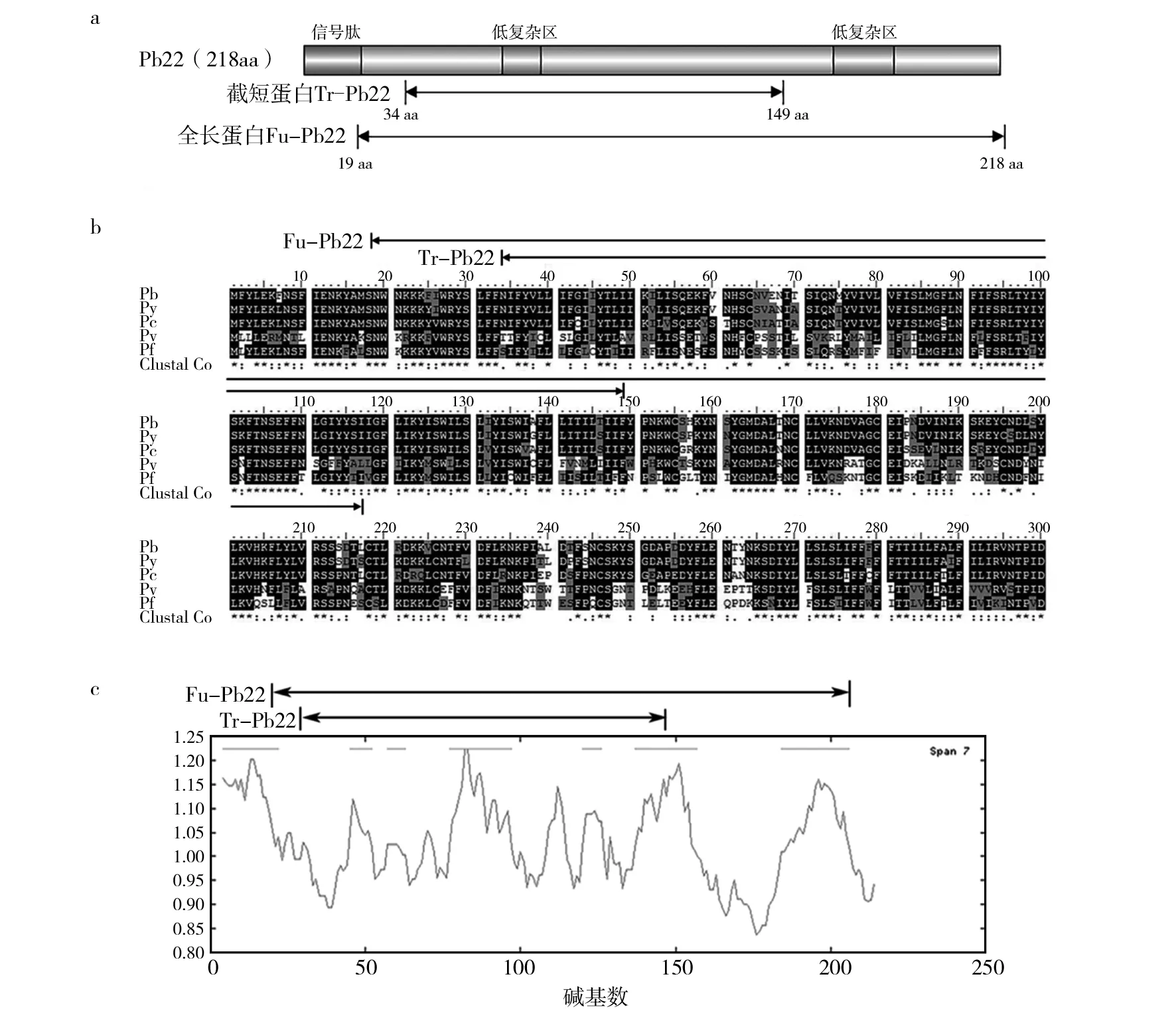
图1 Pb22生物信息学分析Fig.1 Bioinformatics analysis of Pb22a:Pb22蛋白结构域预测图;b:Fu-Pb22和Tr-Pb22与其他同源疟原虫蛋白的序列比对分析,Pb:P. berghei,Py:P. yoeli,Pc:P. chabaudi,Pv:P. vivax,Pf:P. falciparum;c:Pb22抗原决定簇分析a:The prediction of Pb22′s protein domains;b:The alignment analysis b22 between homologous proteins,Pb:P. berghei,Py:P. yoeli,Pc:P. chabaudi,Pv:P. vivax,Pf:P. falciparum;c:The antigenic determinants of Pb22
2.2 Pb22免疫血清抗体滴度检测
ELISA结果显示,Fu-Pb22蛋白免疫后得到的血清抗体效价大于1∶256 000 (P<0.01),Tr-Pb22蛋白免疫后得到的血清抗体效价大于1∶64 000 (P<0.05),证明Fu-Pb22和Tr-Pb22均具有良好的抗原性,且Fu-Pb22免疫原性优于Tr-Pb22(图2)。
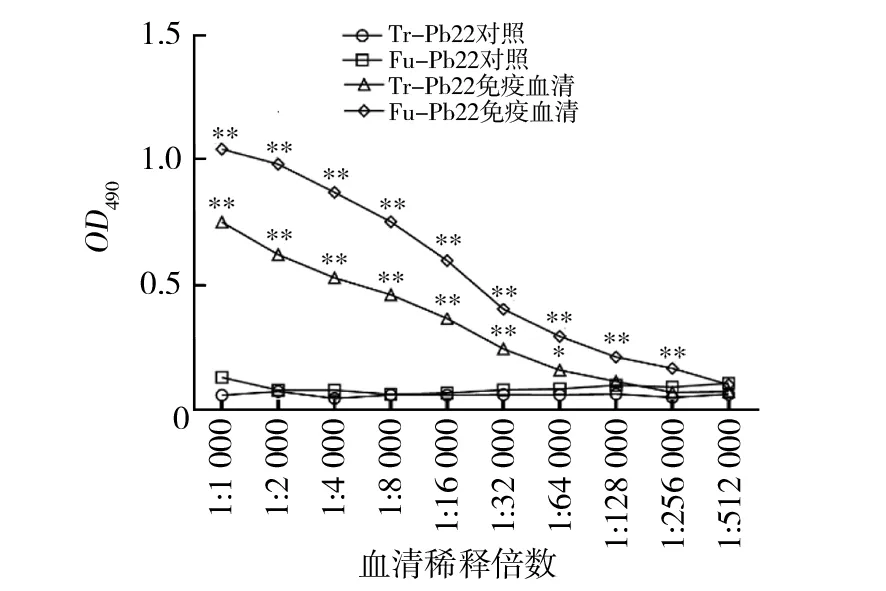
图2 Fu-Pb22和Tr-Pb22免疫血清的抗体滴度Fig.2 The antibody titers of immune serum with Fu-Pb22 and Tr-Pb22**P<0.01,*P<0.05
2.3 Tr-Pb22免疫血清与疟原虫天然抗原结合的能力
IFA结果显示,抗免疫血清可特异性识别雌雄配子体、雌雄配子与动合子的表面抗原,提示Tr-Pb22在疟原虫配子体、配子阶段的胞内和膜上都有表达,在动合子阶段有少量表达(图3),表明其具有成为TBVs候选抗原的能力。
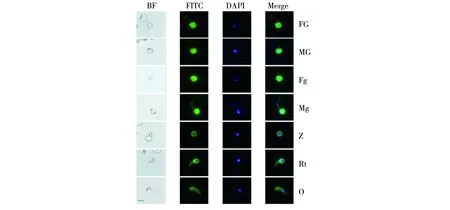
图3 IFA分析 Tr-Pb22结合天然抗原的能力Fig.3 The analysis of Tr-Pb22′s ability to bind to natural antigens by IFABF为普通光镜明视野照片;FITC 显示为绿色荧光;DAPI 为疟原虫细胞核经 DAPI 染色;Merge:第2列与第3列合成图[16]。FG:雌配子体;MG:雄配子体;Fg:雌配子;Mg:雄配子;Z:合子;Rt:未成熟动合子;O:动合子BF is the picture under the ordinary microscope with clear view;FITC shows as green fluorescence;DAPI shows the nucleus stained by DAPI.Merge:The second column is merged with the third column[16].FG:Female gametocyte;MG:Male gametocyte;Fg:Macrogamete;Mg:Microgamete;Z:Zygote;Rt:Retort;O:Ookinete
2.4 Fu-Pb22和Tr-Pb22免疫对疟原虫生长发育的影响
经Fu-Pb22和Tr-Pb22免疫的小鼠感染疟原虫后的红细胞感染率、配子体率和配子体细胞性别比率与His标签蛋白免疫的小鼠比较无显著统计学差异(图4a、b、c)。Fu-Pb22免疫组配子体出丝数为1.625个/视野,较 His 标签蛋白免疫组的4.625个/视野减少了64.8%(P<0.01),具有显著的统计学差异。Tr-Pb22免疫组配子体出丝数为3.1个/视野,较 His 标签蛋白免疫组的4.625个/视野减少了32.4%,与对照组相比仅有下降趋势,无统计学差异。Fu-Pb22免疫组较Tr-Pb22免疫组出丝中心数显著减少(P<0.05)(图4d)。与 His 标签蛋白免疫对照组相比,Tr-Pb22免疫组和Fu-Pb22免疫组动合子形成分别减少了84.8%、93.4%,差异均具有显著的统计学意义(P<0.01)[18]。Fu-Pb22免疫实验组的动合子形成数量较Tr-Pb22少,具有统计学差异(P<0.05)(图4e)。
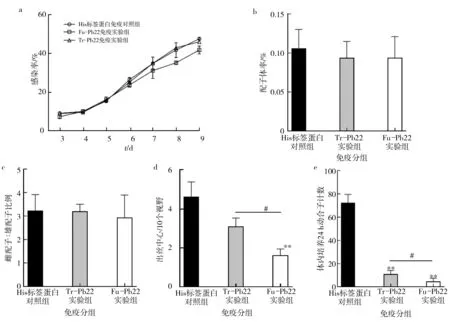
图4 His标签蛋白免疫组、Fu-Pb22免疫组和Tr-Pb22免疫组表型分析Fig.4 The phenotypic analysis of the mice of the His-tag protein group,the Fu-Pb22 group and the Tr-Pb22 groupa:感染率;b:配子体率;c:配子体性别比率;d:配子体出丝中心数;e:动合子数量(组间比较 #P<0.05;组内比较 **P<0.01) a:Parasitemia;b:Gametocytemia;c:Female∶male ratio;d:Exflagellation centers;e:Ookinete numbers in vivo culture(comparison between groups #P<0.05;Intra group comparision **P<0.01)
3 讨 论
TBVs可能在疟疾的终局阶段发挥重要作用,在防止继发感染、防止疟疾爆发以及保护其他干预措施免受逃逸突变体的影响等方面具有重大意义[19]。有足够的证据表明,当恶性疟原虫和间日疟原虫以配子体的形式被蚊子摄取时,存在于配子细胞表面的抗原抗体反应可以传播给蚊子。这种反应的传播降低了蚊子的感染风险,是TBV发展的基础[19]。
根据前期中国医科大学免疫教研室曹雅明课题组的研究结果,通过PlasmoDB筛选出了疟原虫保守蛋白Pb22(PBANKA_0305900)[20]。其对应的Pb22基因在有性阶段大量表达[21],蛋白N端有一个信号肽。与野生型相比,敲除Pb22基因的伯氏疟原虫P.berghei在体外配子体培养中,雄配子出丝率显著降低 (约89%),动合子数量显著减少(约97%)。表达重组Pb22并免疫小鼠,探讨其阻断传播的潜力。体外实验表明,Pb22抗血清对配子形成的抑制率为64.8%,对动合子的抑制率为93.4%。蚊子在喂食Pb22免疫小鼠后,蚊感染率(83.3%~93.3%) 和卵囊密度 (93.5%~99.6%) 也显著下降,证实其可以成为传播阻断疫苗候选抗原[14]。
本研究针对Pb22选择的截短蛋白Tr-Pb22减低了蛋白正确折叠的难度,目的是使蛋白的功能得到最大限度的发挥。但是本研究中,截短蛋白的抗原性和传播阻断能力均不如全长蛋白,这可能是由于抗原蛋白的分子量与抗体滴度相关,Pb22截短蛋白较全长蛋白缺少两个抗原表位,且Pb22蛋白截短后分子量较小,导致抗体滴度较全长蛋白低,进而导致Tr-Pb22的免疫血清传播阻断能力低于Fu-Pb22组。
多阶段多抗原的联合疫苗将成为TBVs的研发趋势,多抗原联合可能会降低疫苗接种者不良反应的风险、减少突变的可能并产生协同效应[22]。目前,可能成型的双抗原传播阻断疫苗的候选抗原是Pfs48/45和Pfs230的嵌合蛋白,初步数据表明联合抗原存在着潜在的协同作用[23]。在后续研究中,也将考虑将Pb22全长蛋白与其他无性阶段抗原串联,尝试探究联合抗原的协同作用。
