米糠液态发酵紫色红曲霉产色素的营养因子优化
2022-10-10夏欣欣郭明伟刘曼丽孙晶晶吴兴泉
夏欣欣,陈 迪,姜 凌,郭明伟,刘曼丽,孙晶晶,吴兴泉
河南工业大学 生物工程学院,河南 郑州 450001
红曲霉(Monascusspp.)是一种药食两用的丝状真菌[1],在中国、日本和东南亚国家用于食品发酵和药物生产已有近2 000年的历史[2]。红曲霉可以产生多种有益次级代谢产物,通常具有聚酮结构和生物活性,包括红曲色素(MPs)[3]、莫纳可林K(MK)[4]和γ-氨基丁酸等[5]。红曲色素作为着色剂在食品领域应用广泛,如腐乳[6]、肉制品[7]、红曲黄酒[8]、红曲面包[9]等。由于化学合成着色剂对健康的不利影响,微生物来源的天然食品着色剂相较来说则更为安全,通过感官和生物安全性评价发现红曲色素具有食品着色剂的生物安全性和适用性[10]。红曲色素是一种混合色素,其中主要的6种色素是红色素(红斑胺(rubropunctamine)[11]、红曲红胺(monascorubramine)[12])、橙色素(红斑素(rubropunctatin)[13]、红曲红素(monascorubrin)[12])和黄色素(红曲素(monascin)[14]、红曲黄素(ankaflavin)[13])。红曲色素的各个组分可以用于不同食品的着色。此外,红曲色素还具有抗炎[15]、抗癌[16]、抑制肥胖[17]、降血糖[18]等功效。近年来红曲色素已成为微生物源天然色素中发展速度最快的食品添加剂之一。
目前,发酵红曲霉产红曲色素的原料主要是大米,而大米作为世界第二大主粮,供给全球1/2人口,完全依赖大米为培养基质发酵产红曲色素,无疑增加了红曲色素的生产成本[19]。在大米加工过程中会产生大量的副产物米糠,其含量可占糙米的5%~8%,全球年产量约2 930万t[19]。米糠是米粒的外层,主要由果皮、糊粉层、亚糊粉层和胚芽组成,其营养物质丰富,膳食纤维量大,抗氧化能力强,对多种代谢性疾病有一定的治疗作用,但常被用作动物饲料,或被当作废物扔掉[19]。若能将米糠作为红曲色素的生产原料,可降低生产成本,提高农业副产物米糠的利用价值。
近年来利用农业副产物生产红曲色素的研究报道越来越多,De Almeida等[20]以玉米麸皮为原料,采用深度发酵工艺优化红曲色素的生产工艺。Silva等[21]以农业和工业废渣(米粉和甘蔗糖蜜)为基质生产红曲霉色素。Liu等[22]用水稻秸秆添加葡萄糖为培养基提高了红曲色素的色价。然而,以米糠为基质添加外源营养因子以提高红曲色素产量的研究报道并不多见。吴双双等[23]以米糠为基质发酵产MPs和MK,发现米糠更适合红曲霉产MK,且并未发现有效提高MPs产量的刺激物。
本试验以米糠为基质,以色价为主要评价指标,筛选了不同碳源、氮源和无机盐作为营养因子,研究其对紫色红曲霉M9产色素的影响,并采用响应曲面分析得到了提高红曲色素产量的最佳营养组成,同时采用TLC和HPLC分析了优化前后红曲色素的组分变化,为综合利用粮食副产物和提高红曲色素产量提供了技术参考。
1 材料与方法
1.1 试验材料
从河南省原阳市宴宾米业购买糙米,经碾米机打磨(1 060 r/min)得到米糠;试验使用菌株为实验室保藏菌种MonascuspurpureusM9(NO.CGMCC 3.19586)。
1.2 仪器与设备
TM05C碾米机:佐竹(苏州)机械有限公司;Spark酶标仪:深圳市恩科生物科技有限公司;DK-S24水浴锅:上海精宏实验设备有限公司;BBS-DDC超净工作台:济南鑫贝西生物技术有限公司;QYC-200摇床:上海新苗医疗器械制造有限公司;AGILENT 1260高效液相色谱仪:安捷伦(中国)科技有限公司;DHP-500恒温培养箱:北京市永光明医疗仪器有限公司。
1.3 试验方法
1.3.1 培养基配方
斜面培养基:麦芽汁糖化液(10度)加入3%琼脂,于121 ℃灭菌20 min。灭菌完成后倾斜摆放,待凝固后备用。
种子培养基:葡萄糖6.0 g,蛋白胨2.0 g,NaNO31.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,用水定容至100 mL,121 ℃灭菌20 min。
米糠液态基本培养基:米糠2.5 g,用水定容至50 mL,121 ℃灭菌20 min。
大米液态基本培养基:大米2.5 g,用水定容至50 mL,121 ℃灭菌20 min。
碳源液态培养基:米糠2.5 g,外加一定质量不同种类碳源,用水定容至50 mL,121 ℃灭菌20 min。
氮源液态培养基:米糠2.5 g,外加一定质量不同种类氮源,用水定容至50 mL,121 ℃灭菌20 min。
无机盐液态培养基:米糠2.5 g,外加一定质量不同种类无机盐,用水定容至50 mL,121 ℃灭菌20 min。
1.3.2 液态发酵红曲霉M9
刮取斜面菌丝接种于种子培养基,180 r/min培养(36~48 h)得到种子培养液,经8层纱布过滤得到孢子悬液,无菌水调节孢子浓度达106个/mL,取孢子悬液接种于50 mL液体培养基中,接种量6.00%,在28 ℃,180 r/min条件下发酵5 d。
1.3.3 色素提取液的制备
参照薛原[24]使用的方法进行色素液的提取。
1.3.4 色价的测定
参照薛原[24]使用的方法进行胞内色价的测定,于505 nm处测定吸光度,并代入下列公式计算:
式中:S为样品的色价,U/g;A为稀释液的吸光度;n为稀释倍数;G为菌丝质量,g。
1.3.5 单因素试验
碳源选择添加葡萄糖、蔗糖、麦芽糖、半乳糖、木糖、甘露醇、木糖醇、果糖,氮源选择添加蛋白胨、尿素、谷氨酸钠、(NH4)2SO4、NaNO3、NH4NO3,无机盐选择添加KH2PO4、MgSO4、ZnSO4、FeSO4、MnSO4。通过单因素试验考察外加碳源、氮源、无机盐对米糠发酵产色素的影响。
1.3.6 最陡爬坡试验
通过单因素试验,确定对米糠产色素影响较大的碳源、氮源、无机盐,选取合适的水平及梯度进行最陡爬坡试验。
1.3.7 响应面分析
根据最陡爬坡试验结果,确定中心点,利用Design export 12进行中心组合设计,并进行响应面试验。再根据响应面分析结果进行验证试验。
1.3.8 TLC法初步分离红曲色素
参照屈炯[25]使用的方法进行薄层色谱分离发酵所产红曲色素,分离得到红、黄、橙等色素条带。
1.3.9 高效液相色谱法测定红曲色素组分
参照Chen等[26]使用的梯度洗脱方法进行红曲色素组分的测定。
1.3.10 橘霉素的测定
参照薛原[24]使用的高效液相方法进行橘霉素的测定。
1.4 数据处理
所有试验重复3次,取平均值,利用Origin 9.0、SAS 9.0和Design export 12对数据进行处理和响应面分析。
2 结果与分析
2.1 碳源对紫色红曲霉M9产红曲色素色价的影响
由图1可知:随着葡萄糖及半乳糖添加量的增加,色价都呈现下降趋势,当葡萄糖添加量为4.00%时,色价最高可达703.90 U/g;半乳糖添加量为3.00%时,色价最大,为67.90 U/g;添加蔗糖和麦芽糖时,色价呈现波浪状的变化趋势,添加蔗糖的最高色价仅达83.32 U/g,而添加麦芽糖的最高色价可达555.80 U/g。上述4种碳源中,添加半乳糖和蔗糖的最高色价甚至低于纯米糠发酵的色价(106.15 U/g),表明半乳糖和蔗糖对米糠发酵产红曲色素没有提升作用。添加木糖、木糖醇、甘露醇及果糖后,色价呈先上升后下降的变化趋势,其中添加甘露醇的色价最高,可达1 138.90 U/g(5.00%);添加果糖的色价次之,可达981.30 U/g;添加木糖的色价(707.50 U/g)和木糖醇的色价(719.00 U/g)不仅趋势相似,最高色价也接近。由此可见,以米糠为基质添加碳源能显著提高红曲色素的色价,其中甘露醇效果最显著,色价是纯米糠发酵的(106.15 U/g)10.73倍,其次是果糖。
2.2 氮源对紫色红曲霉M9产红曲色素色价的影响
如图2所示,随着氮源添加量的增加,其中添加尿素、谷氨酸钠、蛋白胨的色价均呈现一直下降的趋势。尿素的最高色价可达105.60 U/g,谷氨酸钠的最高色价仅有95.76 U/g,蛋白胨的最高色价也只有132.64 U/g,尿素、谷氨酸钠及蛋白胨的添加并没有显著提升米糠的色价。随着硫酸铵添加量的增加,红曲色素的色价先上升后下降再有所回升,于1.50%处达最高色价(172.64 U/g)。NaNO3和NH4NO3随着添加量的增加,色价均先上升后下降,NaNO3和NH4NO3的最高色价分别可达154.92 U/g、252.64 U/g,添加NH4NO3的色价是纯米糠色价(106.15 U/g)的2.38倍。综上所述,所选氮源中NH4NO3对米糠发酵产色素的能力提升最为显著,后续试验选择NH4NO3进一步优化。
2.3 无机盐对紫色红曲霉M9产红曲色素色价的影响
由图3可知:随着FeSO4添加量的增加,色价先下降再升高,最高色价可达229.44 U/g;MnSO4添加后色价呈起伏式变化,当添加量为0.20%时,色价达最高值(234.44 U/g);添加KH2PO4后色价整体呈上升趋势,于0.30%处达最高色价(260.84 U/g);添加MgSO4和ZnSO4后色价呈现先升高后下降的趋势,MgSO4的添加量为0.20%时,色价最高,为196.80 U/g,当ZnSO4添加量为0.40%时,发酵所得色素的色价(396.00 U/g)是纯米糠的(106.15 U/g)3.73倍。添加ZnSO4能显著提高米糠发酵产色素的能力,故选择ZnSO4作为下一步优化的因素之一。
2.4 最陡爬坡试验结果
根据单因素试验结果,碳源选取甘露醇、氮源选取NH4NO3、无机盐选取ZnSO4,并选择合适的坡度进行最陡爬坡试验,试验结果如表1所示。由表1可知,第2组(甘露醇添加量为5.00%、ZnSO4添加量为0.40%、NH4NO3添加量为1.00%)的色价最高(1 209.60 U/g),以这个添加量为中心点进行下一步响应面优化。

表1 最陡爬坡试验
2.5 响应面设计
根据单因素及最陡爬坡试验结果,选取合适的因素(甘露醇添加量、ZnSO4添加量、NH4NO3添加量)及水平进行三因素三水平的响应面试验。响应面水平设计见表2,试验设计及结果见表3。利用Design-Expert 12 软件进行响应面设计及回归分析,以505 nm处的色价为响应值,建立有关色价的回归方程如下:

表2 响应面设计水平与编码
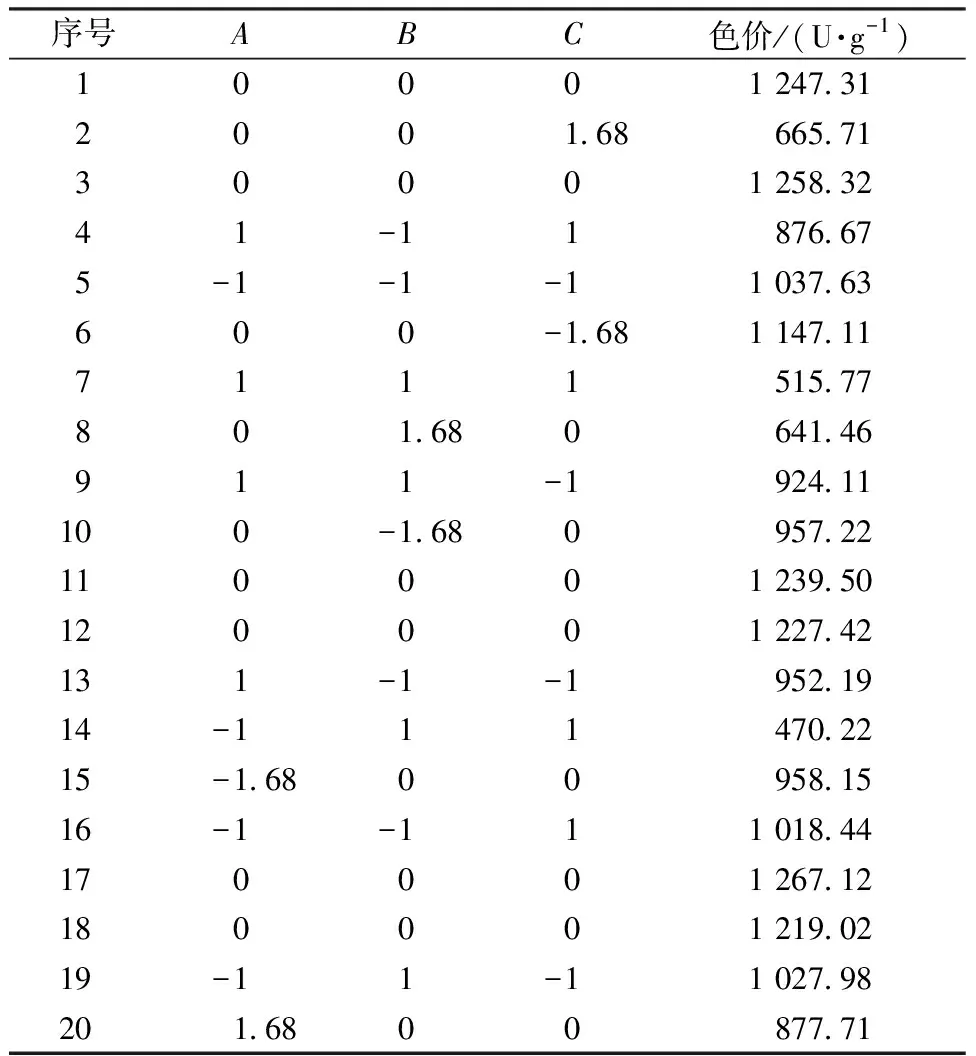
表3 响应面设计及结果
色价=1 243.09-30.81A-108.22B-136.96C+21.11AB+11.64AC-108.92BC-114.83A2-156.76B2-118.90C2。

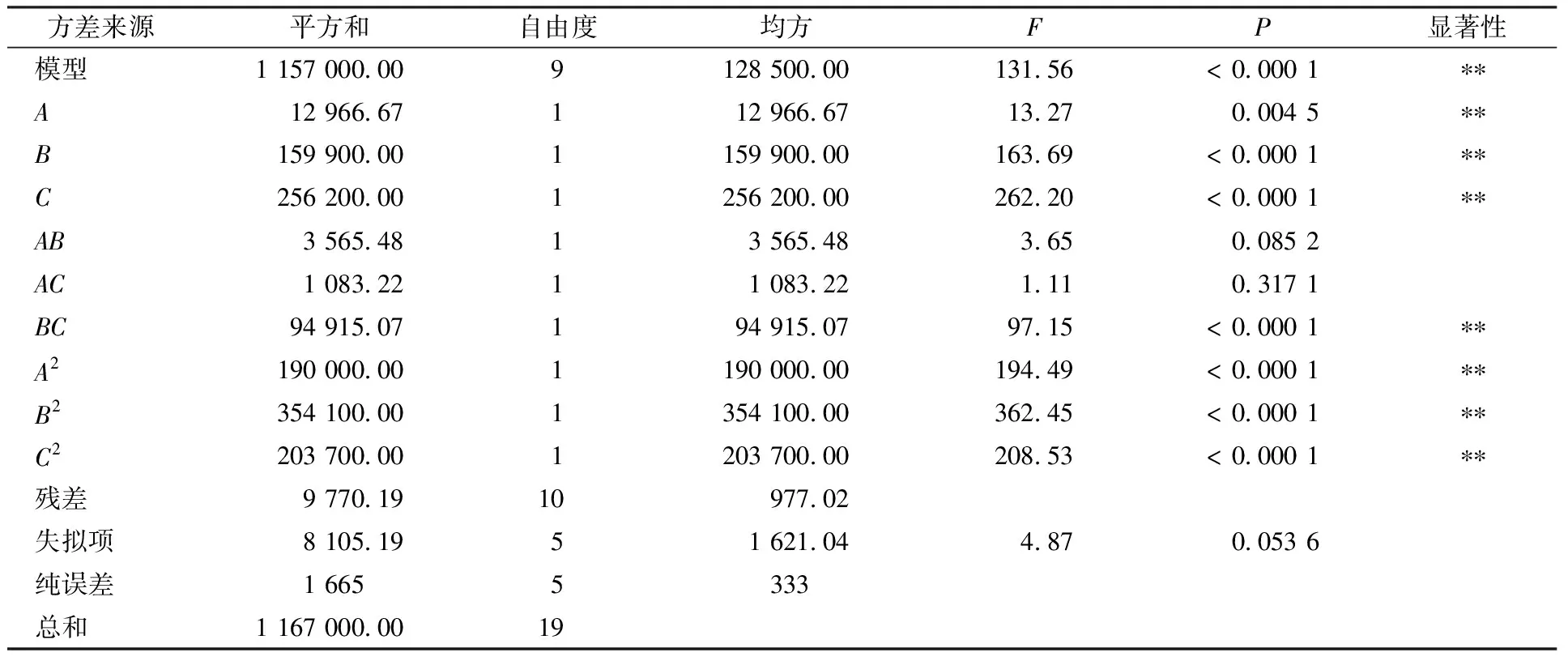
表4 响应面方差分析结果
2.6 优化前后培养基与大米培养基对比分析
为了进一步考察营养因子优化后所产红曲色素的特性,采用薄层色谱法分析了优化前后色素的组成和种类,结果如图4所示。由图4可知,纯米糠发酵色素经薄层展开未得到清晰条带,优化后发酵的色素有两条清晰的红色素条带(Rf=0.20、Rf=0.25),两条明显的橙色素条带(Rf=0.69、Rf=0.76),黄色素条带(Rf=0.88、Rf=0.93)颜色较浅。对比纯米糠培养基、优化后培养基及普通大米培养基(505 nm)的色价,如图4所示,纯米糠发酵的色价最低,仅为106.15 U/g(505 nm);普通大米发酵后的色价最高,可达1 751.74 U/g;优化后所得色价比优化前显著提升,可达1 250.83 U/g,且优化后所得色价为普通大米培养基的71.41%。
HPLC色谱结果(图5)表明,纯米糠发酵色素响应值很低,几乎未见色素产生。普通大米发酵后黄色素和橙色素占比较高,红色素含量较低。优化后的米糠培养基发酵后出现6种色素峰,分别是2种橙色素:红斑素(rubropunctatin)、红曲红素(monascorubrin),2种红色素:红斑胺(rubropunctamine)、红曲红胺(monascorubramine),2种黄色素:红曲素(monascin)、红曲黄素(ankaflavin),其中2种红色素相对峰面积最大,其次是橙色素,黄色素较低,HPLC分析结果与TLC结果一致。对3种培养基发酵后样品橘霉素毒素含量进行了高效液相分析,结果如图6所示。由图6可知,普通大米发酵所得橘霉素最高,可达143.02 μg/g,是优化后培养基发酵的(37.37 μg/g)3.82倍,是纯米糠发酵的(2.42 μg/g)59.10倍。纯米糠发酵所产橘霉素最少,优化后培养基所产橘霉素是纯米糠的15.44倍。综上所述,优化后发酵所产红曲色素的色价及橘霉素含量均有显著提升,但都低于大米发酵二者的水平。
3 结论
本试验以米糠为基质液态发酵生产红曲色素,选取多种碳源、氮源和无机盐,考察不同营养因子对红曲色素产量的影响,发现甘露醇、ZnSO4和NH4NO3显著提高了红曲色素的色价。在单因素试验基础上,进行最陡爬坡试验,确定中心点(甘露醇添加量5.00%、ZnSO4添加量0.40%、NH4NO3添加量1.00%)。经过响应曲面优化,确定以甘露醇5.10%、ZnSO40.40%、NH4NO31.00%加入米糠培养基,得到色价(505 nm处)最高为1 250.83 U/g,与预测值十分接近,模型拟合度较高。优化后培养基发酵所得红曲色素的色价可达大米培养基的71.41%,橘霉素含量则为大米的26.13%(37.37 μg/g),并通过TLC和HPLC分析色素特性,发现优化后得到了6种主要红曲色素,其中2种红色素含量最高,其次是2种橙色素和少量黄色素。
