乳腺非典型性腺肌上皮瘤1例
2022-10-09袁军李娜凌利
袁军,李娜,凌利
嘉兴市妇幼保健院,浙江 嘉兴 314000;1.病理科;2.超声科
乳腺腺肌上皮瘤(adenomyoepithelioma, AME)是一种较为罕见的乳腺肿瘤,具有双向分化的特点。根据其临床病理特征及生物学行为可以分为良性、非典型性及恶性(原位和浸润性),其中良性及恶性AME国内外文献均有报道,而对于非典型性AME的认识较晚,目前国内鲜见报道,国外仅见个别报道。笔者报道1例罕见的非典型性AME,收集患者的临床、病理资料,并复习文献,希望为临床提供参考价值。
1 病例资料
患者,女,54岁,2020年4月因“无意中触及左乳肿块1周”就诊,自诉肿块约核桃大小,肿块处轻压痛,无乳头溢液,无局部皮肤红肿,无畏寒发热,无消瘦乏力,无头痛头晕,当地医院考虑良性肿块,未作任何治疗。遂患者来嘉兴市妇幼保健院就诊,自觉无明显不适症状,体格检查:左乳外下方可触及一肿块,大小约4.0 cm×3.0 cm,质硬,边界欠清,无压痛,活动不佳,遂门诊拟“左乳肿块”收住入院。入院前我院浅表彩超(乳腺加弹性)检查:左乳近3点距乳头5 cm处见30 mm×20 mm×25 mm囊实性回声,边界欠清,形态不规则,弹性成像4级(见图1)。双侧腋下未见明显异常肿大淋巴结。双侧腋下软组织内未见明显异常回声。彩色多普勒血流显像(color Doppler flow imaging, CDFI):未见异常血流信号,检查结果:双乳乳腺病,左乳囊实性肿块,弹性成像4级,USBI-RADS 4B类。入院后行磁共振成像(magnetic resonance imaging, MRI)检 查:双乳构成呈ACR C类。腺体组织不均匀增厚,右乳下方见不对称致密影,左乳外侧见肿块两枚,大者大小约26 mm×22 mm,边界清,两者相重叠。右乳见钙化灶一枚。遂于全麻下手术,术中于左乳外侧作一长约5.0 cm放射状切口,切开皮肤、皮下组织探查见左乳外侧腺体内肿块约5.0 cm×3.0 cm× 3.0 cm,质硬,活动差,切除肿块,送快速。术中冰冻诊断:左侧乳AME,细胞有异型,可见核分裂像,确切报告待常规石蜡切片及免疫组化。
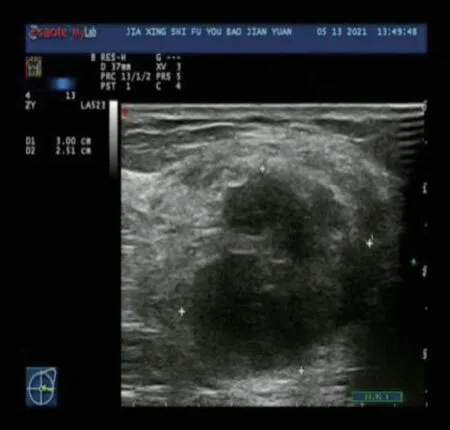
图1 患者乳腺超声图像
病理巨检:左乳肿块标本:一块淡红黄色软组织,大小约4.8 cm×4.6 cm×2.7 cm,切面囊实相间,囊最大径约1.3 cm,内含暗红色血样液体。镜下所见:肿瘤组织有典型的腺肌上皮特征,腺上皮和肌上皮两种类型的细胞构成肿瘤的主体,以形成乳头状结构为主(见图2a),乳头与周围间质有裂隙,肿瘤中央区可见坏死,肿瘤周边逐渐转变为实性片块状,局部间质浸润性生长(见图2b)。在乳头较为明显的区域,肿瘤细胞顺着乳头的轴心排列成两排,靠内侧的细胞胞浆淡染到透亮不等,为肌上皮细胞;靠近外侧的细胞胞浆嗜酸性,为腺上皮细胞,两者还形成腺管样排列结构(见图2c)。从乳头区到实性区过渡的过程中,肌上皮增生越发明显(见图2d),并出现细胞核大小不一的异常形态变化(见图2e),核仁明显,核内染色质颗粒状,分布不均,在一个高倍镜视野内出现了>2个核分裂像(见图2f)。免疫组化结果:P63在肌上皮细胞弥漫核表达(见图3a)、E-cadherin表达具备特征性,表现为腺上皮细胞膜强着色,肌上皮细胞浆弱着色(见图3b),ki-67阳性指数达20%以上,CK(AE1/AE3)、SMA、CK8/18、CK5/6、ER、PR、AR均阳性表达,CD117阴性。经浙江省肿瘤医院会诊: (左侧)乳腺非典型AME。随访2年,未见复发及转移。

图2 HE染色图像
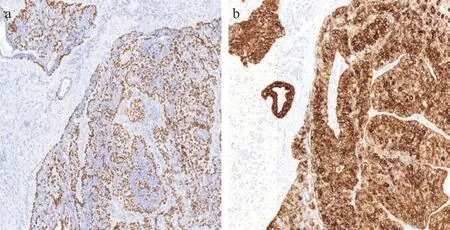
图3 免疫组化染色结果
2 讨论
AME是一种双相分化肿瘤,包含腺上皮细胞和肌上皮细胞两种成分。该病非常少见,发病年龄从16至86岁不等,中位年龄56岁,容易被误诊、漏诊的主要因素是临床医师和病理医师对该病认识不 足[1]。
良性AME首次描述于1970年,其体积较小,无特殊的临床特征。肿瘤含有腺上皮和/或肌上皮两种细胞成分的增生,细胞无异型性,核分裂罕见(<3/10 HPF),有或无坏死。根据其组织学形态,可以将其分为:乳头状、分叶状、腺管状以及梭形细胞四型[2]。恶性AME表现为肿瘤边界不清,肿瘤细胞具有明显的非典型性,核分裂像常大于10/10 HPF,甚至会出现非典型核分裂像,其主要来自于腺上皮及肌上皮的恶变,以腺上皮恶变为主。根据组织特征将恶性AME分为原位恶性AME、浸润性恶性AME和伴有浸润性癌的AME,其中腺上皮成分显示导管原位癌特征,有典型的AME结构的被称为原位恶性的AME;AME与浸润性乳腺癌共存被称为伴有浸润性癌的AME;含有肌上皮癌或者肌上皮癌合并浸润性腺上皮癌的AME被称为浸润性恶性AME(也称其为浸润性腺上皮癌或浸润性乳腺癌,肌上皮模式[3]。这三种类型基本上包括了恶性AME绝大部分的分类。需要注意的是肿瘤的大小、患者的发病年龄对于良恶性AME的鉴别都不是重要的因素,细胞的异型性、核分裂像以及肿瘤的生长方式是鉴别良恶性的有效指标[4],但是如果肿瘤大小出现短期内快速增大,则支持恶性可能[5]。
乳腺具有非典型性的AME曾在2004年被提 出[6],但在之后的10多年时间内,相关的文献报道非常少[7],与良性及恶性AME相比,非典型性的AME可能是两者之间的一种过渡。虽然在第5版的WHO乳腺肿瘤分类中,还未曾提出非典型性AME的分类建议。但在2021年,RAKHA等[8]首次提出将非典型性的AME归入乳腺AME的分类的建议,并将其定义为一种恶性潜能不确定的、可局部复发、具备典型的AME组织学特征但又不足以诊断恶性AME的一类病变。其组织学表现为以下部分但不是全部恶性特征时可诊断为非典型AME:①过度生长的上皮或者肌上皮成分。②轻到中度的细胞学非典型性。③大于3/10 HPF的核分裂像。④有或者无轻微的浸润性生长方式。⑤有或者无局灶性的坏死。其中,①②③项是诊断非典型性AME必备的条件,④⑤不是诊断必须的。本组病例组织学特征表现为核分裂像<10/10 HPF,伴有浸润性的生长模式,细胞只具有轻度的非典型性,病变以肌上皮成分为主,因此归入为非典型性的AME较为合适。同时免疫组化结果也显示了两种细胞成分,E-cadherin染色呈双相着色,在腺上皮中膜表达较强,在肌上皮细胞中细胞质表达较弱,肌上皮成分Ki-67指数>10%也支持诊断为具有非典型性的AME。
由于AME具有双相肿瘤细胞分化,其鉴别诊断主要是同样具有双相分化的其他乳腺肿瘤。首先需要和良性及恶性的AME鉴别,非典型性AME的诊断标准目前WHO乳腺肿瘤分类并未明确,故采用RAKHA 等[8]提出的五项组织学特征来划分,无论是良性、非典型性及恶性AME,其都必须具备AME典型的组织学背景,即腺上皮及肌上皮双相细胞学分化,其中对于恶性AME的免疫标记,文献报道不一[9-10]。其次需要鉴别的就是腺样囊性癌,由于腺样囊性癌也包含了腺上皮及肌上皮成分,但其多形成典型的筛孔样结构、胶原化的间质及具有明显的侵犯神经现象,很少形成乳头状排列,此外,腺样囊性癌的ER、PR常阴性,并表达CD117,这与AME刚好相反,小宗的病例报道两者同时出现[11-12]。在分子生物学方面,腺样囊腺癌具有特征性的MYB融合基因突变,而AME中常见的基因改变包括:PIK3CA(不区分良恶性)、HRAS(多见于恶性)及AKT1(仅见于良性)[13-14]。最后需要鉴别的就是多形性腺瘤,因其同样含有腺上皮及肌上皮成分,多形性腺瘤特征性黏液软骨样间质及鳞状上皮成分在AME中很少出现。当多形性腺瘤中的腺上皮和/或肌上皮发生恶性转化时,两者的鉴别相对比较困难,但AME典型的组织学背景是诊断恶性AME必须的。
治疗及预后:良性的AME常常预后较好,只需要将整个肿块切除即可;恶性的AME可以局部复发及远处转移,可转移至肺、甲状腺、骨、脑、心脏甚至肾脏等,预后较差,因此常选择全乳切除或者局部扩大切除,术后再根据肿瘤恶性成分选择相应的后续治疗。非典型性AME可以局部复发,但未见有远处及淋巴结转移的报道,目前多采取肿块完整切除并保证手术切缘阴性即可,主要目的为减少其局部复发的风险,术后无需放化疗等,病例仅行肿块扩大切除后,通过超声、影像及临床随访2年,未见复发及转移。
综上所述,乳腺AME是一种具有双向分化特点且罕见的乳腺肿瘤,由于发病率低且形态学多样性,长期以来乳腺AME缺乏一致的分类标准,国内外文献报道也较少,这为该病的预后评估和临床治疗带来挑战。笔者结合文献深入探讨了AME的病理特征,希望为临床及病理医师对该病的认识提供参考价值。
