人参皂苷Rh2通过调控GSK-3β/Wnt双信号通路影响骨肉瘤细胞增殖和凋亡
2022-10-09潘天龙潘骏
潘天龙,潘骏
温州医科大学附属第二医院育英儿童医院 骨科,浙江 温州 325027
骨肉瘤是最常见的原发性骨肿瘤之一,由于其恶性程度高,侵袭性强,易发生转移,病情进展十分迅速,导致患者的长期生存率不高[1]。因为骨肉瘤细胞对放疗不敏感,所以化疗是骨肉瘤的主要临床治疗方法。寻找一种更加有效且不良反应较小的新型化疗药物则成为了骨肉瘤治疗的主要方向。相关研究表明Wnt/β-catenin信号通路对肿瘤的发生和发展具有一定的调控作用[2-3]。人参皂苷Rh2是人参皂苷中主要活性物质的水解成分之一,具有多种药理活性,其对肺癌、乳腺癌及黑色素瘤等肿瘤细胞均具有较强的抗肿瘤作用[4-5]。然而,对于Rh2在骨肉瘤细胞中具体的抗肿瘤作用的相关研究报导相对较少。因此,本研究旨在探讨Rh2是否可以通过调节GSK-3β/Wnt双信号通路抑制骨肉瘤细胞的增殖、侵袭、迁移并诱导其凋亡,为骨肉瘤的临床治疗提供新的思路。
1 材料和方法
1.1 试剂 人参皂苷Rh2购于北京Solarbio科技有限公司;MMP2、MMP9、E-cadherin、Bcl-2、Bax、PARP均购自美国Cell Signaling Technology公司;Cyclin D1、GSK-3β、β-catenin、C-myc均购自美国Abcam Technology公司;胎牛血清、DMEM基本培养基等均购于美国Gibco公司。
1.2 细胞培养 人骨肉瘤细胞株U2OS和MG63购自上海基因化学有限公司。U2OS和MG63骨肉瘤细胞均在含有10%的胎牛血清,1%青、链霉素双抗的DMEM培养基中培养,培养箱中的条件为37 ℃,5% CO2。
1.3 细胞活性检测 用不同浓度的Rh2(0、35、70和100 μmoL/L)处理U2OS和MG63骨肉瘤细胞24和48 h,随后按照说明书使用MTT检测试剂盒检测骨肉瘤细胞活性的变化。
1.4 蛋白质印迹(Western blot)法检测相关蛋白的表达 用不同浓度的Rh2(0、35和70 μmoL/L)处理U2OS和MG63骨肉瘤细胞24 h后提取总蛋白,使用BCA试剂盒检测蛋白浓度。随后进行SDS-PAGE凝胶电泳、PVDF膜转膜,5% BSA封闭液封闭2 h,随后加入一抗(MMP2、MMP9、E-cadherin、Bcl-2、Bax、PARP、Cyclin D1、GSK-3β、β-catenin、C-myc;抗体比例1: 1 000)并在4 ℃摇床冰箱孵育过夜。次日使用相应的二抗(抗体比例1:3 000)室温孵育2 h,随后加入ECL显影液并在化学发光显像仪上曝光,收集图像并定量分析。
1.5 骨肉瘤细胞的迁移和侵袭实验 在细胞迁移实验中将U2OS和MG63骨肉瘤细胞(5×104)接种在无血清培养基中的Transwell平板的上孔中,下孔添加600 μL培养基(含10% FBS)。U2OS和MG63骨肉瘤细胞在37 ℃含5% CO2的增湿培养箱中培养过夜。用含有Rh2(分别为0、35和70 μmoL/L)的新鲜培养基替换上孔中的培养基,并再培养24 h。随后使用结晶紫溶液对迁移的细胞进行染色处理并收集图像分析。在细胞侵袭实验中用预冷的培养基将Matrigel试剂按1:10进行稀释。随后将50 μL Matrigel稀释液加入Transwell平板的上孔中,在细胞培养箱中培养30 min,聚合成凝胶。随后在培养孔中添加无血清培养基(每个培养孔50 μL)并在37 ℃的CO2培养箱中再培养30 min。将剩余液体从培养孔中吸出,之后的程序与上述细胞迁移实验相同。
1.6 骨肉瘤细胞的凋亡实验 将U2OS和MG63细胞(3×105)接种在6孔细胞培养板中,并在37 ℃、5% CO2培养箱中培养过夜。次日,用Rh2(0、35和 70 μmoL/L)处理骨肉瘤细胞24 h。然后,按照CA1020-100T试剂说明(北京Solarbio科技有限公司),使用Annexin V-FITC凋亡检测试剂盒收集细胞并通过流式细胞仪检测骨肉瘤细胞的凋亡情况。
1.7 统计学处理方法 采用SPSS20.0统计软件进行数据分析。计量资料以±s表示,每组实验重复3次,多组间比较用单因素方差分析,两两比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 Rh2对骨肉瘤细胞活性的影响 用不同浓度的Rh2(0、35、70和100 μmoL/L)处理U2OS和MG63骨肉瘤细胞24和48 h后,细胞的活性显著下降,并呈浓度依赖性,差异有统计学意义(P<0.05),见图1。

图1 Rh2对骨肉瘤细胞活性的影响
2.2 Rh2对骨肉瘤细胞迁移和侵袭的影响 经Rh2预处理后,骨肉瘤细胞的迁移与侵袭能力呈浓度依赖性降低,差异有统计学意义(P<0.05),见图2AD。而在蛋白表达的水平上,Rh2可以显著地降低MMP2和MMP9蛋白的表达,并同时增强E-cadherin蛋白的表达,差异有统计学意义(P<0.05),见图2E、图2F。Rh2通过调节MMP2、MMP9和E-cadherin蛋白的表达来抑制骨肉瘤细胞的迁移和侵袭。

图2 Rh2对骨肉瘤细胞迁移和侵袭的影响
2.3 Rh2对骨肉瘤细胞凋亡的影响 Rh2可以呈剂量依赖性地促进骨肉瘤细胞的凋亡,差异有统计学意义(P<0.05),见图3A。Rh2增加了骨肉瘤细胞中Bax的表达,抑制了Bcl-2和PARP的表达,差异有统计学意义(P<0.05),见图3B、图3C。提示Rh2通过调节凋亡相关蛋白的表达促进骨肉瘤细胞的凋亡反应。

图3 Rh2对骨肉瘤细胞凋亡的影响
2.4 Rh2对骨肉瘤细胞中GSK-3β/Wnt双信号通路的影响 Rh2可下调骨肉瘤细胞中β-catenin、Cyclin D1和C-myc蛋白的表达,同时上调GSK-3β蛋白的表达,差异有统计学意义(P<0.05),见图4。Rh2可能是通过调节骨肉瘤细胞中GSK-3β/Wnt双信号通路相关蛋白的表达起到抗肿瘤的作用。
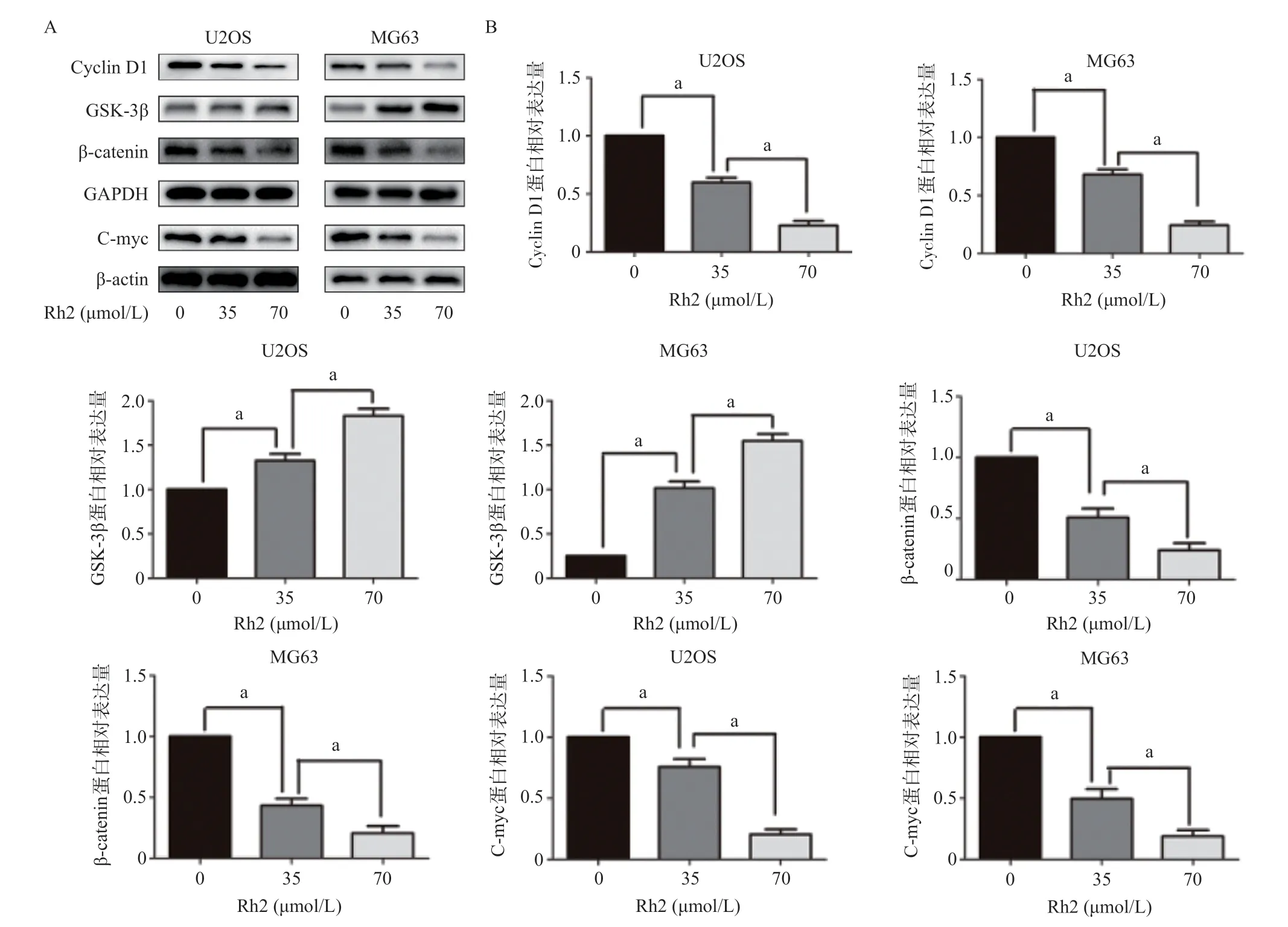
图4 Rh2对骨肉瘤细胞中GSK-3β/Wnt双信号通路的影响
3 讨论
骨肉瘤是儿童和青少年最常见的恶性骨肿瘤之一,因为其具有高度的侵袭与易复发的特性,患者的预后通常都不理想。目前临床上对于骨肉瘤患者的主要治疗方法为手术联合化疗,但多数化疗药物在治疗的同时也具有一定的不良反应,导致患者的治疗效果不佳[6]。因此,研发一种对骨肉瘤治疗敏感且不良反应较弱的新型高效化疗药物成为了迫切的需求。
多项研究表明Rh2具有抗侵袭、抗转移、抗增殖等多种抗肿瘤作用[7]。此外,Rh2还可以减轻患者化疗后的各种不良反应,如脱发、贫血和呕吐等症状[8]。SONG等[9]研究表明Rh2在抑制人肝癌细胞系增殖方面具有良好的作用,且其抑制作用呈现时间-剂量依赖性。POPOVICH等[10]研究证明Rh2对结直肠癌细胞具有显著的细胞毒性作用。LEE等[11]指出Rh2还在抑制乳腺癌细胞增殖方面具有较好的作用。以上研究结果证明Rh2作为一种新型抗肿瘤药物可以在多种肿瘤细胞中起到良好的治疗作用。
细胞凋亡也被称为细胞的程序性死亡,分为内源性及外源性凋亡途径两种主要方式[12]。细胞凋亡作用的缺失是肿瘤发生的重要原因之一,而Rh2可以通过促进肿瘤细胞凋亡来达到抗肿瘤的作用[13]。 抗凋亡相关蛋白Bcl-2和凋亡相关蛋白Bax是调节细胞凋亡反应的主要蛋白之一,通过下调Bcl-2,上调Bax蛋白在肿瘤细胞中的表达量可以促进其凋亡反应[14]。本研究发现Rh2可以促进骨肉瘤细胞中Bax蛋白的表达,并下调Bcl-2蛋白的表达,进而起到抗肿瘤的作用。
研究表明GSK-3β/Wnt双信号通路在肿瘤细胞的增殖、迁移、侵袭及细胞的凋亡等方面均有一定的调节作用,在多种肿瘤细胞中均可以发现GSK-3β/Wnt双信号通路及其相关蛋白被大量激活[15]。因此,通过抑制GSK-3β/Wnt信号通路及其相关蛋白的表达即可起到抗肿瘤的作用。本研究发现Rh2可以通过下调β-catenin、Cyclin D1、C-myc蛋白的表达,上调GSK-3β蛋白的表达,进而起到抗肿瘤的作用。
本研究通过使用不同浓度的人参皂苷Rh2处理骨肉瘤细胞以探讨其抗肿瘤的作用。MTT实验结果表明,Rh2对MG63和U2OS骨肉瘤细胞的增殖有显著的抑制作用,且其抑制作用呈时间及剂量依赖性。通过迁移和侵袭实验可以证明Rh2能有效抑制骨肉瘤细胞的转移。通过FITC-Annexin V/PI双染色法检测骨肉瘤细胞的凋亡,结果表明Rh2可以促进骨肉瘤细胞的凋亡反应,进而起到抗肿瘤的作用。本研究还通过Western blot法证明Rh2可调节骨肉瘤细胞中细胞周期相关蛋白、凋亡相关蛋白、转移相关蛋白和GSK-3β/Wnt信号通路相关蛋白的表达来起到抗肿瘤的作用。
