植物源益生乳酸菌的筛选及其特性
2022-10-09聂紫玉吴艳阳王增光李子晗康文丽潘丽娜汪家琦戴智勇赵玲艳邓放明
聂紫玉,吴艳阳,王增光,李子晗,康文丽,潘丽娜,汪家琦,戴智勇,赵玲艳,*,邓放明,*
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.澳优乳业(中国)有限公司,人体微生态制品湖南省工程研究中心,湖南 长沙 410200)
联合国粮农组织和世界卫生组织将益生菌定义为“剂量充足时,对宿主健康有益的活的微生物”。对于益生菌的研究,从1899年发现到目前已有122 年。据统计,2013—2017年,全球益生菌市场价值由320.6亿 美元增至3 472.51亿 美元,增长近10 倍。2017—2020年,中国益生菌产业市场价值由559亿 元增至850亿 元,发展迅速。益生菌具有对抗肠道病原菌与致病微生物菌群竞争黏连的独特能力,可以与致病性微生物群竞争黏附位点进而疏远病原体,或通过在宿主肠道外激活特定基因刺激和调节宿主的免疫反应;益生菌还被证明可以调节脂肪贮存和刺激肠道血管生成、维持肠道菌群的稳定、减少乳糖不耐症、预防抗生素诱发的腹泻、预防结肠癌、提高免疫力、降胆固醇、治疗抑郁症、帕金森症等与大脑神经中枢有关的疾病等;且近年来病毒感染频发,有相关研究表明益生菌或可与病毒发生拮抗。因此,益生菌研究是食品和医药领域热门课题。
乳酸菌是最常见的益生菌,其来源广泛,可从人类、动物、植物和环境中分离出来。传统上,大多数益生菌来自肠道。发酵蔬菜是一种以蔬菜为原料,利用微生物进行发酵的冷加工方式。我国自公元前3世纪就已有发酵蔬菜的生产,且发酵蔬菜种类繁多。自然发酵蔬菜制品是一个较为复杂的微生态环境,其微生物菌群组成既有优势菌群存在的共性,也有样品特异性。在蔬菜的起始发酵和主发酵阶段,占优势的细菌包括肠膜状明串珠菌、短乳杆菌、啤酒片球菌、植物乳杆菌、保加利亚乳杆菌以及粪链球菌等,乳酸菌是所有自然发酵蔬菜中最主要的微生物菌群,因此,发酵蔬菜是重要的乳酸菌分离源,从植物源中分离的乳酸菌主要用作发酵剂或益生菌,目前对植物源益生菌研究较多的是韩国泡菜,而有关中国传统发酵食品的报道较少。植物源乳酸菌相对于动物源乳酸菌具有更高的安全性,但由于分离源的特殊性,植物源乳酸菌能否适应人体肠道环境和表现出益生功能需要进行研究。潜在益生菌筛选的主要指标包括:对胃酸的耐受性、肠道胆盐的耐受性、以及对潜在致病性微生物的抗菌性、抗生素的药物敏感性等。对于选择具有特定作用的益生菌菌株,还可以考虑一些额外的益生菌特性,如降低胆固醇的能力、抗炎抗氧化活性或对癌细胞的细胞毒性作用。工业化生产发酵蔬菜时,一般接种发酵剂,以确保发酵的高效性和安全性,而家庭制备发酵蔬菜都是自然发酵,没有受到商业益生菌的干扰。本实验从农家制备的传统发酵蔬菜中分离乳酸菌,并进行一系列益生特性的初步研究及菌种鉴定,旨在开发具益生潜力的中国本土植物源乳酸菌菌株。
1 材料与方法
1.1 材料与试剂
MRS固体琼脂培养基、改良MC培养基、营养肉汤培养基、革兰氏染色试剂盒、技术琼脂粉、牛胆盐、血平板、赖(酪/组/精)氨酸脱羧酶与氨基酸脱羧酶对照试剂盒广东环凯微生物科技有限公司;抗菌药物药敏纸片杭州微生物试剂有限公司;盐酸、氯化钠、丙三醇、无水乙醇、琼脂糖 国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 东京化成工业株式会社;48、96 孔板无锡耐思生命科技股份有限公司;细菌基因组DNA快速抽提试剂盒、针式滤菌器 美国默克公司;电泳纯化聚合酶链式反应(polymerase chain reaction,PCR)引物 上海派森诺生物科技有限公司;D4030A dNTP、DRR20AM TaKaRa LA聚合酶 宝日医生物技术(北京)有限公司。
1.2 仪器与设备
PHS-2F pH计 上海仪电科学仪器有限公司;ULTS1368超低温冰箱 美国赛默飞世尔公司;全套精密移液枪 德国艾本德股份公司;SQ810C自动高压蒸汽灭菌器 重庆雅玛拓科技有限公司;YP-B10002电子天平 上海光正医疗仪器有限公司;HCB-1300V洁净工作台 青岛海尔生物医疗股份有限公司;CX31光学显微镜 日本奥林巴斯株式会社;Heraeus MultifugeX1R高速冷冻离心机、涡旋振荡仪 赛默飞世尔科技(中国)有限公司;SPL250生化培养箱 天津市莱玻特瑞仪器设备有限公司;TECAN spark多功能酶标仪 西安纵横仪器科技有限公司;MNT-150游标卡尺 上海美耐特实业有限公司;KQ-250DE型数控超声波清洗器昆山市超声仪器有限公司;Mini Pro 300V Power Supply电泳仪 美国Major Science公司;Labnet Sub System 70电泳槽 美国莱伯特公司;UV-1801分光光度计 北京北分瑞利分析仪器(集团)有限公司。
1.3 方法
1.3.1 乳酸菌的分离与形态学鉴定
从中国不同地区采集农户按传统方法自制的发酵蔬菜。采样时用无菌镊子取足量样品至100 mL无菌管内,密封,暂存于低温采样箱中,随后送回实验室。在超净台中用无菌镊子取适量样品于无菌生理盐水中浸泡,用灭菌生理盐水进行10 倍梯度稀释。选取合适浓度的3 个梯度,各取0.1 mL稀释液,在含有碳酸钙的MC培养基平板上进行涂布。生长48 h后挑选有融钙圈且表面光滑的白色、淡黄色菌落划线至MRS培养基,反复划线至纯,待长出后挑选单个菌落进行革兰氏染色并镜检。革兰氏染色结果为阳性且镜检菌体外围无半透明薄膜、无芽孢的判定为乳酸菌。将其菌落挑选至MRS肉汤培养基中培养12 h后,与40%甘油按1∶1保藏至-80 ℃冰箱中。
1.3.2 乳酸菌耐酸性筛选
初筛:菌株活化2 代后,培养12 h,以2%接种量接入用浓盐酸调节至pH 3.0的MRS肉汤培养基中,37 ℃培养12 h后肉眼观察是否有显著沉淀且摇匀后培养液是否显著浑浊。记录浑浊的菌株编号进行复筛。
复筛:菌株活化至稳定,培养12 h后,按1%的接种量接入用浓硫酸调节至pH 2.5的酸性MRS培养基中,分别培养0 h和4 h后进行稀释涂布,待菌落长出后进行计数,按式(1)计算存活率,并按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》方法分别进行活菌数计算,平行3 次。
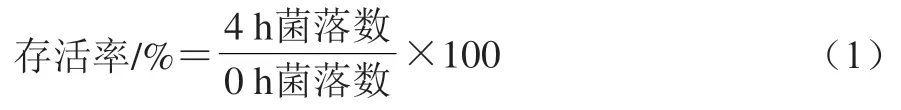
1.3.3 乳酸菌耐胆盐能力筛选
菌株培养至稳定,培养12 h后,取6 mL培养液倒入无菌离心管中,12 000 r/min离心8 min,去除上清液,用生理盐水反复洗涤沉淀物表面,去除杂质,然后加入含0.3%牛胆盐的生理盐水7 mL,制成菌悬液,分别于0 h和2 h进行稀释涂布,培养48 h后平板计数,按式(2)计算存活率,并按照GB 4789.2—2016方法分别进行活菌数计算,平行3 次。

1.3.4 16S rDNA鉴定
按试剂盒步骤提取DNA后进行扩增,乳酸菌引物为通用引物(27F:AGAGTTTGATCCTGGCTCAG;1492R:GGTTACCTTGTTACGACTT),经过电泳检测扩增产物后,送至上海派森诺生物科技股份有限公司测序。综合测序峰图将测序结果截取800 bp的区域,将测序得到的序列在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)中比对,选择相似度最大的序列作为物种鉴定结果。
1.3.5 乳酸菌药敏性实验
采用纸片扩散法,菌株活化3 代离心后弃去上清液,再用生理盐水重悬得到菌悬液。采用比浊法调节菌悬液浓度为1×10CFU/mL左右(=0.5±0.05),吸取1 mL菌悬液于培养皿中,倒入15 mL固体培养基(50 ℃),混匀,待培养基凝固后,在每个培养皿中均匀放置3 张药敏纸片,37 ℃恒温培养48 h后测量抑菌圈直径,并根据表1标准进行药物敏感性判定。

表1 微生物药物敏感实验执行标准Table 1 Criteria for microbial drug susceptibility test
1.3.6 乳酸菌抑菌实验
采用琼脂扩散法。平板中倒入15 mL融化的素琼脂(2%),待其充分冷却凝固后,放入已灭菌的牛津杯数个,并按一定次序排列整齐。将指示菌稀释成合适浓度菌悬液,取该菌悬液l mL与15 mL经融化后保持在45 ℃左右的MRS培养基迅速混合均匀,冷却后用无菌镊子取出牛津杯,即形成若干孔洞。分别向孔洞里加入等量待检菌的离心上清液,37 ℃培养12 h,游标卡尺测量抑菌圈直径。
1.3.7 乳酸菌溶血性实验
取血琼脂培养基,采用点种法,中心以金黄色葡萄球菌为对照,外围取实验乳酸菌菌点种3 次。37 ℃培养48 h,观察实验菌与对照菌溶血情况。
1.3.8 乳酸菌氨基酸脱羧酶活性实验
试剂盒法:菌株活化3 代,培养18 h后,取0.05 mL菌液添加至不同试剂瓶中,并加0.5 mL灭菌液体石蜡封层。37 ℃培养18~24 h后根据说明书观察变色情况。
氨基酸脱羧酶基因、毒力因子检测:参考黄晓棠方法;精氨酸脱羧酶氨基因、毒力因子引物引自文献[30-32]。
1.3.9 乳酸菌DPPH自由基清除能力测定
制备菌悬液,采用比浊法调节浓度至1×10CFU/mL。配制DPPH-无水乙醇溶液0.2 mmol/L,并进行无菌过滤。在避光环境中,按样品+DPPH()、样品+无水乙醇()、纯水+DPPH()分组加入48 孔板中,每组3 个孔。避光反应40 min后,收集液体,离心后取上清液,于517 nm波长处测吸光度。DPPH自由基清除率计算如下:

1.4 数据分析
采用方差分析和最小显著差异法,<0.05,差异显著。分析、计算分别采用DPS数据处理软件和Origin 2018 64Bit。所有测定均为3 次重复取平均。
2 结果与分析
2.1 乳酸菌耐酸能力分析
益生菌要在肠道中发挥作用,必须通过胃液环境。人体空腹时胃液pH值约为1.3~2.0,进食后pH值约为3.0~5.0。益生菌必须在pH 3.0的条件下存活1.5~2 h,故筛选植物源潜在益生菌在胃肠道中的生存和持久性至关重要。由于菌种数目过多,为有效筛选耐酸的乳酸菌,实验初期采用pH 3.0的培养基进行初筛,通过肉眼观察培养基是否浑浊,获得沉淀明显乳酸菌82 株。82 株菌经pH 2.5 MRS培养得乳酸菌49 株(表2)。其中577、602、722、933、755、578、580、582、584、592、594、601这12 株菌在pH 2.5 MRS培养基中培养4 h后活菌数较之前增加,表明具有极强的耐酸能力。

表2 菌株对pH 2.5 MRS培养基的耐受能力Table 2 Survival of strains in MRS medium at pH 2.5
2.2 乳酸菌耐胆盐能力结果
正常人小肠内胆盐质量浓度在0.3~3.0 g/L之间。高浓度胆盐可以拮抗益生菌的生长,因为它们会改变细胞膜的通透性,分解膜蛋白,从而导致细胞破裂和死亡。经pH 2.5 MRS培养得到的49 株乳酸菌进行耐胆盐实验,发现49 株乳酸菌均具有耐胆盐能力,可见耐酸菌株同时具备耐胆盐能力,耐酸与耐胆盐之间可能有某种联系机制。其中来自不同样品的19 株菌株实验结果见表3。19 株菌中有13 株耐胆盐能力极强,2 h后活菌数增加(577、602、664、674、722、6-12、H3D、856、729、727、z1-11、z1-6、z22)(<0.05)。

表3 菌株对0.3%牛胆盐溶液的耐受能力Table 3 Tolerance of strains to 0.3% bovine bile salt solution
2.3 乳酸菌菌株形态及鉴定结果

表4 乳酸菌来源及鉴定结果Table 4 Sources and identification of lactic acid bacteria
将挑选出的19 株乳酸菌进行16S rDNA,鉴定结果见表4。由于菌株来源于发酵蔬菜,所以大部分菌株为植物乳杆菌及发酵乳杆菌,嫩江杆菌、戊糖片球菌、利莫西杆菌、戊糖乳杆菌、屎肠球菌、短乳杆菌分别各1 株。其中577为嫩江杆菌,为中国特有乳酸菌种,因首次分离于黑龙江省嫩江县而得名,1 株从酸菜中分离的嫩江杆菌被证实具有较强低温降解亚硝酸盐的能力,但几乎没有关于其益生特性的研究。z1-11为屎肠球菌,其一般分离自动物,植物源屎肠球菌较少见。胡勇等从青海自然生长的植物花朵中分离鉴定出10 株乳酸菌,其中包括屎肠球菌。利莫西发酵乳杆菌是乳酸杆菌科中的一种厚壁菌,1 株来源于母乳的利莫西发酵乳杆菌被临床证实有抗炎功效。
2.4 乳酸菌安全特性分析
益生菌理论上可能导致全身性感染、有害代谢活动、易感个体过度免疫刺激和轻微胃肠道不适症状4 种副作用。需注意的是,每一种益生菌菌株,包括那些尚未开发的,都可能有不同的安全特性。故对各菌进行安全性测评尤为重要。
2.4.1 乳酸菌对抗生素的耐药性
益生菌中的抗生素耐药基因可转移到某些病原体上,导致病原体耐药性提高。因此,对各菌株进行全面的药敏测试以了解其药敏谱是非常必要的。从表5可看出,本实验供试菌株除729、933外,都对青霉素类的苯唑西林表现敏感,这与Charteris等发现乳酸菌对青霉素和头孢菌素类药物敏感的结果相同。经统计,供试菌株有63.16%对头孢类供试药物表现敏感,且乳酸菌对第1代头孢菌素的敏感性普遍高于第3代产品,与相关报道一致。19 株菌都对红霉素表现敏感或中介,红霉素作为广谱抗生素的抑菌效果已被多次报道证实。供试菌株只有577、602、664、662、6d-16这5 株菌对供试的氨基糖苷类药物表现敏感,据报道,乳酸菌通常对氨基糖苷类(庆大霉素、卡那霉素和链霉素)耐药,因为氨基糖苷的摄取是由细胞色素介导的电子传递,而这在厌氧菌(包括乳酸菌)中不存在。供试菌株对四环素类药物中的米诺环素和多西环素均较敏感,大多数菌株四环素较敏感,但个别菌株对四环素表现出一定的耐药性,这与Dec等研究中乳酸菌对四环素耐药性大于多西环素的结果相似。
综合上述结果,供试乳酸菌对多种药物具有敏感性,其中664、662、577、602、6d-16对20 种药物均敏感。
2.4.2 乳酸菌抑菌能力
供试菌株对李斯特菌、大肠杆菌、金黄色葡萄球菌抑菌能力的检测结果见表6,可见19 株菌对3 种典型致病菌具有不同程度的抑制能力(<0.05)。所有菌株对李斯特菌的抑菌直径在(14.95±0.62)mm以上,最高达到(23.65±0.60)mm,表明具有极强的抑菌作用;所有菌株对大肠杆菌的抑菌直径在(10.98±0.27)~(21.24±0.25)mm之间,表明具有较强的抑菌作用;所有菌株对大肠杆菌的抑菌直径在(15.38±0.32)~(25.50±0.12)mm之间,表明具有极强的抑菌作用。

表5 菌株对抗生素的耐药性Table 5 Antibiotic susceptibility of strains

表6 乳酸菌对致病菌的抑菌直径Table 6 Inhibition zone diameter of lactic acid bacteria against pathogenic bacteria
抑菌性是益生菌的重要特性之一,乳酸菌对病原菌不仅有抑制效果,而且能削弱病原菌的毒力,是制备发酵剂和食品生物防腐剂的理想选择。乳酸菌的抗菌活性主要来源于其代谢产生的HO、有机酸(乳酸、乙酸和甲酸)、蛋白质类化合物、小分子肽及乳酸。乳酸菌在宿主肠道中定植后,会产生超氧阴离子自由基并通过呼吸作用转化为毒性较小的过氧化氢,过氧化氢的持续积累抑制了其他细菌的生长;一些非均相发酵的乳酸菌通过代谢己糖产生CO,降低环境中氧气浓度,产生厌氧环境,抑制有害需氧细菌的生长;乳酸菌还能通过糖酵解代谢柠檬酸产生双乙酰,抑制多种有害微生物。
2.4.3 乳酸菌溶血性分析

图1 菌株溶血性观察结果Fig. 1 Hemolytic activity observation of strains
一些菌株在血平板上培养时,菌落周围会形成明显的透明溶血环,根据使绵羊血细胞琼脂溶血的能力分类为完全溶血(β溶血)、部分溶血(α溶血)和不溶血(γ溶血),α溶血的链球菌呈现半透明草绿色溶血环,β溶血的链球菌呈现透明溶血环,大多数溶血性菌株是致病性的。供试菌株的溶血性实验结果见图1,可看出平板中心的指示菌(金黄色葡萄球菌)产生了明显的溶血环,而周围的3 个供试菌株的菌落无溶血环,故19 株菌皆无溶血性。一般认为乳酸菌属是安全的共生菌,缺乏溶血素,不会产生机会性毒力,符合食品安全的要求。
2.4.4 乳酸菌氨基酸脱羧酶活性
食品中的生物胺大部分由微生物脱羧氨基酸形成,它的产生需耍3 个条件:足够的氨基酸、有氨基酸脱羧酶活性的微生物和利于微生物生长的低酸环境。常见产生物胺菌株有乳酸杆菌属、肠杆菌属、肠球菌属和乳杆菌属。适量生物胺有利于人体的正常生理活动,一旦过量则会对人体产生不利影响,故产生物胺能力也是选择发酵乳酸菌和益生菌的标准之一。由于对人体健康威胁较大的组胺、酪胺、腐胺和尸胺的前提物质分别为组氨酸、酪氨酸、精氨酸与赖氨酸,因此本实验对供试菌株这4 种氨基酸脱羧酶活性进行检测。发现722、647、z1-6、729、6-12、577、yz16-3、856的精氨酸脱羧酶呈阳性(图2),其余皆为阴性。

图2 精氨酸脱羧酶阳性对照结果Fig. 2 Evaluation of arginine decarboxylase activity of strains
精氨酸脱羧酶可与腐胺、精胺、亚精胺的生成有关。氨基酸脱羧酶试剂瓶显色是一种简便快速的方法,却也有一定的局限性,易受环境影响,为进一步确定菌株是否具有氨基酸脱羧酶活性,利用PCR法在基因层面对试剂瓶阳性的菌株进行检测。基因扩增电泳图(图3)显示,8 株乳酸菌均不携带氨基酸脱羧酶基因(精氨酸脱羧酶基因;组氨酸脱羧酶基因、、;酪氨酸脱羧酶基因、、)及毒力因子(asal、esp、ace、gelE、cylA、cylB、cylM)。


图3 乳酸菌基因扩增电泳图Fig. 3 Electrophoretic patterns of amplified lactic acid bacterial genes
2.5 乳酸菌体外抗氧化能力
DPPH自由基清除实验是目前乳酸菌的抗氧化作用研究中最常用的方法,据文献报道,乳酸菌的DPPH自由基清除率高于40%则可认为其体外抗氧化能力较强。由图4可看出,z1-6、H3D、856、6D-16、z1-11的DPPH自由基清除率分别为(45.28±5.43)%、(43.01±6.58)%、(46.52±2.51)%、(51.07±6.50)%、(59.41±0.32)%(<0.05),表明体外抗氧化能力较强,可考虑用作进一步抗氧化研究。

图4 各菌株对DPPH自由基的清除效果Fig. 4 DPPH radical scavenging effect of each strain
3 结 论
以传统发酵蔬菜中分离的乳酸菌为出发菌株,经pH 3.0 MRS培养得乳酸菌82 株,再经pH 2.5 MRS培养得乳酸菌49 株;49 株菌经0.3%胆盐测试,均具有耐胆盐能力,表明植物源乳酸菌具有益生菌的基本特性;根据镜检形态结合植物源发酵样品的不同,从耐酸耐胆盐菌株中挑选19 株乳酸菌,经生理生化实验、形态观察和16S rDNA鉴定,7 株为发酵乳杆菌、6 株为植物乳杆菌,嫩江杆菌、戊糖片球菌、利莫西杆菌、戊糖乳杆菌、屎肠球菌、短乳杆菌分别各1 株,其中577为嫩江杆菌,属中国特有乳酸菌种属。19 株乳酸菌对所选20 种抗生素多数表现敏感,其中4 株菌对20 种抗生素都较敏感,部分菌株对氨基糖苷类表现出一定抗药性,可能由于氨基糖苷类药物本身特点是对厌氧菌和肠球菌无效,对李斯特菌、大肠杆菌、金黄色葡萄球菌具有较强的抑制能力,且在血平板中均没有表现出溶血性;经氨基酸脱羧酶活性试剂盒结合PCR扩增检测表明无产生物胺的潜在威胁;以上研究表明19 株菌具有益生菌的安全特性;体外DPPH自由基清除实验中,有5 株菌体外抗氧化能力高于40%;综上所述,该19 株菌均可做为潜在益生菌。由此可见,我国传统发酵蔬菜是益生菌选育的重要来源之一。
