铁过载对肝LO2细胞糖代谢关键酶活性的影响*
2022-10-08陶秀娟刘贺荣蔡慧珍范彦娜高清菡杨建军
陶秀娟,刘贺荣,蔡慧珍,范彦娜,高清菡,杨建军
(宁夏医科大学公共卫生与管理学院,银川 750004)
近几十年来,2型糖尿病的患病人数在全世界都明显上升[1]。据估计到2040年,全球成年糖尿病患者的比例将增加到10.4%,即6.42亿糖尿病患者[2]。近年来,关于铁过载与糖尿病关系的研究已逐渐成为糖尿病相关研究领域的热点。体内铁过载可能是引起2型糖尿病发病的独立危险因素之一,机体铁储存量愈多,发生葡萄糖耐量异常、2型糖尿病或妊娠糖尿病的风险也愈大[3-5]。临床研究或动物实验均提示,机体铁过载是糖尿病发病的危险因素,各种因素导致的铁过载在糖尿病发生、发展过程中均扮演着重要的角色[6-8]。体内铁含量的升高可导致葡萄糖代谢的紊乱,其机制可能与胰岛素分泌受损或胰岛素抵抗有关[9]。肝脏是铁代谢的主要器官,也是铁蓄积产生毒害的首要靶器官,铁过载产生的活性氧通过肝脏激酶-B1/丝裂原活化蛋白激酶信号通路抑制胰岛素受体在肝脏等组织中的磷酸化,降低胰岛素受体的敏感度[10]。但肝脏铁过载是否能引起肝细胞糖代谢关键酶活性的改变从而诱发肝脏糖代谢紊乱的相关报道尚少见。因此,本研究拟通过用不同浓度枸橼酸铁铵(ferric ammonium citrate,FAC)干预肝LO2细胞,探讨铁过载对LO2细胞活性氧水平及葡萄糖代谢关键酶活性的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1试剂与仪器
RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶购自上海逍鹏生物科技有限公司;FAC购自美国MedChemexpress生物科技公司;去铁胺(desferrioxamine,DFO)购自美国Sigma-aldrich生物科技有限公司;细胞计数试剂盒(CCK-8)购自江苏凯基生物技术有限公司;人葡萄糖激酶(glucokinase,GK)酶联免疫分析试剂盒、人丙酮酸激酶(pyruvate kinase,PK)酶联免疫分析试剂盒购自上海酶联生物科技有限公司;活性氧(reactive oxygen species,ROS)试剂盒购自上海碧云天生物技术有限公司。Multiskan GO型酶标仪(美国Thermo Fisher Scientific公司);CO2培养箱(上海力申科学仪器有限公司);F-4600型荧光分光光度计(日本日立公司)。
1.1.2细胞株
人肝LO2细胞株购自中国科学院上海细胞生物研究所细胞库,培养于含有10%胎牛血清和1%双抗的RPMI 1640培养基,于37 ℃、5% CO2饱和湿度的培养箱中培养,待细胞贴壁长至70%左右传代,待细胞生长密度达到1×104个/mL时用于实验。
1.2 方法
1.2.1LO2细胞分组与处理
取生长状态良好LO2细胞胰酶消化后,取1×104/mL的细胞悬液,按检测指标所需分别接种于无菌的96孔、12孔培养板内。以含10% FBS的RPMI 1640培养基培养24 h后,实验分为5组,每组设5个复孔。(1)对照组:正常接种的LO2细胞+RPMI 1640培养基;(2)低剂量干预组:正常接种的LO2细胞+含7.5 mmol/L FAC的RPMI 1640培养基;(3)中剂量干预组:正常接种的LO2细胞+含75 μmol/L FAC的RPMI 1640培养基;(4)高剂量干预组:正常接种的LO2细胞+含750 μmol/L FAC的RPMI 1640培养基;(5)DFO处理组:正常接种的LO2细胞+含75 μmol/L FAC的RPMI 1640培养基干预18 h,加DFO(250 μmol/L)。
1.2.2检测指标与方法
1.2.2.1LO2细胞活力检测(CCK-8法)
取对数生长期LO2细胞,按照每孔5×103个细胞量接种于96孔板,待细胞贴壁后分5组干预。各组细胞每孔加入10 μL的CCK-8试剂,放入37 ℃,5% CO2饱和湿度的培养箱内培养24 h,酶标仪测定在450 nm波长处测定吸光度(A)值。细胞活力(%)=[A(加药)—A(空白)]/[A(0加药)—A(空白)]×100。A(加药):具有细胞、CCK8溶液和药物溶液的孔的A值;A(空白):具有培养基和CCK-8溶液而没有细胞的孔的A值;A(0加药):具有细胞、CCK8溶液而没有药物溶液的孔的A值。
1.2.2.2ELISA检测LO2细胞GK、PK活性
取对数生长期LO2细胞按每孔2×106个接种于12孔板,预先置于37 ℃,5% CO2饱和湿度的培养箱内培养24 h,待细胞贴壁后分组干预。将干预好的细胞从培养箱中拿出,胰蛋白酶消化后离心5 min(1 000 r/min)磷酸盐缓冲液冲洗2次,并稀释细胞悬液使浓度达1×107/mL放入离心管。通过反复冻融,破坏细胞,2 000 r/min离心20 min,仔细收集上清液待检。采用ELISA法,按照人GK、PK活性检测试剂盒说明书进行操作。
1.2.2.3LO2细胞ROS水平检测
取对数生长期LO2细胞按每孔2×106个接种于12孔板,预先置于37 ℃,5% CO2饱和湿度的培养箱内培养24 h,待细胞贴壁后分组干预。按照ROS检测试剂盒安装荧光探针2,7-二氯荧光素二乙酸酯(DCFH-DA)后,收集细胞后用荧光分光光度计检测,设置激发波长488 nm,发射波长525 nm,检测各组细胞荧光强度。
1.3 统计学处理
2 结 果
2.1 铁过载对肝正常细胞LO2生物活性的影响
各组细胞活性比较,差异无统计学意义(F=2.710,P=0.070),见图1。

图1 铁过载对肝LO2细胞活力的影响(n=4)
2.2 铁过载对正常肝LO2细胞葡萄糖代谢关键酶活性的影响
中、高剂量干预组细胞GK活性低于对照组,高剂量干预组PK活性低于对照组,差异有统计学意义(P<0.05);DFO处理组GK、PK活性高于中剂量干预组,但差异无统计学意义(P>0.05),见图2、3。
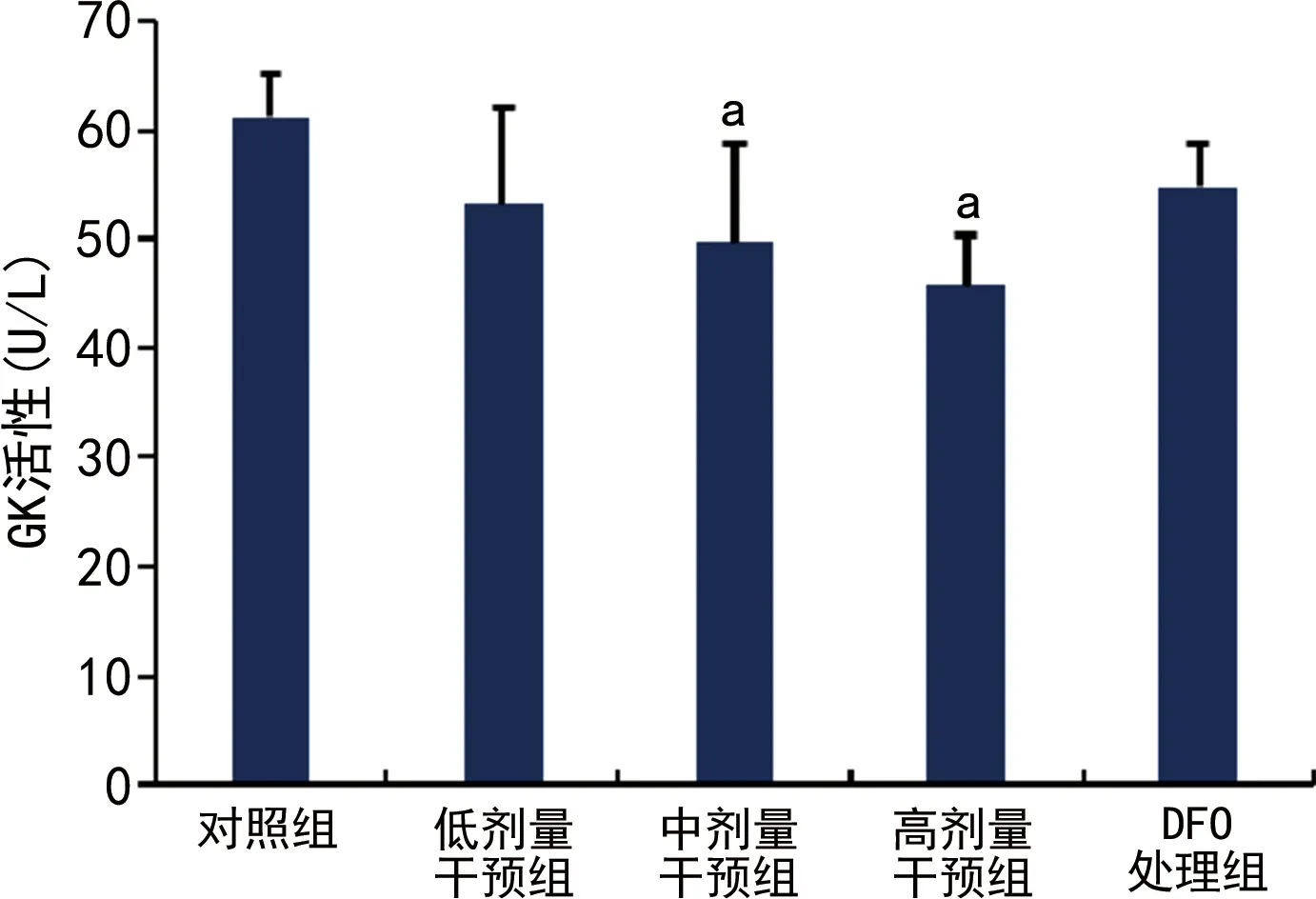
a:P<0.05,与对照组比较。
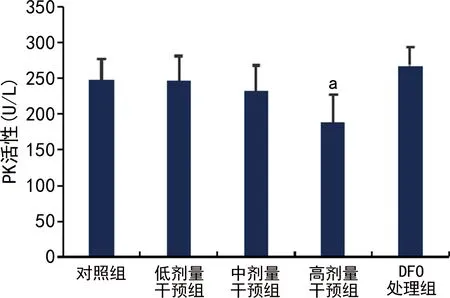
a:P<0.05,与对照组比较。
2.3 铁过载对正常肝LO2细胞活性氧水平的影响
高剂量干预组细胞内ROS水平高于对照组,差异有统计学意义(P<0.05),见图4。
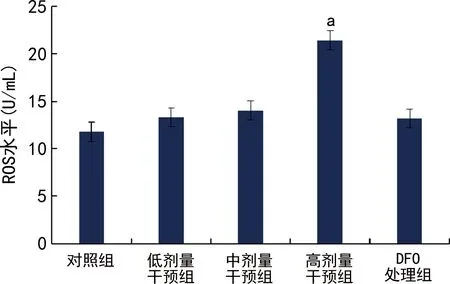
a:P<0.05,与对照组比较。
3 讨 论
铁是人体必需的微量元素,在机体吸收、利用、储存及循环利用过程中维持着稳态水平。高铁负荷和铁代谢障碍疾病已经被证明和糖代谢异常发病风险的增高有关[11]。多个流行病研究显示铁过载与胰岛素抵抗相关,其机制可能有多种[12-15]。
肝脏是铁代谢的主要器官,也是铁蓄积产生毒害的首要靶器官。肝铁聚集与高铁蛋白血症、胰岛素抵抗、非酒精性脂肪肝有关[16-17]。在前期研究的基础上,本研究以不同浓度FAC干预肝LO2细胞,在各组细胞FAC干预后细胞活性无差异的前提下,检测各组细胞ROS水平,发现高剂量干预组细胞内ROS水平明显高于对照组,差异有统计学意义(P<0.05),说明LO2细胞铁负荷达到一定水平后,打破了机体内ROS产生与机体ROS自我清除之间的相对平衡,可能对细胞造成过氧化损伤。
GK是一种己糖激酶,特异性存在于胰岛β细胞和成熟肝细胞中。前者是催化胰岛素分泌的限速步骤,后者参与糖原合成,因此,在糖代谢中发挥着重要作用。在GK基因中已经发现了大量致病突变。在临床中,激活突变表现为先天性高胰岛素血症,而功能丧失突变会导致糖尿病[18]。通过GK传感器的作用,人体不同细胞、器官形成了一个紧密调控和稳定的葡萄糖稳态网络系统,始终维持人体血糖稳态[19]。本研究发现,GK在中、高剂量干预组活性下降,而在DFO处理组GK活性有所上升,可能的原因是DFO通过螯合铁离子,降低了细胞ROS的产生,避免其对细胞产生氧化损伤,从而降低了铁对GK活性的影响。
PK是糖酵解途径的关键酶之一,催化磷酸烯醇式丙酮酸形成丙酮酸并生成ATP[20]。本研究发现PK在高剂量干预组活性下降。当肝细胞内GK与PK活性下降时,会导致糖原合成与葡萄糖利用减少,最终引起糖代谢紊乱,与胰岛素抵抗的发生、发展密切相关[21]。
综上所述,75、750 μmol/L FAC干预的细胞内GK、PK活性降低,可能是导致细胞糖代谢紊乱的原因之一,但其机制也有待进一步研究。
