阿尔茨海默病患者血清LncRNA MALAT1、LncRNA NEAT1的表达变化及临床意义*
2022-10-08王锋存赵秀丽刘军莉
王锋存,赵秀丽,刘军莉
(青海大学附属医院1.神经内科;2.老年病科,青海西宁 810001)
阿尔茨海默病(Alzheimer's disease, AD)是以进行性认知功能障碍和行为损害为主要特征的中枢神经系统变性疾病,起病隐匿,病程慢性迁延并进行性发展,严重影响患者生活质量[1]。目前尚未完全明确AD 发病机制,近年研究证实神经免疫炎症反应在其中发挥重要作用,以小胶质细胞激活和炎症细胞因子表达为主要特征[2-3]。长链非编码RNA(long non-coding RNA, LncRNA)是一类不编码蛋白质的RNA,转移相关的肺腺癌转录本1(metastasis associated lung adenocarcinoma transcript 1, MALAT1)和核旁斑组装转录本1(nuclear paraspeckle assembly transcript 1, NEAT1)是近年来受到广泛关注的LncRNA,研究指出LncRNA MALAT1 通过抑制核因子E2 相关因子2 表达,LncRNA NEAT1 通过激活Wnt/β-连环蛋白信号通路参与小胶质细胞激活和神经炎症损伤[4-5]。目前关于LncRNA MALAT1、LncRNA NEAT1 与AD 患者炎症因子和认知功能的关系鲜有报道。本研究分析AD 患者血清LncRNA MALAT1、LncRNA NEAT1 的表达变化,探讨其是否参与AD 炎症反应和认知功能损伤。
1 资料与方法
1.1 一般资料
选取2018年1月—2021年1月青海大学附属医院收治的AD 患者93 例为AD 组。其中,男性51 例,女性42 例;年龄48~84 岁,平均(64.88±7.36)岁;体质量指数18~28 kg/m2,平均(23.47±2.20)kg/m2;病程1~11年,平均(5.24±1.18)年;文化程度:初中及以上65 例,小学28 例。纳入标准:①符合《美国精神障碍诊断与统计手册(第4 版)》[6]的AD 诊断标准;②MRI 或CT 脑改变或脑萎缩;③临床资料完整;④患者监护人均知情研究。排除标准:①神经活性药物滥用史;②脑血管疾病、颅脑外伤等导致的认知功能损害;③严重感染疾病;④合并自身免疫性疾病;⑤合并心、肝、肾等器质性病变;⑥其他精神疾病;⑦存在攻击行为或自杀倾向。另选取同期本院54 例体检健康者为对照组。其中男性34 例,女性20 例;年龄54~86 岁,平均(65.25±8.14)岁;体质量指数18~28 kg/m2,平均(23.54±2.17)kg/m2;文化程度:初中及以上38 例,小学16 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 血清指标检测
采集受试者静脉血,以3 000 r/min 离心10 min,离心半径10 cm,取上清液,置于-80℃冰箱冷冻保存待检。取部分血清,采用TRIzol 试剂盒提取血清总RNA,TaKaRa 逆转录试剂盒转录合成cDNA,Narodrop 验证cDNA 浓度及纯度,使OD260/OD280 为1.8~2.0,进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRTPCR)扩增。 LncRNA MALAT1 正向引物:5'-GCTCTAGACGCAGCCTCCAGCCCGAGACTTCT-3',反向引物:5'-CGGGATCCGTAGGGCTTCTCAAAACACC AGCT-3',长度均296 bp;LncRNA NEAT1 正向引物:5'-CTTCCTCCCTTTAACTTATCCATTCAC-3',反向引物:5'-CTCTTCCTCCACCATTACCAACAATAC-3',长度均244 bp。反应条件:95℃预变性90 s、95℃变性30 s、63℃退火30 s、72℃拉伸15 s,共40 个循环。以GAPDH作为内参校正,正向引物:5'-TATGAT GATATCAAGAGGGTAGT-3',反向引物:5'-TGTATCCAAACTCATTGTCATAC-3',长度均22 bp。2-ΔΔCt法计算血清LncRNA MALAT1、LncRNA NEAT1相对表达量。剩余血清采用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测超敏C 反应蛋白(high-sensitivity C-reactive protein, hs-CRP),白细胞介素-1β(Interleukin-1β, IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)水平,试剂盒购自上海延慕实业有限公司,所有操作严格按照试剂盒说明书进行。
1.3 认知功能评估
采用简易精神状态量表(mini-mental state examination, MMSE)[7]评估受试者认知功能,包括6个维度共30 个条目,分值0~30 分,分值越高则认知功能越好,初中及以上受教育程度患者<24 分、小学<20 分、文盲<17 分视为认知功能障碍。
1.4 统计学方法
数据分析采用SPSS 26.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数间距M(P25,P75)表示,比较用t检验或秩和检验;相关性分析用Pearson 或Spearman 法;绘制受试者工作特征(receiver operating characteristic, ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清 LncRNA MALAT1、LncRNA NEAT1相对表达量和MMSE评分比较
两组血清LncRNA MALAT1、LncRNA NEAT1 相对表达量和MMSE 评分比较,差异有统计学意义(P<0.05),AD 组血清LncRNA MALAT1 相对表达量和MMSE 评分低于对照组,LncRNA NEAT1 相对表达量高于对照组。见表1。

表1 两组血清LncRNA MALAT1、LncRNA NEAT1相对表达量和MMSE评分比较
2.2 两组血清炎症因子水平比较
两组hs-CRP、IL-1β、IL-6、TNF-α 水平比较,差异有统计学意义(P<0.05),AD 组高于对照组。见表2。
表2 两组血清炎症因子水平比较 (pg/mL,±s)
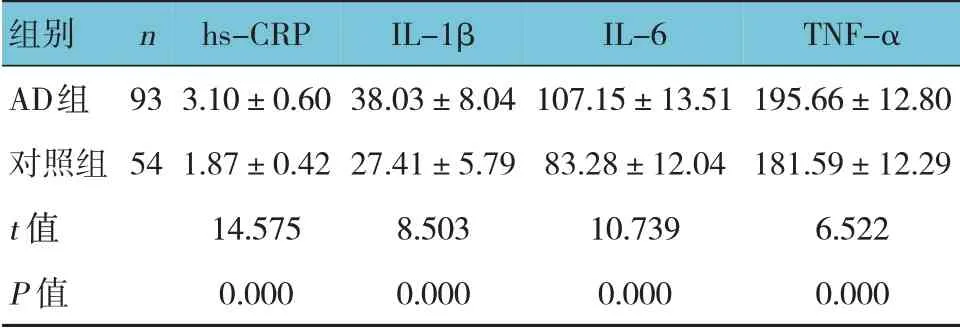
表2 两组血清炎症因子水平比较 (pg/mL,±s)
组别AD组对照组t 值P 值n 93 54 hs-CRP 3.10±0.60 1.87±0.42 14.575 0.000 IL-1β 38.03±8.04 27.41±5.79 8.503 0.000 IL-6 107.15±13.51 83.28±12.04 10.739 0.000 TNF-α 195.66±12.80 181.59±12.29 6.522 0.000
2.3 AD 患者血清LncRNA MALAT1、LncRNA NEAT1 表达与病程、MMSE 评分和炎症因子的相关性
Pearson 或Spearman 相关性分析显示,AD 患者血清LncRNA MALAT1 表达与MMSE 评分呈正相关(rs=0.587,P=0.000),与hs-CRP、IL-1β、IL-6、TNF-α水平均呈负相关(rs=-0.522、-0.601、-0.574和-0.577,均P=0.000),LncRNA NEAT1 表达与MMSE 评分呈负相关(rs=-0.593,P=0.000),与hs-CRP、IL-1β、IL-6、TNF-α 均呈正相关(r=0.487、0.588、0.611 和0.573,均P=0.000)。
2.4 血清炎症指标和LncRNA MALAT1、LncRNA NEAT1表达对AD的诊断价值
ROC 曲线显示,血清LncRNA MALAT1 诊断AD的AUC 为0.915(95% CI:0.858,0.955),最佳临界值为0.98,其对应的敏感性为94.62%(95% CI:87.92,98.22),特异性为81.48%(95% CI:68.61,90.70);血清LncRNA NEAT1 诊断AD 的AUC 为0.858(95% CI:0.791,0.910),最佳临界值为2.37,其对应的敏感性为90.32%(95% CI:82.45,95.52),特异性为72.22%(95%CI:58.44,83.57)。见表3 和图1。
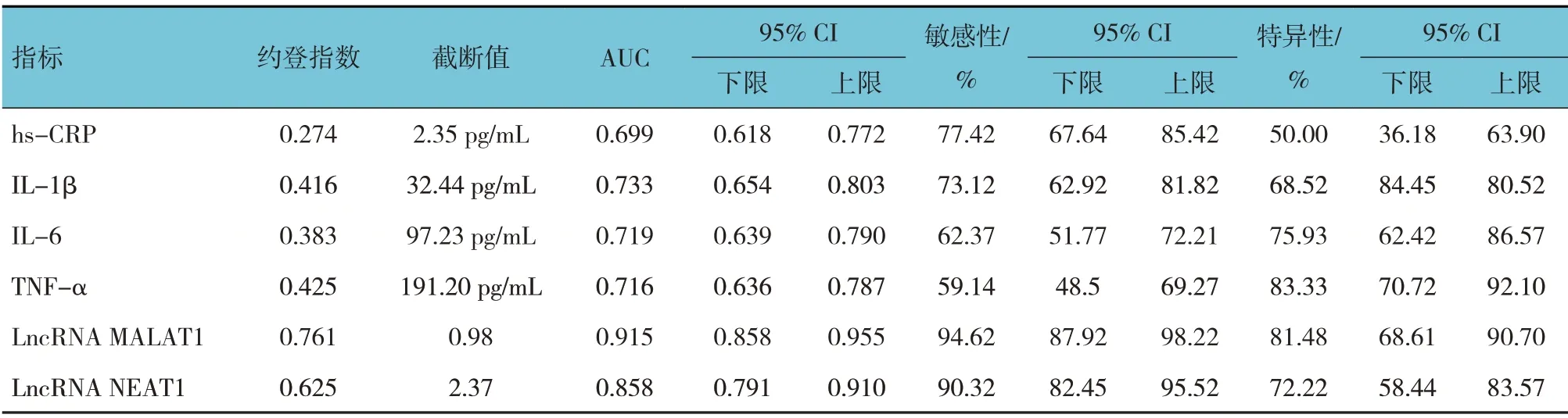
表3 血清炎症指标和LncRNA MALAT1、LncRNA NEAT1表达诊断AD的效能分析
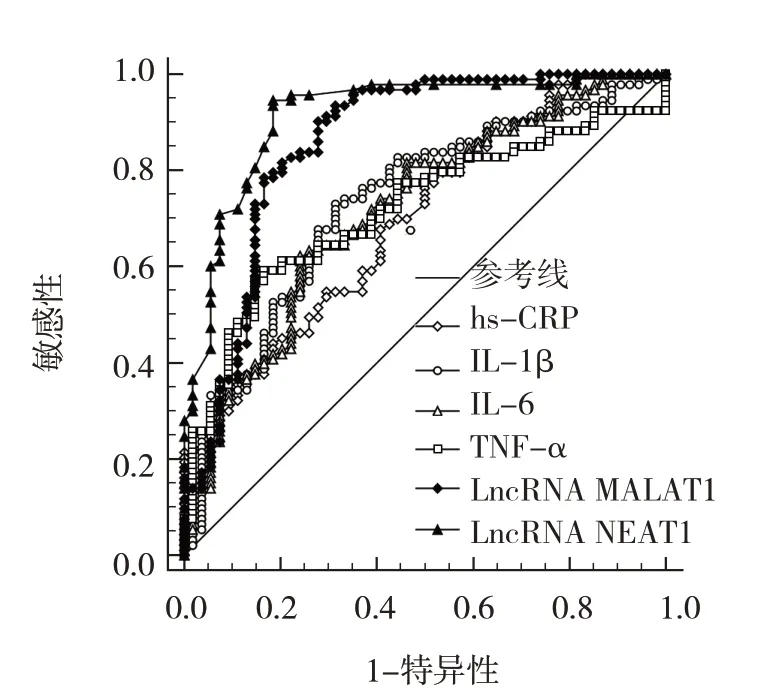
图1 血清炎症指标和LncRNA MALAT1、LncRNA NEAT1表达诊断AD的ROC曲线
3 讨论
AD 是导致老年人失能的重要原因,发病率逐年增高,2020年我国AD 患者约900 万,到2050年预计将增加至2 100 万[8]。早期识别AD 有助于改变脑结构、功能和行为水平的可塑性,延缓病情进展,减轻功能障碍,增强患者社会参与力,改善生活质量。目前尚未完全明确AD 发病机制,主流观点认为错误折叠的β-淀粉样蛋白(amyloid βprotein, Aβ)于大脑中沉积形成淀粉样蛋白斑块和Tau 蛋白过度磷酸化导致的神经纤维纠缠是AD 最主要的病理特征[9]。研究发现,Aβ 斑块沉积周围存在大量活化小胶质细胞,与Aβ 大量产生导致小胶质细胞过度激活有关,小胶质细胞过度激活介导的炎症反应又能诱导Aβ 大量产生,形成恶性循环参与AD 进展[10]。近年实验也表明,非甾体类抗炎药能显著改善Aβ 沉积和认知功能[11]。上述研究提示神经炎症反应参与AD 病理、生理过程,研究其相关细胞因子对AD 早期诊断、治疗具有重要意义。
LncRNA 是一类转录本>200 个核苷酸的非编码RNA,携带多种信息并具有重要调节功能,已被证实参与脑卒中、AD、帕金森等多种神经炎症反应疾病过程[3]。LncRNA MALAT1 位于染色体11q13.1,首次由JI 等[12]在非小细胞肺癌中发现,并认为是非小细胞肺癌预后标志物。近年来大量研究证实LncRNA MALAT1 还参与其他恶性肿瘤进展,并参与其他非肿瘤疾病发生、发展过程。SHANG 等[13]研究显示,脑缺血或再灌注损伤小鼠模型海马中LncRNA MALAT1 表达下调,增加LncRNA MALAT1表达具有抑制神经元凋亡、缩小梗死体积、改善学习和记忆功能等作用。PATEL 等[14]研究显示,创伤性脑损伤大鼠模型脑组织LncRNA MALAT1 表达下调,增加LncRNA MALAT1 表达能抑制脑组织中IL-1β、TNF-α 等炎症细胞因子表达,抑制神经炎症。上述研究提示LncRNA MALAT1 与神经炎症反应和认知功能密切相关。本研究结果显示,AD 组血清LncRNA MALAT1 表达低于对照组,提示LncRNA MALAT1 参与AD 发病过程。MMSE 为临床AD 患者智力状态和认知功能评估方式,hs-CRP、IL-1β、IL-6、TNF-α 是AD 患者血清中常见异常炎症细胞因子。本研究结果证实,LncRNA MALAT1低表达与AD 患者炎症反应升高和认知功能降低密切相关,其机制可能与AD 患者脑组织炎症反应引起LncRNA MALAT1 表达抑制,LncRNA MALAT1 低表达导致miR-125b 表达升高。miR-125b 作为AD 重要的生物标志物,在促进Aβ 大量分泌、抑制神经突生长、诱导神经元凋亡等方面发挥关键作用[15]。研究表明,LncRNA MALAT1 能靶向下调miR-125b表达,降低IL-6、TNF-α 表达,抑制AD 模型神经炎症和凋亡,促进神经突生长[16]。
LncRNA NEAT1 也位于人染色体11q13.1,因该染色体是癌症多发的基因位点,因此近年来大量研究报道了其在癌症中的作用,如LncRNA NEAT1能通过海绵miR-486-5p 调节核受体4A1/Wnt/β-连环蛋白信号通路,促进结直肠癌细胞增殖、迁移和侵袭[17]。近年研究发现,LncRNA NEAT1 还参与中枢神经系统疾病,如KUKHARSKY 等[18]研究显示,敲除小鼠LncRNA NEAT1 基因可损害小鼠社交能力,但对小鼠认知功能、运动功能无影响。NI等[19]研究显示,敲低脑缺血或再灌注损伤小鼠LncRNA NEAT1 可抑制小胶质细胞向促炎M1 表型极化,抑制神经元凋亡。有研究显示,LncRNA NEAT1 能靶向miR-107 加重Aβ 过度沉积诱导的神经元损伤[20]。本研究结果显示,AD 组血清LncRNA NEAT1 表达高于对照组,提示LncRNA NEAT1 参与AD 发病过程。进一步分析证实,LncRNA NEAT1过表达与AD 患者炎症反应和认知功能降低密切相关,其机制可能与LncRNA NEAT1 可促进小胶质细胞向促炎表型极化,释放炎症细胞因子,损害神经功能有关[18]。β 分泌酶1 是IL-6、TNF-α 等炎症细胞因子诱发的AD 重要促进因子,能通过增加Aβ表达参与AD 发生、发展[21]。研究发现,LncRNA NEAT1 能通过海绵miR-124 上调β 分泌酶1 表达[22]。提示LncRNA NEAT1 高表达还可能通过增加Aβ 表达诱导小胶质细胞过度活化,释放炎症细胞因子,参与AD 发生、发展。笔者评估了血清炎症指标和LncRNA MALAT1、LncRNA NEAT1 表达对AD 的诊断价值,结果显示LncRNA MALAT1、LncRNA NEAT1 表达诊断AD 的AUC 分别为0.915 和0.858,显著大于血清hs-CRP、IL-1β、IL-6、TNF-α 水平,说明血清LncRNA MALAT1、LncRNA NEAT1 表达对AD 具有良好的诊断价值。
综上所述,AD 患者血清LncRNA MALAT1 低表达,LncRNA NEAT1 高表达,两者可能参与AD 炎症反应和认知功能损伤,可作为AD 诊断标志物。但本研究样本量有限,且有关LncRNA MALAT1、LncRNA NEAT1 与AD 的作用机制尚未完全明确,还需进一步研究。
